- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии 8 класс Вещество (повторение)
Содержание
- 1. Презентация к уроку химии 8 класс Вещество (повторение)
- 2. Атом–это наименьшая частица химического элемента, являющаяся носителем
- 3. Молекула – наименьшая электронейтральная частица вещества, обладающая всеми его химическими свойствами, физически неделимая, но делимая химически.
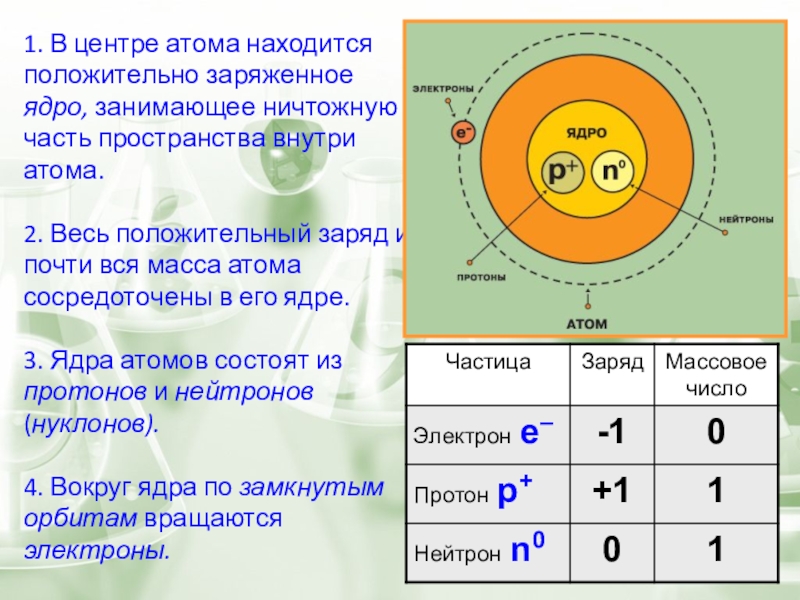
- 4. 1. В центре атома находится положительно заряженное
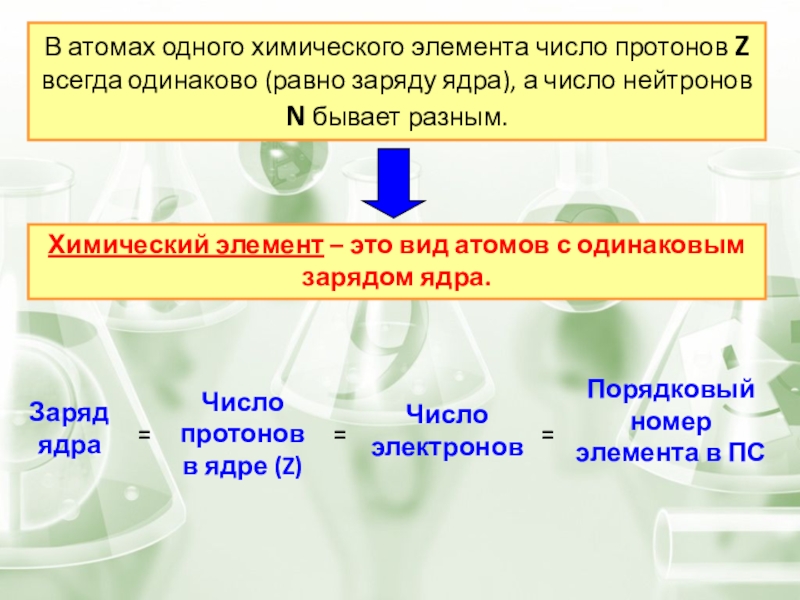
- 5. В атомах одного химического элемента число протонов
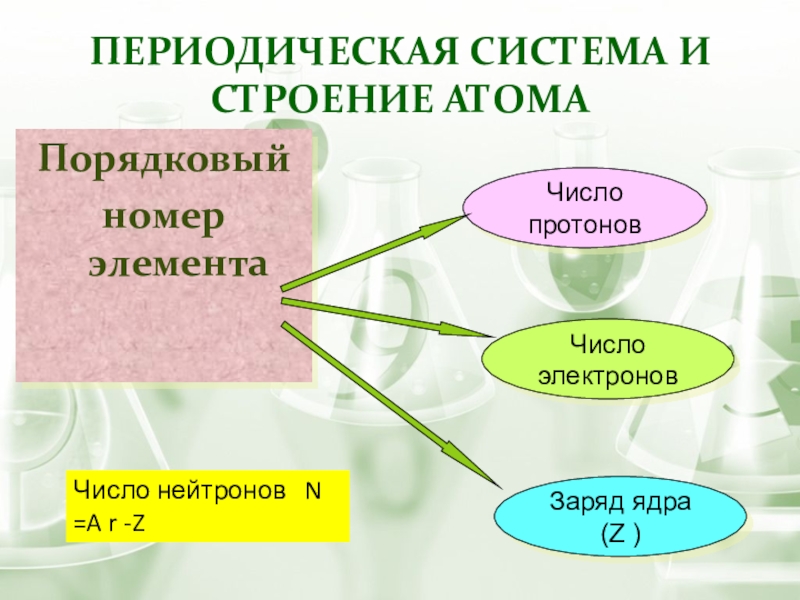
- 6. Периодическая система и строение атомаПорядковыйномер элемента Число
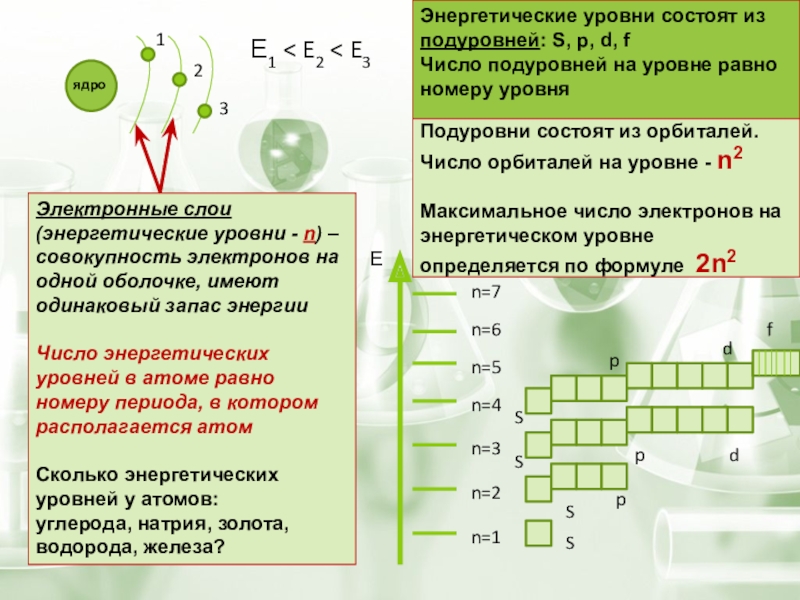
- 7. Подуровни состоят из орбиталей. Число орбиталей на
- 8. Как определить вид связи в веществе?Определите природу
- 9. Энергетические уровни, содержащие максимальное число электронов, называются
- 10. Область наиболее вероятного местонахождения электрона в пространствеФорма
- 11. Относительная молекулярная масса вещества (Mr ) – это
- 12. Слайд 12
- 13. Восстановительные свойства атомов (способность терять электроны при
- 14. Электроотрицательность в периоде увеличивается с возрастанием заряда
- 15. В одной и той же группе с
- 16. Химическая связьВодороднаяМеталлическаяКовалентнаяИонная
- 17. Валентность –способность атомов присоединять к себе определенное число других атомов
- 18. Валентность Постоянная Переменная I – H, F,
- 19. Связь в металлах между атомами и ионами, образованная за счет обобществления электронов, называетсяметаллической.
Слайд 2Атом
–это наименьшая частица химического элемента, являющаяся носителем его свойств. Атом построен
Слайд 3Молекула
– наименьшая электронейтральная частица вещества, обладающая всеми его химическими свойствами, физически
Слайд 41. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть
2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре.
3. Ядра атомов состоят из протонов и нейтронов (нуклонов).
4. Вокруг ядра по замкнутым орбитам вращаются электроны.
Слайд 5В атомах одного химического элемента число протонов Z всегда одинаково (равно
Химический элемент – это вид атомов с одинаковым зарядом ядра.
Слайд 6Периодическая система и строение атома
Порядковый
номер элемента
Число протонов
Число электронов
Заряд ядра (Z
Число нейтронов N =A r -Z
Слайд 7
Подуровни состоят из орбиталей. Число орбиталей на уровне - n2
Максимальное
1
2
3
Е1 < E2 < E3
Электронные слои (энергетические уровни - n) – совокупность электронов на одной оболочке, имеют одинаковый запас энергии
Число энергетических уровней в атоме равно номеру периода, в котором располагается атом
Сколько энергетических уровней у атомов:
углерода, натрия, золота, водорода, железа?
Энергетические уровни состоят из подуровней: S, p, d, f
Число подуровней на уровне равно номеру уровня
Е
n=1
n=2
n=3
n=4
n=5
n=6
n=7
S
p
d
f
S
S
S
p
p
d
ядро
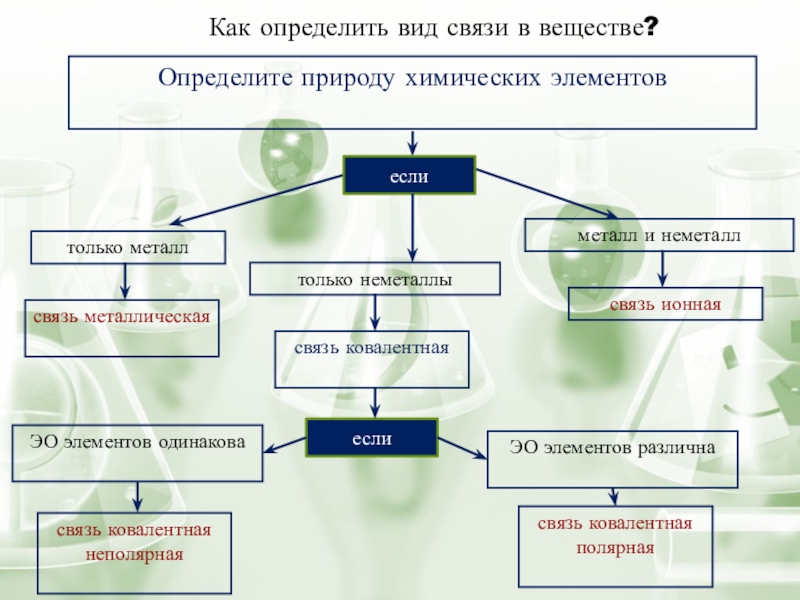
Слайд 8Как определить вид связи в веществе?
Определите природу химических элементов
если
только металл
только неметаллы
металл
если
связь металлическая
связь ковалентная
связь ионная
связь ковалентная полярная
связь ковалентная неполярная
ЭО элементов одинакова
ЭО элементов различна
Слайд 9Энергетические уровни, содержащие максимальное число электронов, называются завершенными. Они обладают повышенной
Энергетические уровни, содержащие меньшее число электронов, называются незавершенными
n=1 – 1 подуровень (S), 2 электрона
n=2 – 2 подуровня (S, р), 8 электронов
n=3 – 3 подуровня (S, р, d), 18 электронов
n=4 – 4 подуровня (S, р, d, f), 32 электрона
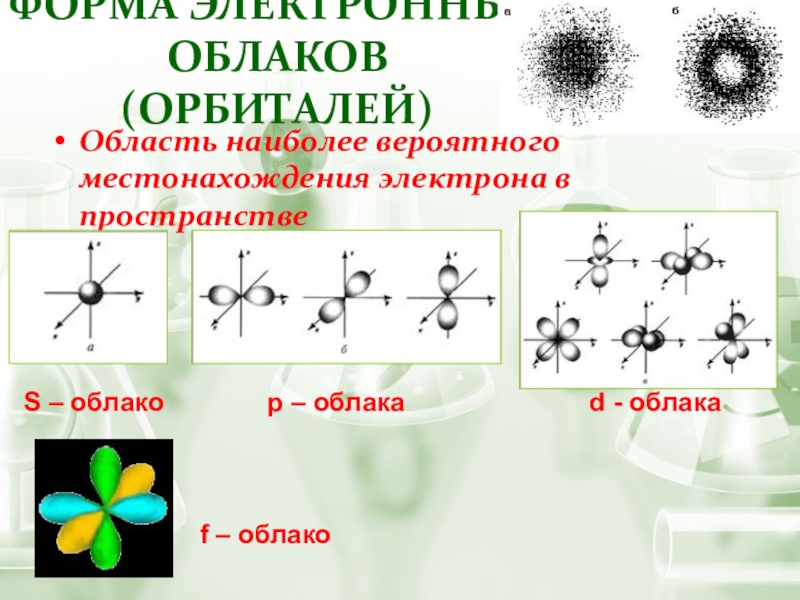
Слайд 10Область наиболее вероятного местонахождения электрона в пространстве
Форма электронных облаков (орбиталей)
S –
f – облако
Слайд 11Относительная молекулярная масса вещества
(Mr ) –
это число, показывающее, во сколько
Mr= Ar(A)·x + Ar(B)·y + Ar(С)·z
Где: А, В, С – знаки химических элементов;
x, y, z – количество атомов этих элементов (индексы).
R – relative (относительный)
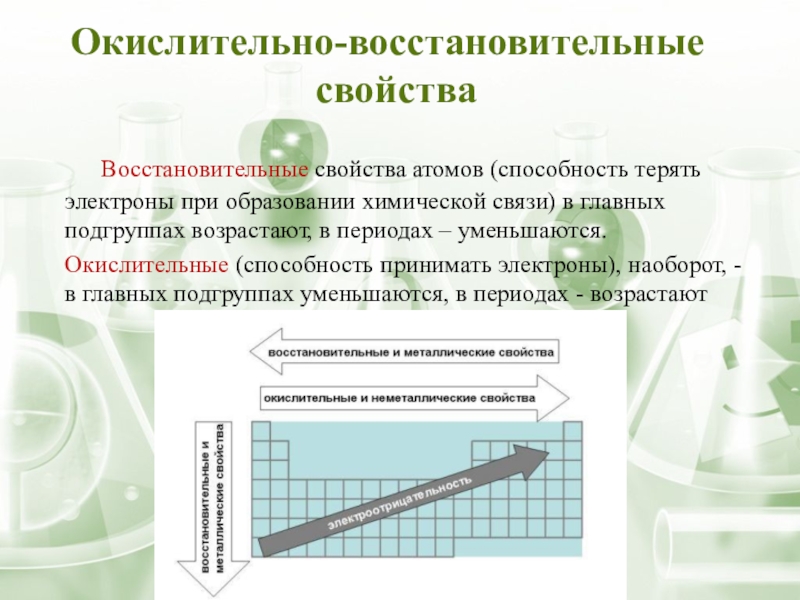
Слайд 13 Восстановительные свойства атомов (способность терять электроны при образовании химической связи) в
Окислительные (способность принимать электроны), наоборот, - в главных подгруппах уменьшаются, в периодах - возрастают
Окислительно-восстановительные
свойства
Слайд 14 Электроотрицательность в периоде увеличивается с возрастанием заряда ядра химического элемента, то
Электроотрицательность
Слайд 15 В одной и той же группе с увеличением номера периода атомные
Изменение радиуса атома в группе
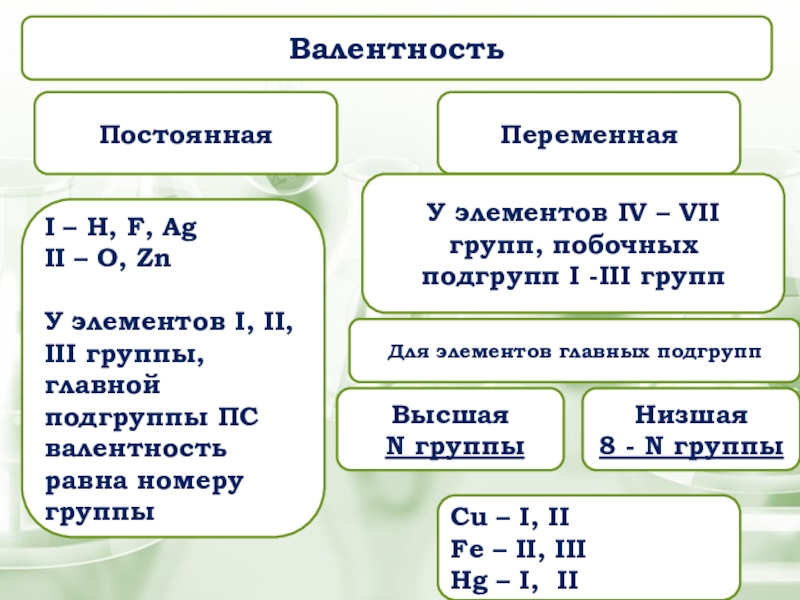
Слайд 18Валентность
Постоянная
Переменная
I – H, F, Ag
II – O,
У элементов I, II, III группы, главной подгруппы ПС валентность равна номеру группы
Cu – I, II
Fe – II, III
Hg – I, II
У элементов IV – VII групп, побочных подгрупп I -III групп
Высшая
N группы
Низшая
8 - N группы
Для элементов главных подгрупп
Слайд 19Связь в металлах между атомами и ионами, образованная за счет обобществления
металлической.