- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к контрольно обобщающему уроку Амины и аминокислоты
Содержание
- 1. Презентация к контрольно обобщающему уроку Амины и аминокислоты
- 2. Цель урока: Установление правильности степени и
- 3. Оборудование урока: медиапроектор, компьютер, карточки задания в
- 4. ДЕВИЗ УРОКА« «Кто мало знает, для того
- 5. Конкурс № 1 «Представление команд» АМИHОКИСЛОТЫ
- 6. Определение аминокислотАминокислотами называются азотсодержащие органические соединения, в
- 7. Историческая справка
- 8. Классификация аминокислотМоноаминокарбоные кислоты
- 9. Ароматические аминокислотыФенилалани́н (α-амино-β-фенилпропионовая кислота) — ароматическая
- 10. Изомерия аминокислота) углеродного скелета: СН3 – СН2-–
- 11. Лабораторный: уксусная кислота →хлоруксусная кислота→аминоуксусная кислотаСН3-СООН +
- 12. Получение аминокислотИх получают из галогенопроизводных карбоновых кислот под действием аммиака:R1ГалCOOHHNHHHNHHГалHR1ГалCOOHHNHNH4
- 13. Получение аминокислот гидролизом белковПолучение в промышленности гидролизом
- 14. Физические свойстваАминокислоты: бесцветные кристаллические вещества сладкие на
- 15. Химические свойства1) Растворимость в воде
- 16. Химические свойстваС основаниями NH2 – CH2 –
- 17. Химические свойстваЕсли в молекуле совпадает количество аминогрупп
- 18. 4. Аминокислоты реагируют друг с другом, образуя
- 19. Аминокислоты как часть белков Белок состоит из 20
- 20. Получение аминокислот гидролизом белковПолучение в промышленности гидролизом
- 21. Применение аминокислотАминокислотыСинтез белкаМедицинские целиПодкормка животныхСинтез волокон (например, для синтеза капрона используется 6 - аминогексановая кислота)
- 22. Незаменимые: валин, лейцин, лизин, треонин, цистеин и
- 23. Конкурс № 1 представление командАмины
- 24. Определение Аминов: Аминами называются производные аммиака, в молекулах
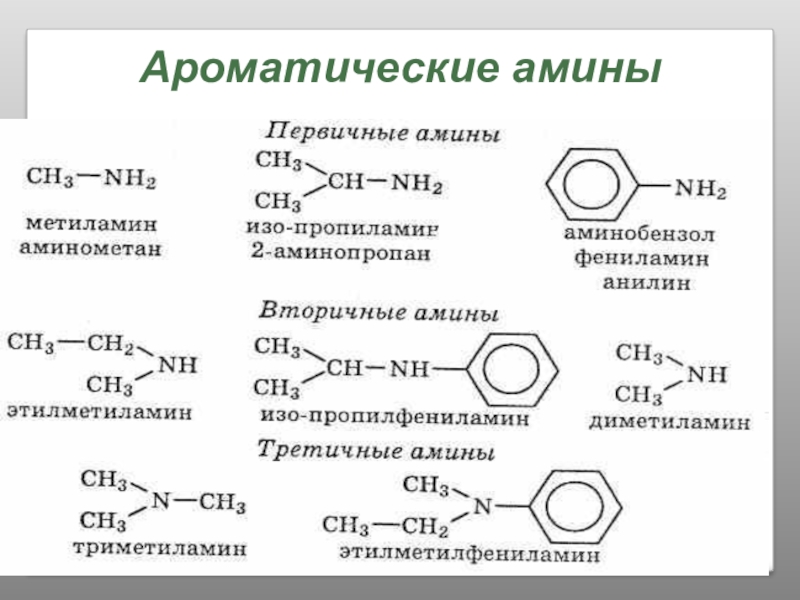
- 25. Классификация аминов
- 26. Классификация аминов по углеводородному радикалу
- 27. Строение аминовСтроение молекул аминов аналогично строению молекулы
- 28. НоменклатураCH3 – CH2 – NH2Радикал + – амин(в порядке увеличения)этиламинСоответствующий углеводород с приставкой амино – аминоэтан
- 29. Изомерия аминов Структурная изомерия углеродного скелета, начиная
- 30. Присоединение водорода по донорно-акцепторному механизму.H3N: + H+
- 31. Физические свойства аминов Простейшие амины - газы с
- 32. Получение аминов 1.Восстановление нитроалканов. CH3NO2 + 3H2 →
- 33. Основное свойство аминов (взаимодействие с кислотами)
- 34. Основные свойства аминовАмины – органические основания(более сильные, чем NH3)
- 35. Химические свойства аминов В водном растворе и в
- 36. Амины взаимодействуют с водой и минеральными кислотами(СН3)2NH
- 37. В отличие от NH3, амины горят на
- 38. Ароматические амины
- 39. Строение анилинаАнилин - ароматический амин, в составе которого ароматический радикал фенил связан с аминогруппой
- 40. Открытие анилина 1843г. Гофман доказал, что это одно вещество
- 41. Физические свойства анилинаАнилин — бесцветная маслянистая ядовитая
- 42. Химические свойства анилинаХимические свойства анилина обусловлены наличием
- 43. Подобно аминам, анилин реагирует с кислотами с
- 44. Реакции замещенияВ ароматических аминах аминогруппа облегчает замещение
- 45. 2) Раствором дихромата калияC6H5NH2 + K2Cr2O7 + H2SO4 → черный анилин
- 46. Окисление анилина1) Раствором хлорной извести (Качественная реакция на анилин)C6H5NH2 + CaOCl2 → фиолетовый раствор
- 47. Получение анилинаРеакция Зинина1. C6H5NO2 + 6H → C6H5NH2 + 2H2O
- 48. При нитровании (сульфировании) нитрогруппа (сульфо) замещает водород
- 49. Применение аминов
- 50. Слайд 50
- 51. Разминка «Узнай своего» NH2CH3 . CH2NH2COOH.
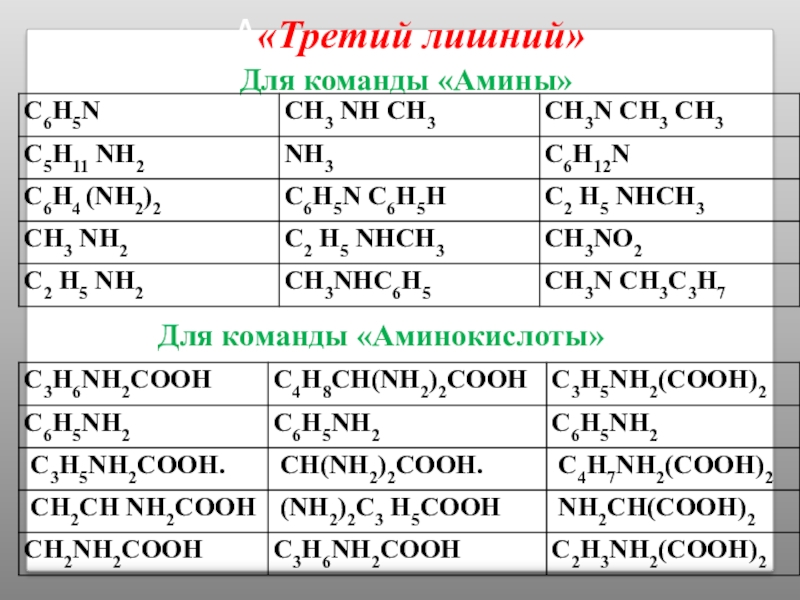
- 52. РАПЗИНКА«Третий лишний»Для команды «Аминокислоты»Для команды «Амины»
- 53. Химическая эстафета CH3Cl →
- 54. «Посчитай-ка» Для команды «Амины» При бромировании анилина массой 250
- 55. массовая доля кислорода в одноосновной аминокислоте
- 56. Конкурс Тест: «Амины и амиинокислотыЗадание: ответьте на вопросы
- 57. «Закончите фразу»:–.- Углерод в органических соединениях имеет
- 58. Слайд 58
- 59. а)построить шаростержневые модели: 2.3-диметилбутиламин-2 б) бъемную модель:3-метил 4-аминопентановая кислотаПрактическая часть:
- 60. «Эксперимент» В пробирку прилейте 0,5 мл
- 61. «Кроссворд» Задание: Разгадать кроссворд. Участники конкурса
- 62. Слайд 62
- 63. По горизонтали:
- 64. «Выдающиеся химики»
- 65. Вопросы:1. Итальянский физик и химик, открыл закон,
- 66. «Выдающиеся химики»
- 67. Конкурс. Ребусы и лабиринты
- 68. Слайд 68
Слайд 1
Презентация к контрольно обобщающему уроку
«Амины и аминокислоты»
Преподаватель:
Светличная Л.С.
.
Слайд 2Цель урока:
Установление правильности степени и осознанности Усвоения всеми обучающимися объёма
Закрепление и обобщение знаний по теме
Решение задач разных типов;
Развитие умений сравнивать, анализировать, делать выводы;
Формирование умения слушать, дополнительные ответы, объективно оценивать работы товарищей.
Слайд 3Оборудование урока:
медиапроектор,
компьютер,
карточки задания в печатном виде,
лабораторное
наборы для конструирования шаростержневых и объемных моделей,
кроссворды
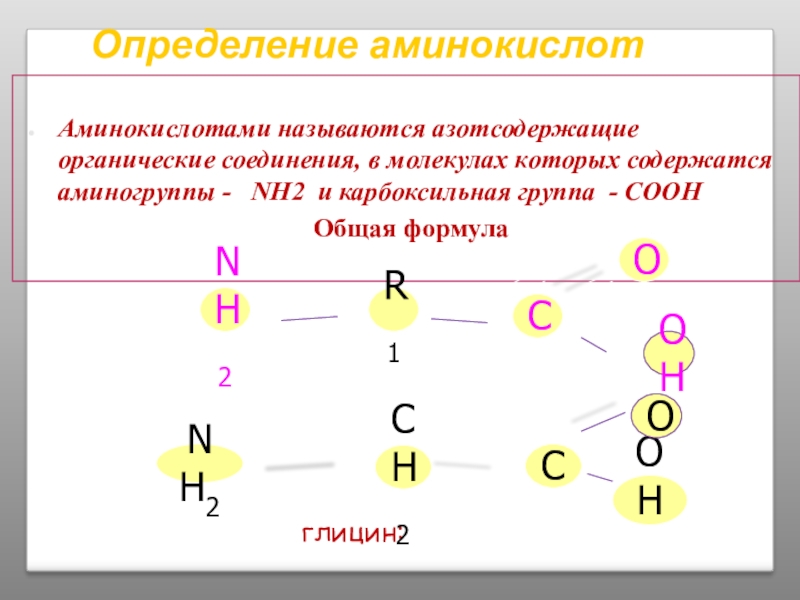
Слайд 6Определение аминокислот
Аминокислотами называются азотсодержащие органические соединения, в молекулах которых содержатся аминогруппы
Общая формула
NH2
R1
C
OH
глицин:
NH2
OH
C
CH2
O
O
Слайд 8Классификация аминокислот
Моноаминокарбоные кислоты
׀
NH2
Диаминокарбоновые кислоты.
С-С-С-С-С –СООН лизин
׀ ׀
NH2 NH2 2, 6 – диаминогексановая кислота
Моноаминодикарбоновые кислоты.
НООС-С-С-С-СООН
|
2-аминопентандиовая кислота NH2 глутаминовая
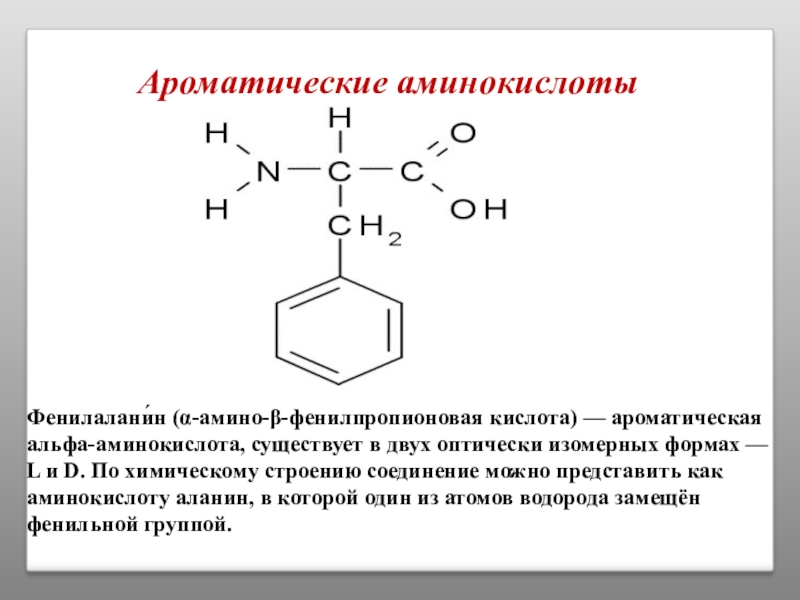
Слайд 9
Ароматические аминокислоты
Фенилалани́н (α-амино-β-фенилпропионовая кислота) — ароматическая альфа-аминокислота, существует в двух оптически
Слайд 10Изомерия аминокислот
а) углеродного скелета: СН3 – СН2-– СН- С=О
γ β α
б) расположения функциональной группы : СН3 – СН2-– СН- СООН
NH2
α- аминомасляная кислота
γ β α
СН3 – СН2-– СН- СООН β- аминомасляная кислота
NH2
γ β α
NН2 – СН2-– СН- – СН2- СООН γ- аминомасляная кислота.
в) межклассовая ( с нитросединениями, сложными эфирами
г) оптическая изомерия: |
ОН OH
С = О C = O
Н – С – NH2 H2N – C – H
CH3 CH3
D-изомер(-) L- изомер (+)
Слайд 11Лабораторный:
уксусная кислота →хлоруксусная кислота→аминоуксусная кислота
СН3-СООН + Сl2 → СН2-СООН
Cl
СН2-СООН + NH3 → СН2-СООН
| |
Сl NH2
способы получения
гидролиз белков
Промышленный:
Слайд 12
Получение аминокислот
Их получают из галогенопроизводных карбоновых кислот под действием аммиака:
R1
Гал
COOH
H
N
H
H
H
N
H
H
Гал
H
R1
Гал
COOH
H
N
H
NH4
Слайд 13Получение аминокислот гидролизом белков
Получение в промышленности гидролизом белков.
Смесь аминокислот обычно получают
H+
(- NH – CH - CO– NH – CH – CO -)n + 2H2O →
R1 R2
Слайд 14Физические свойства
Аминокислоты:
бесцветные кристаллические вещества
сладкие на вкус
безвкусные
Горькие
хорошо растворяются
имеют температуру плавления 2200- 3150 С.
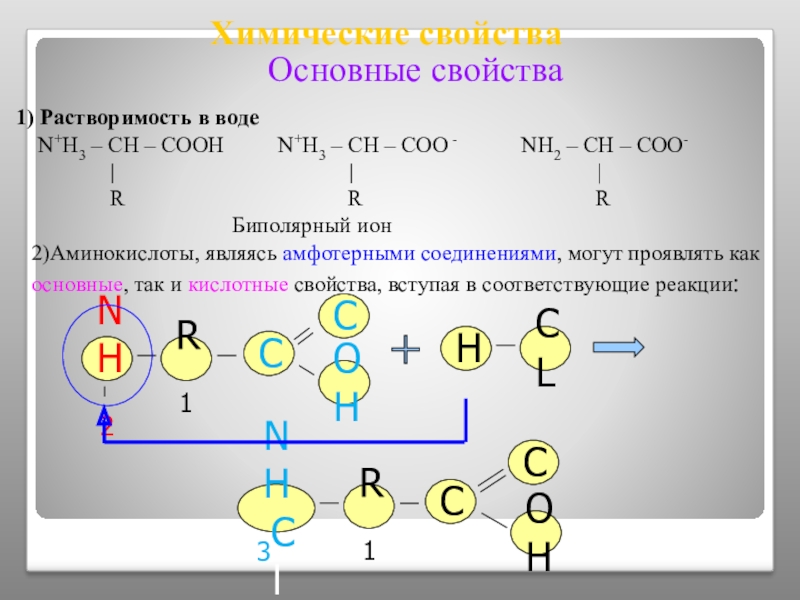
Слайд 15Химические свойства
1) Растворимость в воде
N+H3 – CH –
| | |
R R R
Биполярный ион
2)Аминокислоты, являясь амфотерными соединениями, могут проявлять как основные, так и кислотные свойства, вступая в соответствующие реакции:
NH2
R1
C
OH
C
Основные свойства
NH3Cl
R1
C
OH
C
H
CL
Слайд 16Химические свойства
С основаниями
NH2 – CH2 – COOH + Na OH
как кислота
Вывод : аминокислоты - органические амфотерные соединения
Карбоксильная группа сохраняет способность образовывать сложные эфиры. Аминокислоты реагируют со спиртами (реакция протекает в присутствии хлористого водорода в качестве катализатора) :
NH2-CH2-COOH
R1OH
NH2-CH2-COOR1
H2O
Слайд 17Химические свойства
Если в молекуле совпадает количество аминогрупп и карбоксильных групп, то
N
R1
C
O
O
H
H
H
биполярный ион
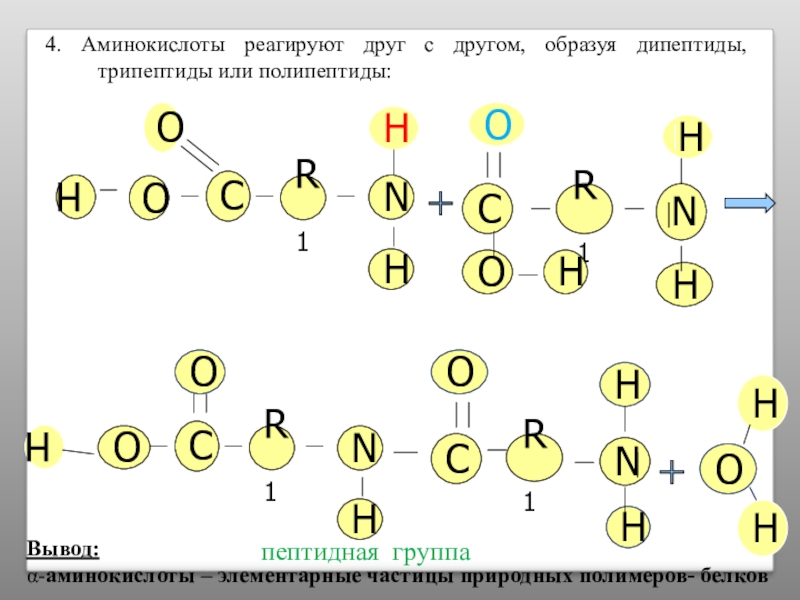
Слайд 184. Аминокислоты реагируют друг с другом, образуя дипептиды, трипептиды или полипептиды:
С
R1
N
С
Н
О
О
H
О
Н
N
R1
Н
С
R1
N
С
Н
О
О
H
О
Н
N
R1
Н
Н
О
Н
О
Н
Н
пептидная
Вывод:
α-аминокислоты – элементарные частицы природных полимеров- белков
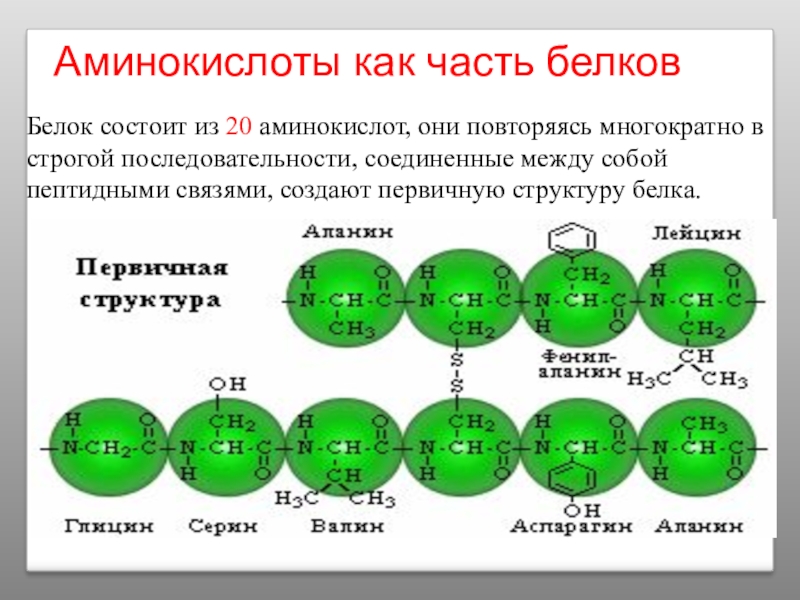
Слайд 19Аминокислоты как часть белков
Белок состоит из 20 аминокислот, они повторяясь многократно
Слайд 20Получение аминокислот гидролизом белков
Получение в промышленности гидролизом белков.
Смесь аминокислот обычно получают
(- NH – CH - CO– NH – CH – CO -)n + 2H2O → H+ R1 R2
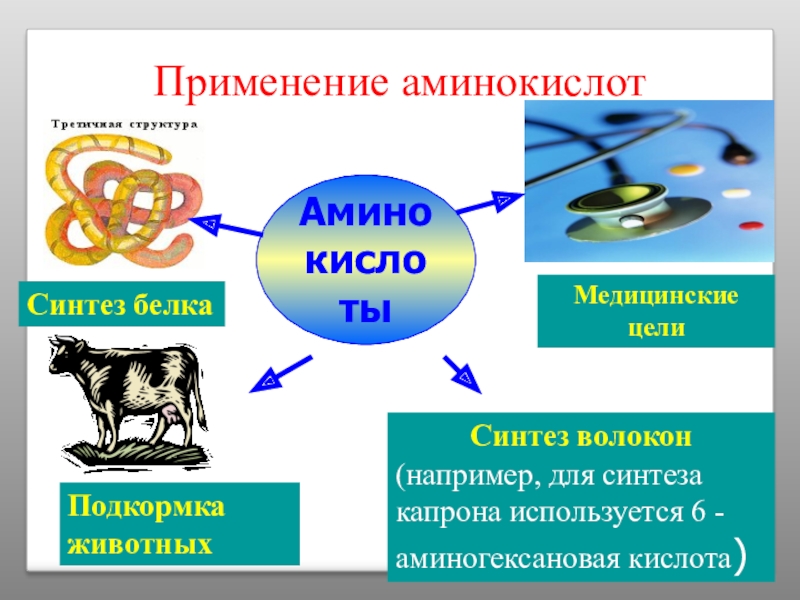
Слайд 21Применение аминокислот
Аминокислоты
Синтез белка
Медицинские цели
Подкормка животных
Синтез волокон
(например, для синтеза капрона используется
Слайд 22Незаменимые:
валин, лейцин, лизин, треонин, цистеин и др.
Антибиотики (пенициллин)
Плиамидные смолы (капрон,
Добавка к корму
В живых организмах:
Природные аминокислоты (около 150)
Протеиногенные аминокислоты (около 20) в белках
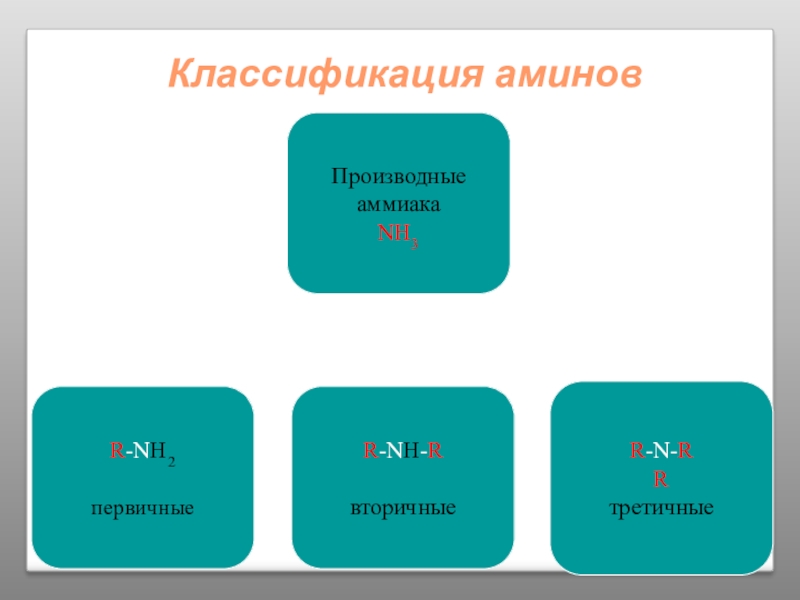
Слайд 24Определение Аминов:
Аминами называются производные аммиака, в молекулах которого один или несколько
CH3 – NH2 C6H5 – NH2
Группа NH2 называется аминогруппой.
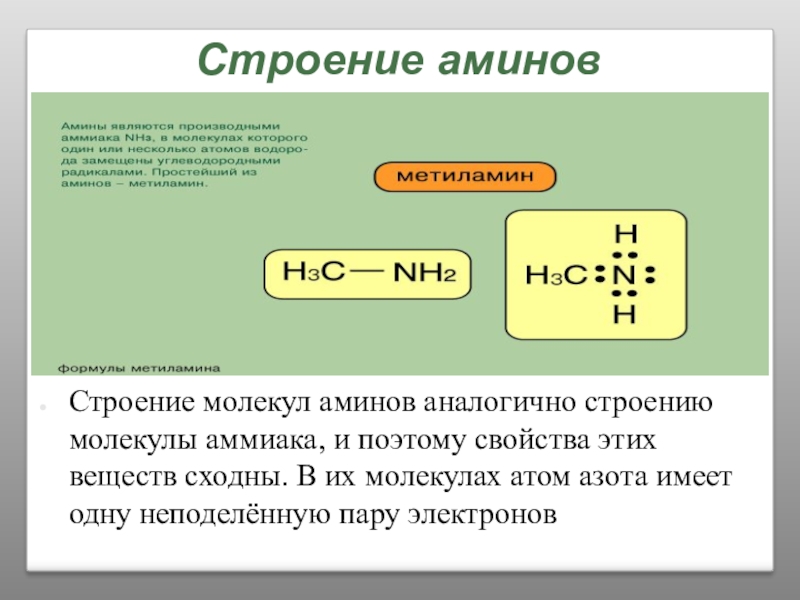
Слайд 27Строение аминов
Строение молекул аминов аналогично строению молекулы аммиака, и поэтому свойства
Слайд 28Номенклатура
CH3 – CH2 – NH2
Радикал + – амин
(в порядке увеличения)
этиламин
Соответствующий углеводород
аминоэтан
Слайд 29Изомерия аминов
Структурная изомерия
углеродного скелета, начиная с С4H9NH2:
положения
- изомерия аминогруппы, связанная с изменением степени замещенности атомов водорода при азоте:
Пространственная изомерия
Возможна оптическая изомерия, начиная с С4H9NH2:
Слайд 30Присоединение водорода по донорно-акцепторному механизму.
H3N: + H+
..
H3CNH2 + H+ H3CNH3+ ион метиламмония
..
C6H5NH2 + H+ C6H5NH3+
ион фениламмония
Слайд 31Физические свойства аминов
Простейшие амины - газы с запахом аммиака, более сложные
Слайд 32Получение аминов
1.Восстановление нитроалканов.
CH3NO2 + 3H2 → CH3NH2 + 2H2O
(kat
Реакция Зинина — удобный способ получения ароматических аминов при восстановлении ароматических нитросоединений.
2.Аминирование галогеналканов в спиртовом растворе при нагревании под давлением:
CH3Cl + NH3 → CH3NH2 + HCl
(t, P, спиртовой раствор).
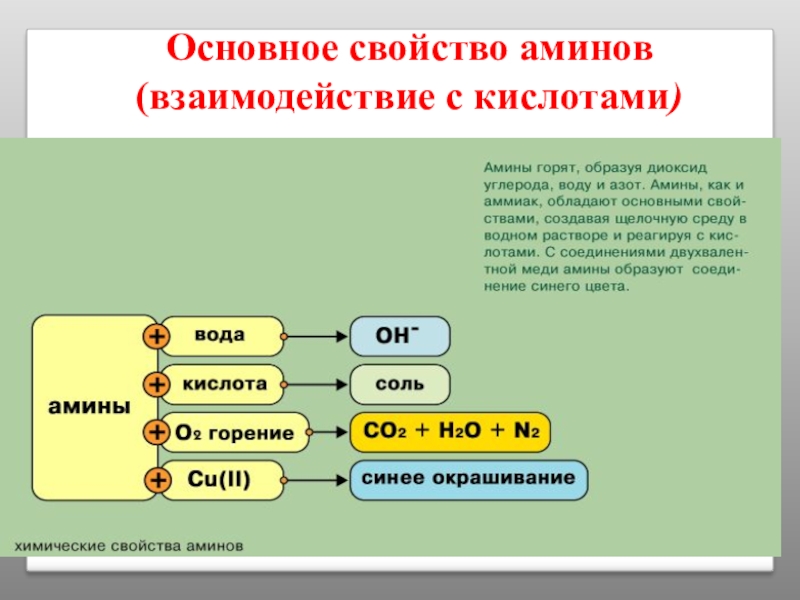
Слайд 35Химические свойства аминов
В водном растворе и в присутствии кислот неподеленная электронная
Следовательно, аммиак и амины обладают основными свойствами.
Их водные растворы окрашивают раствор лакмуса в синий цвет, а раствор фенолфталеина — в малиновый.
H3CNH2 + HCl [CH3NH3]+Cl-
хлорид метиламмония
C6H5NH2 + HCl [C6H5NH3]+Cl-
хлорид фениламмония
Слайд 36Амины взаимодействуют с водой и минеральными кислотами
(СН3)2NH + H2O → [(СН3)2NH2]ОН
3[(СН3)2NH2]ОН + FeCI3 →
→ Fe(OH)3↓+3[(СН3)2NH2]CI
(СН3)2NH + HCI = [(СН3)2NH2] CI
Слайд 37В отличие от NH3, амины горят на воздухе, образуя азот, углекислый
4CH3NH2 + 9O2 → 4CO2 + 10H2O +2N2
4(СН3)2NH +15 O2 = 8CO2 + 14H2O + 2N2
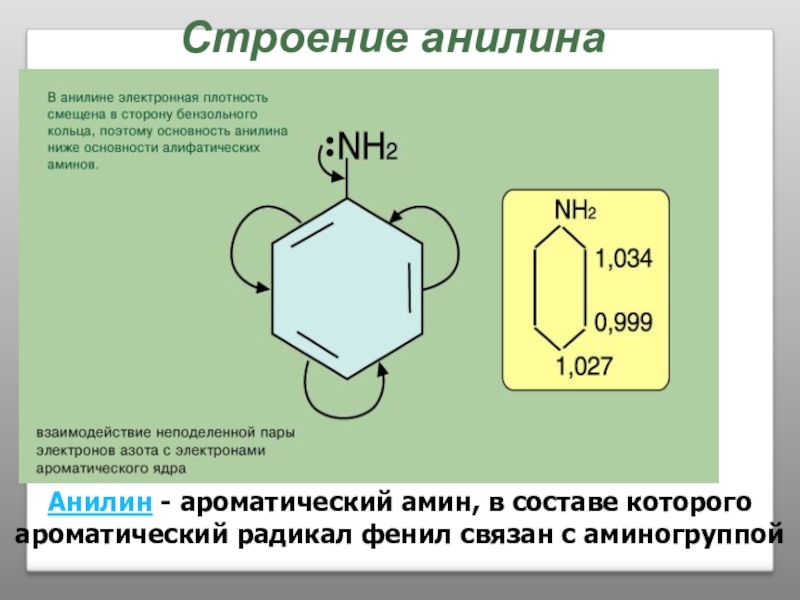
Слайд 39Строение анилина
Анилин - ароматический амин, в составе которого ароматический радикал фенил
Слайд 41Физические свойства анилина
Анилин — бесцветная маслянистая ядовитая жидкость, мало растворимая в
Слайд 42Химические свойства анилина
Химические свойства анилина обусловлены
наличием в его молекуле аминогруппы
NH2 и бензольного ядра.
Анилин окраски лакмуса не изменяет.
Слайд 43Подобно аминам, анилин реагирует с кислотами с образованием солей
C6H5NH2 + HCl
хлорид фениламмония
(солянокислый анилин)
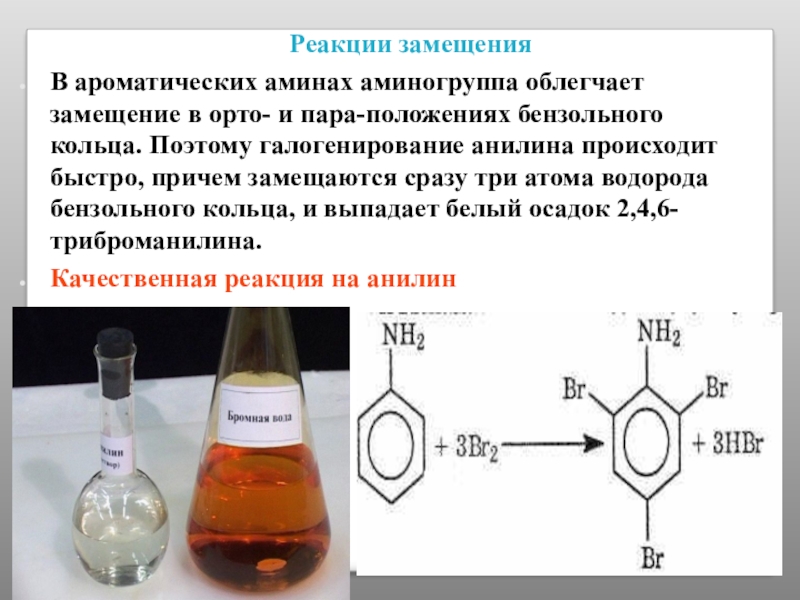
Слайд 44 Реакции замещения
В ароматических аминах аминогруппа облегчает замещение в орто- и пара-положениях
Качественная реакция на анилин
Слайд 46Окисление анилина
1) Раствором хлорной извести (Качественная реакция на анилин)
C6H5NH2 + CaOCl2
Слайд 48При нитровании (сульфировании) нитрогруппа (сульфо) замещает водород в пара-положении.
2.
NH2 + HNO3 → O2N NH2
NH2 + H2SO4→ HO3S NH2
сульфаниловая кислота
Слайд 49 Применение аминов Амины широко применяются для получения лекарств, полимерных материалов. Анилин
Слайд 51Разминка «Узнай своего»
NH2CH3 .
CH2NH2COOH.
CH3NO2
C6H5NH
C3H6NH2COOH
C6H5NH2
C3H6NH2COOH.
NH2CH10COOH
Слайд 53Химическая эстафета
CH3Cl → C2H6
→ CH3-COOH → →
CH4 → C2H2 → C6H6 →
C6H5NO2 → C6H5NH2 → HCl X
NH3
X
CH2ClCOOH
Для команды «Аминокислоты»
Для команды «Амины»
Осуществить следующие превращения.
→
→
Слайд 54«Посчитай-ка»
Для команды «Амины»
При бромировании анилина массой 250 г было получено триброманилина
Для команды «Аминокислоты»
Какой объем аммиака потребуется для превращения бромуксусной кислоты в глицин (аминоуксусная кислота) , в результате чего получено 250 г. глицина, если выход её составляет 95 % от теоретического ?
Слайд 55 массовая доля кислорода в одноосновной аминокислоте равна 42,67%. Установите молекулярную
Первичный амин образует с бромоводородом соль, массовая доля брома в которой составляет 71,4%. Установите молекулярную формулу этого амина и назовите его.
Слайд 57
«Закончите фразу»:
–.
- Углерод в органических соединениях имеет валентность, равную…
– Углеводороды, в
– Двойная связь – это сочетание двух связей: -... связи и … связи
– Для предельных углеводородов характерны реакции…
– Для непредельных углеводородов наиболее характерны реакции…
– Многократно повторяющаяся в структуре полимера группировка атомов называется…
– Число структурных звеньев в молекуле полимера называют…
– Реакция отщепления водорода называется…
– Реакция, в результате которой происходит отщепление воды, – это…
– Для большинства органических веществ характерны реакции…
– Качественная реакция на анилин .....
- Характерные свойства аминокислот.....
Слайд 58
Составить структурные формулы
Для команды «Амины»
а) анилина
б) 2 –метиланилина
в) 3,4 –дихлоранилина
г)2,6-динитроанилин
Для команды «Аминокислоты»
а)2- аминоуксусной кислоты
б) альфа, бетта -диаминобутановой кислоты
в) 1,3.амино 4 оксигексановой кислоты
г) аминобензойной кислоты
Слайд 59
а)построить шаростержневые модели:
2.3-диметилбутиламин-2
б) бъемную модель:
3-метил
4-аминопентановая кислота
Практическая часть:
Слайд 60 «Эксперимент»
В пробирку прилейте 0,5 мл анилина и 3 мл воды.
Ответьте на вопросы:
Почему при добавлении соляной кислоты происходит растворение анилна. Напишите уравнение реакции.
Почему при добавлении щелочи анилин выделяется из водного раствор. Напишите уравнение реакции.
В трех пробирках, содержатся растворы: моноаминокислоты, диаминокислоты и аминодикарбоновой кислоты. Как с помощью одного реактива можно распознать какая кислота в какой пробирке.
Что наблюдаете? Ответьте на вопросы:
Чем обусловлено появление различной окраски растворов при действии выбранного реактиа.
Записать соответствующие уравнения реакций.
Слайд 61
«Кроссворд»
Задание: Разгадать кроссворд.
Участники конкурса получают конверт. В конверт вложен листок
Слайд 63 По горизонтали:
2. Химическая посуда.
4. одно из условий, часто необходимое для протекания химических реакций.
6. Пищевой продукт, из которого впервые была получена лактоза.
7 Цифра в химических формулах, которая показывает число атомов в молекуле.
8. Продукт переработки нефти, который используется как топливо для тракторов, реактивных самолетов и ракет.
9. Реакция взаимодействия карбоновых кислот со спиртами, приводящая к образованию сложных эфиров.
10. Реакция введения хлора в молекулы органических веществ.
15. Единица измерения количества вещества.
16. Низкомолекулярное вещество, образующиеся при дегидратации спиртов.
1.Одноатомный спирт, в молекуле которого три атома углерода.
3.Органическое вещество, в молекуле которого содержится две двойные связи.
5.Азотистое основание.
11.Название вещества с формулой CuSO4 * 5H20
12. Млечный сок каучуконосных растений.
13.Вещества, имеющие одинаковый количественный и качественный состав, но разное строение.
14. Одно из агрегатных состояний вещества.
17. Органическое вещество, в молекуле которого ОН- группа непосредственно соединена с бензольным кольцом.
18. Вещество, предоставляющее электронную пару при обраовании ковалентной полярной связи.
19.Число атомов углерода в молекуле пропина.
20. Аминокислота, содержащаяся в белках.
21. Получение сложных веществ из более простых путем химических реакций.
По горизонтали:
Слайд 65Вопросы:
1. Итальянский физик и химик, открыл закон, согласно которому в одинаковых
2. Кто первый предложил циклическую структурную формулу бензола
3.Кто из русских ученых – сформулировал правило присоединения галогеноводородов к алкенам?
4.Русский ученый, создавший теорию строения органических веществ.
5.Русский ученый, открывший реакцию восстановления ароматических нитросоединений, послужившую основой новой отрасли химической промышленности - анилокрасочной
6. Кто из русских ученых первый участвовал в открытии Российской академии наук, российский ученый, поэт, просветитель.
7. Немецкий химик, лауреат Нобелевской премии, синтезировал ряд пуриновых оснований и аминокислот, в том числе гуанин и валин.
8. Когда, где и кем впервые был введен термин «органическая химия»
9. Кто из русских ученых первым был лауреатом Нобелевской премии


























![Презентация к контрольно обобщающему уроку Амины и аминокислоты Амины взаимодействуют с водой и минеральными кислотами(СН3)2NH + H2O → [(СН3)2NH2]ОН Амины взаимодействуют с водой и минеральными кислотами(СН3)2NH + H2O → [(СН3)2NH2]ОН 3[(СН3)2NH2]ОН + FeCI3 →](/img/thumbs/cd499de65036e3bb80d52c3e6fc57a46-800x.jpg)



![Презентация к контрольно обобщающему уроку Амины и аминокислоты Подобно аминам, анилин реагирует с кислотами с образованием солей C6H5NH2 + HCl Подобно аминам, анилин реагирует с кислотами с образованием солей C6H5NH2 + HCl → [C6H5NH3]Cl](/img/thumbs/31bd651d359b07419fcd6ceb5830d0d3-800x.jpg)