- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Игра-зачет Самый умный по химии 11 класс
Содержание
- 1. Презентация Игра-зачет Самый умный по химии 11 класс
- 2. Правила игры:В отборочных турах участвуют все ученики.
- 3. Отборочный тур.Какова степень окисления азота в азотной кислоте?HNO3
- 4. Ответ. +5
- 5. Первый вопрос.Назовите ранние модели строения атома?
- 6. Ответ. «Пудинг с
- 7. Второй вопрос.Дайте определение: гидролиз
- 8. Ответ. Гидролиз – взаимодействие соли с водой, в результате которого идёт образование слабого электролита.
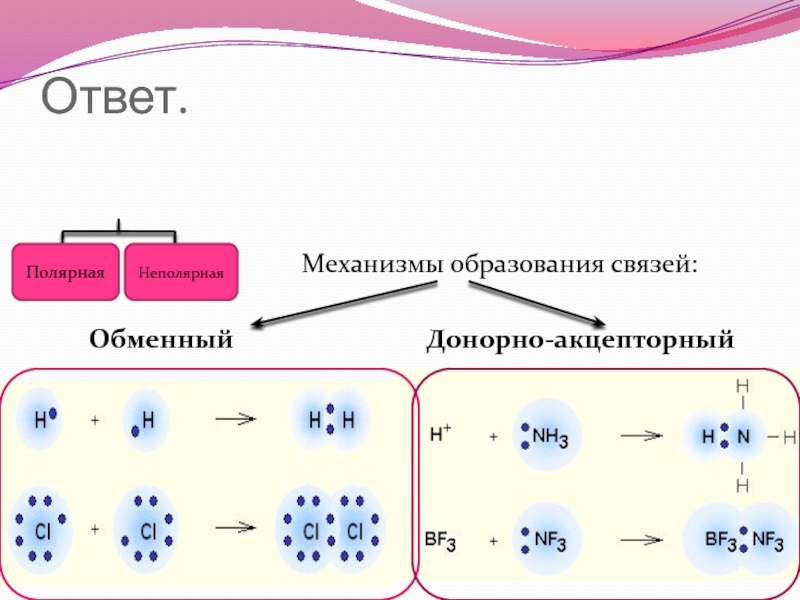
- 9. Третий вопрос.Назовите известные вам виды химической связи и механизмы их образования.
- 10. Ответ. ПолярнаяНеполярнаяМеханизмы образования связей:Обменный Донорно-акцепторный
- 11. По способу перекрывания ЭО различают:δ связь:π связь:Осевое
- 12. Четвёртый вопрос. Что такое химическое равновесие?
- 13. Ответ.Химическое равновесие - состояние системы, в котором скорость прямой реакции равна скорости обратной реакции.
- 14. Пятый вопрос. Сформулируйте принцип Ле-Шателье.
- 15. Ответ. Принцип Ле-Шателье -Если на систему, находящуюся
- 16. Второй отборочный тур. Сколько электронов на внешнем слое у атома хлора?Cl
- 17. Ответ. 7
- 18. Первый вопрос.Назовите положения современной модели строения атома.
- 19. Ответ.Атом – электронейтральная частицаЯдро атома – положительно
- 20. Второй вопрос.Какую среду будут иметь водные растворы
- 21. Ответ. Zn(NO3)2 ↔ Zn2+ + 2NO3–Н2O ↔
- 22. Третий вопрос.Определите тип химической связи между атомами в веществах: СаBr2 HCl LiNO3
- 23. Ответ. СаBr2 металл и неметалл– ионнаяHCl
- 24. Четвёртый вопрос.Какое изменение параметров будет способствовать сдвигу
- 25. Ответ. N2(газ) + O2(газ) 2NO2(газ) - QУвеличение температурыУвеличение концентрации N2 и O2Уменьшение концентрации NO2
- 26. Пятый вопрос. Сформулируйте принцип Паули.
- 27. Ответ. В атоме не может быть двух
- 28. Третий отборочный тур.Какой химический элемент расположен в периодической системе Д. И. Менделеева под номером 8.
- 29. Ответ. Кислород
- 30. Первый вопрос. Что такое изотопы?
- 31. Ответ. Изотопы – совокупность атомов, имеющих одинаковое число протонов, но различающихся количеством нейтронов в ядре атома.
- 32. Второй вопрос. Какую среду будут иметь водные
- 33. Ответ. Na2S ↔ 2Na+ + S2–Н2O ↔
- 34. Третий вопрос.Что такое гибридизация и какие виды гибридизации бывают?
- 35. Ответ. Гибридизация – процесс выравнивания электронных облаков по форме и энергии
- 36. Четвёртый вопрос.Какое изменение параметров будет способствовать сдвигу
- 37. Ответ. CO2(газ) + C(тв)
- 38. Пятый вопрос.Назовите химический элемент, который имеет такую структурно-графическую формулу:
- 39. Ответ.
- 40. Четвёртый отборочный тур.Назовите формулу метана.
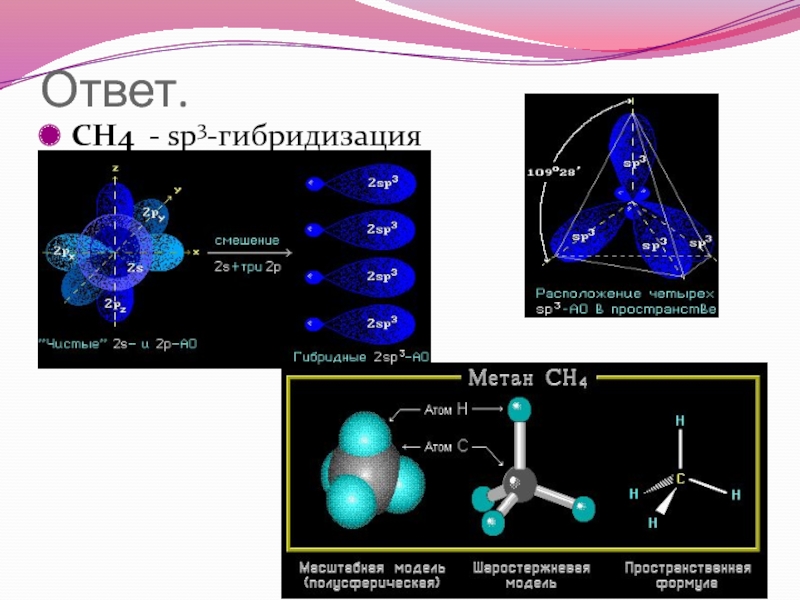
- 41. Ответ. CH4
- 42. Первый вопрос.Перечислите известные вам квантовые числа.
- 43. Ответ. n – главное квантовое число, характеризует
- 44. Второй вопрос.Какую среду будет иметь водный раствор сульфита натрия и нитрата барияNa2SO3 Ba(NO3)2
- 45. Ответ. Na2SO3 ↔ 2Na+ + SO32–Н2O ↔
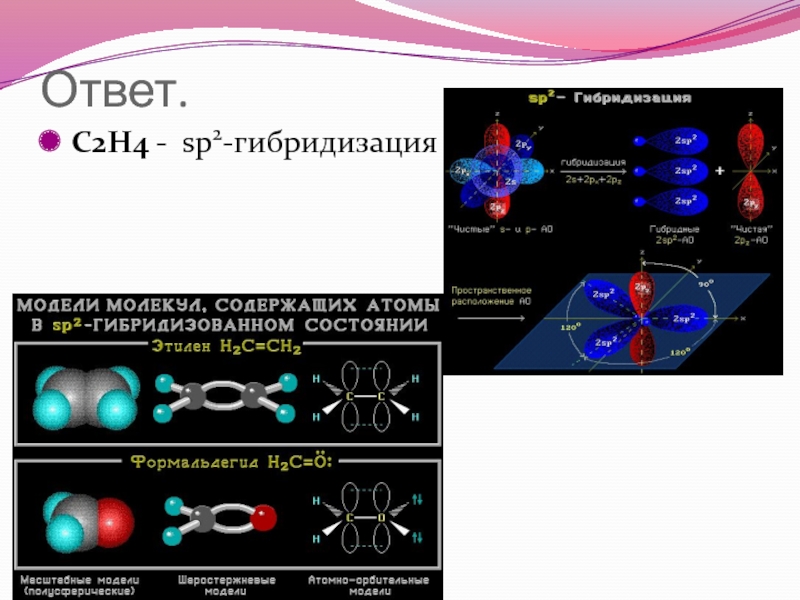
- 46. Третий вопрос.Даны формулы веществ: C2H4, CH4, C(алмаз), определите в каком типе гибридизации находятся центральные атомы.
- 47. Ответ.C2H4 - sp2-гибридизация
- 48. Ответ. CH4 - sp3-гибридизация
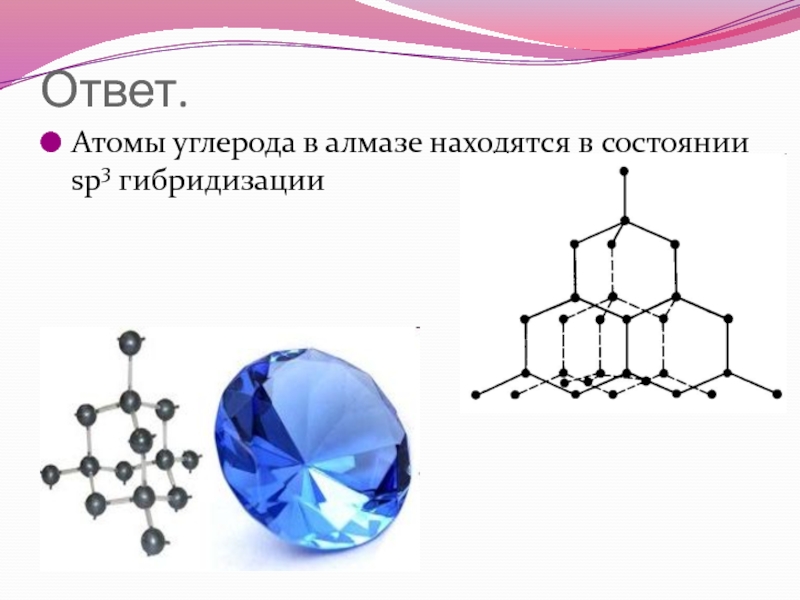
- 49. Ответ. Атомы углерода в алмазе находятся в состоянии sp3 гибридизации
- 50. Четвёртый вопрос.Какое изменение параметров будет способствовать сдвигу
- 51. Ответ. Уменьшение температурыУвеличение давленияУвеличение концентрации N2 и
- 52. Пятый вопрос.Назовите химический элемент, который имеет такую структурно-графическую формулу:
- 53. Ответ.
- 54. Пятый отборочный тур.Определите степень окисления серы в соединении: SO3
- 55. Ответ. +6
- 56. Первый вопрос.Дайте определение понятию: атомная орбиталь. Какой формы они бывают?
- 57. Ответ.Атомная орбиталь – часть э.о., где сосредоточено >90% электронной плотности
- 58. Второй вопрос.Установите соответствие между составом соли и реакцией среды её водного раствора.
- 59. Ответ. NaNO2 – сильное основание, слабая кислота
- 60. Третий вопрос.Определите тип химической связи между атомами в веществах: О2, Na, HCOOK.
- 61. Ответ.О2 – два одинаковых неметалла – ковалентная
- 62. Четвёртый вопрос.В какую сторону сместится химическое равновесие2NO(газ)+
- 63. Ответ. 2NO(газ)+ O2(газ) 2NO2(газ) + QА) прямая реакцияБ) прямая реакция
- 64. Пятый вопрос.Сформулируйте правило Ключевского.
- 65. Ответ. Заполнение электронами орбиталей в атоме происходит
- 66. Шестой отборочный тур.Назовите элемент, который расположен в
- 67. Ответ.Вбор
- 68. Первый вопрос.Какую среду будет иметь водный раствор хлорида аммония и сульфида алюминия?NH4Cl Al2S3
- 69. Ответ. NH4Cl ↔ NH4+ + Сl–Н2O ↔
- 70. Второй вопрос.Определите химический элемент по электронно-графической формуле 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d7
- 71. Ответ. 109 Mt мейтнерий
- 72. Третий вопрос. Определите тип связи между атомами в веществах KOH, Cl2, SO2
- 73. Ответ. KOH – металл и неметалл –
- 74. Четвёртый вопрос.В какую сторону сместится химическое равновесие
- 75. Ответ. N2 + 3H2 2NH3 + QА) обратная реакцияБ) прямая реакция
- 76. Пятый вопрос.Какой тип гибридизации в молекулах: С(графит), С2Н2
- 77. Ответ. Графит – аллотропная модификация углерода. sp2 гибридизация.
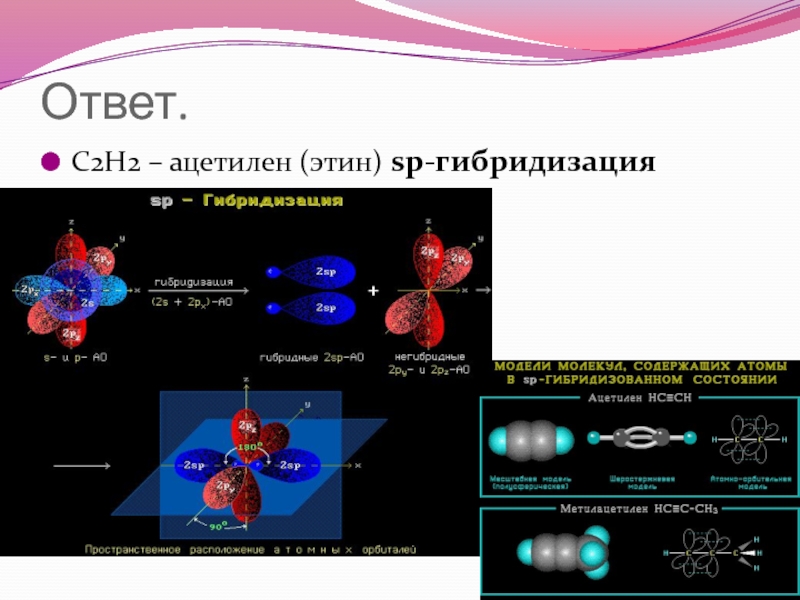
- 78. Ответ. С2Н2 – ацетилен (этин) sp-гибридизация
- 79. Поздравляем победителей!Поздравляем победителей!
Правила игры:В отборочных турах участвуют все ученики. Побеждает тот, который первым даст правильный ответ.Победитель отборочного тура становится игроком. Ему задаются 5 вопросов, время на обдумывание 30 с. Есть 2 подсказки: мнение одного (игрок выбирает ученика и
Слайд 2Правила игры:
В отборочных турах участвуют все ученики. Побеждает тот, который первым
даст правильный ответ.
Победитель отборочного тура становится игроком. Ему задаются 5 вопросов, время на обдумывание 30 с.
Есть 2 подсказки: мнение одного (игрок выбирает ученика и выслушивает его мнение по вопросу), мнение большинства (ученики совещаясь дают общий ответ). После использования подсказки растворяются.
Игрок, ответивший на все 5 вопросов правильно становится победителем игры!
Отборочный тур повторяется для оставшихся учеников.
Победитель отборочного тура становится игроком. Ему задаются 5 вопросов, время на обдумывание 30 с.
Есть 2 подсказки: мнение одного (игрок выбирает ученика и выслушивает его мнение по вопросу), мнение большинства (ученики совещаясь дают общий ответ). После использования подсказки растворяются.
Игрок, ответивший на все 5 вопросов правильно становится победителем игры!
Отборочный тур повторяется для оставшихся учеников.
Слайд 6Ответ.
«Пудинг с изюмом»
(1902-1904 г. Дж. Томсон)
«Планетарная»
(1907 г. Э. Резерфорд)
«Модель Бора» (1913 г.)
(1907 г. Э. Резерфорд)
«Модель Бора» (1913 г.)
Слайд 8Ответ.
Гидролиз – взаимодействие соли с водой, в результате которого идёт
образование слабого электролита.
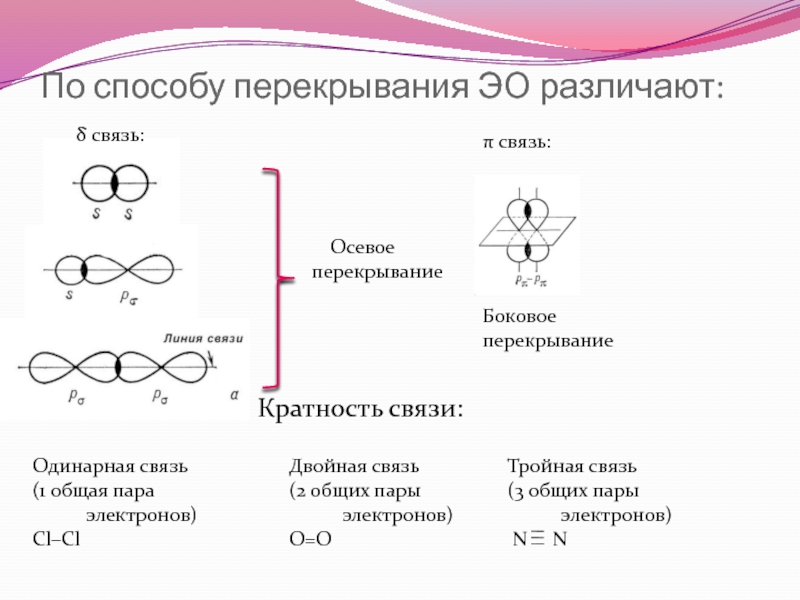
Слайд 11По способу перекрывания ЭО различают:
δ связь:
π связь:
Осевое перекрывание
Боковое перекрывание
Кратность связи:
Одинарная связь
(1 общая пара электронов)
Cl–Cl
Двойная связь
(2 общих пары электронов)
O=O
Тройная связь
(3 общих пары электронов)
N N
Слайд 13Ответ.
Химическое равновесие - состояние системы, в котором скорость прямой реакции равна
скорости обратной реакции.
Слайд 15Ответ.
Принцип Ле-Шателье -Если на систему, находящуюся в состоянии равновесия, оказать
внешнее воздействие, то система перейдет в другое состояние так, чтобы уменьшить эффект внешнего воздействия.
Слайд 19Ответ.
Атом – электронейтральная частица
Ядро атома – положительно заряженное
Электроны – отрицательно заряженные
Электроны
вращаются вокруг ядра с определённой скоростью
Электроны имеют двойственную природу
Электроны имеют двойственную природу
Слайд 20Второй вопрос.
Какую среду будут иметь водные растворы нитрата цинка(2) и сульфата
калия?
Zn(NO3)2 K2SO4
Zn(NO3)2 K2SO4
Слайд 21Ответ.
Zn(NO3)2 ↔ Zn2+ + 2NO3–
Н2O ↔ Н+ + ОН –
____________________________________________________________________________________________________________________
Zn2+
+ 2NO3– + Н2O ↔ ZnOН+ + 2NO3– + Н+
Zn2+ + Н2O ↔ ZnOН+ + Н+ (среда кислая)
Zn(NO3)2 + Н2O ↔ ZnOНNO3 + НNO3
K2SO4 ↔ 2K+ + SO42–
Н2O ↔ Н+ + ОН –
__________________________________________________________________________________________________________________
2K+ + SO42– + Н2O ↔ 2K+ + SO42– + H2O
(среда нейтральная)
Zn2+ + Н2O ↔ ZnOН+ + Н+ (среда кислая)
Zn(NO3)2 + Н2O ↔ ZnOНNO3 + НNO3
K2SO4 ↔ 2K+ + SO42–
Н2O ↔ Н+ + ОН –
__________________________________________________________________________________________________________________
2K+ + SO42– + Н2O ↔ 2K+ + SO42– + H2O
(среда нейтральная)
Слайд 23Ответ.
СаBr2 металл и неметалл– ионная
HCl два разных
по силе э.о. неметалла – ковалентная полярная
LiNO3 металл и неметалл – ионная, два разных по силе эо неметалла – ковалентная полярная
O
Li – O – N
O
LiNO3 металл и неметалл – ионная, два разных по силе эо неметалла – ковалентная полярная
O
Li – O – N
O
Слайд 24Четвёртый вопрос.
Какое изменение параметров будет способствовать сдвигу химического равновесия в сторону
прямой реакции:
N2(газ) + O2(газ) 2NO2(газ) - Q
N2(газ) + O2(газ) 2NO2(газ) - Q
Слайд 25Ответ.
N2(газ) + O2(газ) 2NO2(газ) - Q
Увеличение температуры
Увеличение концентрации
N2 и O2
Уменьшение концентрации NO2
Уменьшение концентрации NO2
Слайд 27Ответ.
В атоме не может быть двух электронов, у которых все
четыре квантовых числа одинаковые.
-1/2+1/2 - по принципу Паули
-1/2+1/2 - по принципу Паули
вопреки принципу Паули
Слайд 28Третий отборочный тур.
Какой химический элемент расположен в периодической системе Д. И.
Менделеева под номером 8.
Слайд 31Ответ.
Изотопы – совокупность атомов, имеющих одинаковое число протонов, но различающихся
количеством нейтронов в ядре атома.
Слайд 32Второй вопрос.
Какую среду будут иметь водные растворы сульфида натрия и
хлорида меди (2)
Na2S CuCl2
Na2S CuCl2
Слайд 33Ответ.
Na2S ↔ 2Na+ + S2–
Н2O ↔ Н+ + ОН –
______________________________________________________________________________________________________________________
2Na+
+ S2– + Н2O ↔ 2Na+ + HS– + ОН –
S2– + Н2O ↔ НS– + ОН – (среда щелочная)
Na2S + Н2O ↔ NaHS + NaОН
CuCl2 ↔ Cu2+ + 2Сl –
Н2O ↔ Н+ + ОН –
___________________________________________________________________________________________________________________
Cu2+ + Сl – + Н2O ↔ CuOH+ + Cl – + Н+
Сu2+ + Н2O ↔ СuOH+ + Н+ (среда кислая)
CuCl2 + Н2O ↔ CuOHCl + НCl
S2– + Н2O ↔ НS– + ОН – (среда щелочная)
Na2S + Н2O ↔ NaHS + NaОН
CuCl2 ↔ Cu2+ + 2Сl –
Н2O ↔ Н+ + ОН –
___________________________________________________________________________________________________________________
Cu2+ + Сl – + Н2O ↔ CuOH+ + Cl – + Н+
Сu2+ + Н2O ↔ СuOH+ + Н+ (среда кислая)
CuCl2 + Н2O ↔ CuOHCl + НCl
Слайд 36Четвёртый вопрос.
Какое изменение параметров будет способствовать сдвигу химического равновесия в сторону
прямой реакции:
CO2(газ) + C(тв) 2CO(газ) - Q
CO2(газ) + C(тв) 2CO(газ) - Q
Слайд 37Ответ.
CO2(газ) + C(тв) 2CO(газ) - Q
Уменьшение
давления
Увеличение температуры
Увеличение концентрации CO2
Уменьшение концентрации CO
Увеличение температуры
Увеличение концентрации CO2
Уменьшение концентрации CO
Слайд 38Пятый вопрос.
Назовите химический элемент, который имеет такую структурно-графическую формулу:
Слайд 39Ответ.
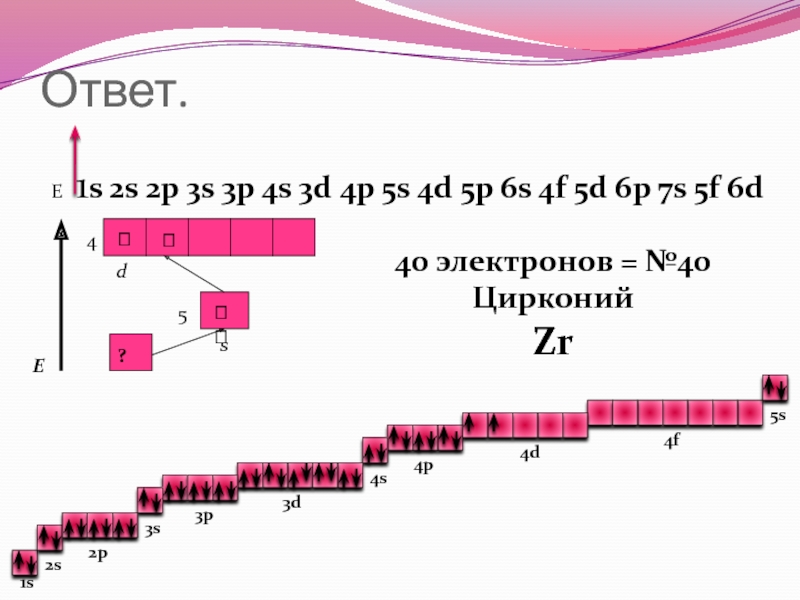
Е
1s 2s
2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
5s
40 электронов = №40
Цирконий
Zr
Слайд 43Ответ.
n – главное квантовое число, характеризует общую энергию электрона данного
уровня, номер периода в ПСХЭ соотствует количеству энергетических уровней в атоме, n принимает целые значения
l – побочное квантовое число; уточняет запас энергии электрона на энергетическом уровне, харартеризует связь e с ядром, а так же форму АО. Значения от 0 до n-1
m1 – магнитное орбитальное квантовое число
ms – магнитное спиновое квантовое число характеризует чисто квантовое свойство электрона
l – побочное квантовое число; уточняет запас энергии электрона на энергетическом уровне, харартеризует связь e с ядром, а так же форму АО. Значения от 0 до n-1
m1 – магнитное орбитальное квантовое число
ms – магнитное спиновое квантовое число характеризует чисто квантовое свойство электрона
Слайд 44Второй вопрос.
Какую среду будет иметь водный раствор сульфита натрия и нитрата
бария
Na2SO3 Ba(NO3)2
Na2SO3 Ba(NO3)2
Слайд 45Ответ.
Na2SO3 ↔ 2Na+ + SO32–
Н2O ↔ Н+ + ОН –
_______________________________________________________________
2Na+
+ SO32– + Н2O ↔ 2Na+ + HSO3– + ОН-
SO32– + Н2O ↔ НSO3– + ОН – (среда щелочная)
Na2SO3 + Н2O = NaHSO3+ NaОН
Ba(NO3)2 ↔ Ba2+ + 2NO3–
Н2O ↔ Н+ + ОН –
________________________________________________________________________________________________________________
Ba2+ + 2NO3– + Н2O ↔ Ba2+ + 2NO3– + Н2O
(среда нейтральная)
SO32– + Н2O ↔ НSO3– + ОН – (среда щелочная)
Na2SO3 + Н2O = NaHSO3+ NaОН
Ba(NO3)2 ↔ Ba2+ + 2NO3–
Н2O ↔ Н+ + ОН –
________________________________________________________________________________________________________________
Ba2+ + 2NO3– + Н2O ↔ Ba2+ + 2NO3– + Н2O
(среда нейтральная)
Слайд 46Третий вопрос.
Даны формулы веществ: C2H4, CH4, C(алмаз), определите в каком типе
гибридизации находятся центральные атомы.
Слайд 50Четвёртый вопрос.
Какое изменение параметров будет способствовать сдвигу химического равновесия в сторону
прямой реакции:
N2(газ) + 3H2(газ) 2NH3(газ)+Q
N2(газ) + 3H2(газ) 2NH3(газ)+Q
Слайд 51Ответ.
Уменьшение температуры
Увеличение давления
Увеличение концентрации N2 и H2
Уменьшение концентрации NH3
N2(газ) +
3H2(газ) 2NH3(газ)+Q
Слайд 52Пятый вопрос.
Назовите химический элемент, который имеет такую структурно-графическую формулу:
Слайд 53Ответ.
Е
1s 2s
2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
5s
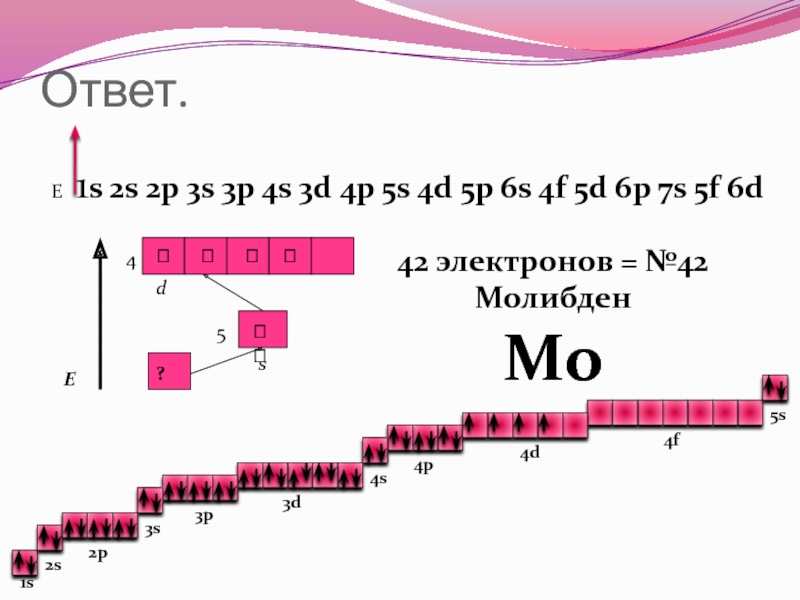
42 электронов = №42
Молибден
Мо
Слайд 58Второй вопрос.
Установите соответствие между составом соли и реакцией среды её водного
раствора.
Слайд 59Ответ.
NaNO2 – сильное основание, слабая кислота
Al2(SO4)3 – слабое основание,
сильная кислота
NaNO3 – сильное основание, сильная кислота
KCN – сильное основание, слабая кислота
NaNO3 – сильное основание, сильная кислота
KCN – сильное основание, слабая кислота
Слайд 61Ответ.
О2 – два одинаковых неметалла – ковалентная неполярная
Na – металл -
металлическая
HCOOК – между неметаллами ковалентная полярная, между металлом и неметаллом – ионная
O
H – C
O K
HCOOК – между неметаллами ковалентная полярная, между металлом и неметаллом – ионная
O
H – C
O K
Слайд 62Четвёртый вопрос.
В какую сторону сместится химическое равновесие
2NO(газ)+ O2(газ)
2NO2(газ) + Q
А) увеличить давление,
Б) уменьшить температуру
А) увеличить давление,
Б) уменьшить температуру
Слайд 65Ответ.
Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы
главного и орбитального квантовых чисел n + l. При одинаковой сумме раньше заполняется орбиталь с меньшим значением n.
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d
Слайд 66Шестой отборочный тур.
Назовите элемент, который расположен в периодической таблице Д. И.
Менделеева во втором периоде, третьей группе, главной подгруппе.
Слайд 68Первый вопрос.
Какую среду будет иметь водный раствор хлорида аммония и сульфида
алюминия?
NH4Cl Al2S3
NH4Cl Al2S3
Слайд 69Ответ.
NH4Cl ↔ NH4+ + Сl–
Н2O ↔ Н+ + ОН–
____________________________________________________________________________________________________
NH4+ + Сl– + Н2O ↔ NH3·H2О + Сl– + Н+
NH4+ + Н2O ↔ NH3·H2О + Н+ кислая среда
NH4Cl + Н2O ↔ NH3·H2О + НСl
Al2S3 + 6H2O-->2Al(OH)3 + 3H2S полный гидролиз
NH4+ + Н2O ↔ NH3·H2О + Н+ кислая среда
NH4Cl + Н2O ↔ NH3·H2О + НСl
Al2S3 + 6H2O-->2Al(OH)3 + 3H2S полный гидролиз
Слайд 70Второй вопрос.
Определите химический элемент по электронно-графической формуле
1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d7
Слайд 73Ответ.
KOH – металл и неметалл – ионная, между кислородом и
водородом – ковалентная полярная
Cl2 – одинаковые неметаллы – ковалентная неполярная
SO2 – разные неметаллы – ковалентная полярная
Cl2 – одинаковые неметаллы – ковалентная неполярная
SO2 – разные неметаллы – ковалентная полярная
Слайд 74Четвёртый вопрос.
В какую сторону сместится химическое равновесие в системе:
N2 + 3H2
2NH3 + Q
А) уменьшить давление
Б) увеличить концентрацию N2
А) уменьшить давление
Б) увеличить концентрацию N2