- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Химия 10 класс. Профильный уровень. Атом-сложная частица
Содержание
- 1. Презентация. Химия 10 класс. Профильный уровень. Атом-сложная частица
- 2. Модель атома Томсона (1904г.)В 1904 г. в
- 3. Планетарная модель атома Резерфорда (1911г.)Планетарная модель атома
- 4. Эксперимент Гейгера и МарсденаБольшинство частиц проходят
- 5. Модель атома Бора (1913г.)
- 6. Слайд 6
- 7. Квантово-механическая теория строения атомаЭлектрон имеет двойственную природуе-
- 8. Электронная оболочка-совокупность всех е- атома.
- 9. Форма орбиталей и облаков
- 10. Магнитное квантовое число mi характеризует направление орбиталей
- 11. Квантово-механическая теория строения атомаСпиновое квантовое число ms
- 12. Принцип Паули: В атоме не может быть
- 13. Квантово-механическая теория строения атомаПравило Клечковского «Принцип наименьшей
- 14. Слайд 14
Слайд 2Модель атома Томсона (1904г.)
В 1904 г. в работе «О структуре
В этой модели атом подобен сферической массе пудинга с положительным зарядом, внутрь сферы вкраплены отрицательно заряженные «сливины» или «изюмины» как капли - электроны. Поэтому модель Томсона называется «капельная».
Электроны совершают колебательные движения, благодаря которой атом излучает энергию. Атом в целом электронейтрален.
Модель Томсона не была подтверждена экспериментально и оставалась только гипотезой.
Представление о составе атома и движении электронов в нем вошли в модель атома Эрнеста Резерфорда.
Слайд 3Планетарная модель атома Резерфорда (1911г.)
Планетарная модель атома Резерфорда ( 1911 г.
Э.Резерфорд - основоположник современного учения об атоме - построил наглядную теоретическую модель атома, которой формально мы пользуемся и сейчас.
Классическая теория Резерфорда не могла объяснить излучение и поглощение энергии атомов.
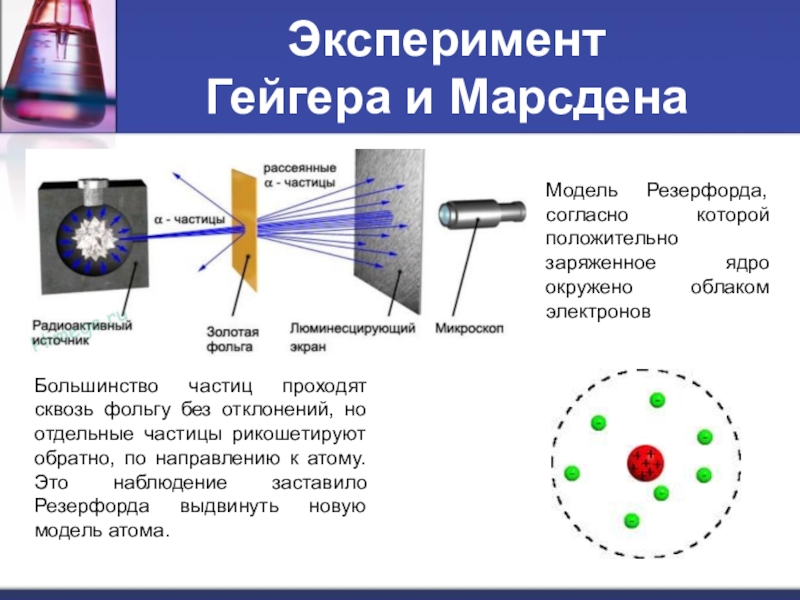
Слайд 4Эксперимент
Гейгера и Марсдена
Большинство частиц проходят сквозь фольгу без отклонений, но
Модель Резерфорда, согласно которой положительно заряженное ядро окружено облаком электронов
Слайд 6
Вещество Поле
Молекулы
Атомы
Ядро + Электроны е-
Протоны Нейтроны
р+ n0
Протонно-нейтронная модель атома (1932г.)
Д.Д. Иванченко (СССР) и Вернер Карл Гейзинберг (Германия)
№ пор= заряд ядра = р+ = е-
n0 = Ar - № пор
Слайд 7Квантово-механическая теория строения атома
Электрон имеет двойственную природу
е-
частица волна
Согласно принципам квантовой механики, состояние электрона в атоме описывается рядом показателей об его энергии и положении в пространстве, т.е. характеризуется четырьмя так называемыми квантовыми числами.
Слайд 8 Электронная оболочка-совокупность всех е- атома.
Главное квантовое
Энергетический уровень – совокупность орбиталей имеющих одинаковое главное квантовое число (близки по размеру и энергии)
n 1 2 3 4 5 6 7
Энергетический уровень K L M N О P Q
Совокупность электронов на одном энергетическом уровне – электронный слой
Число энергетических уровне = номеру периода
N=2n2 максимальное число электронов на энергетическом уровне
Квантово-механическая теория строения атома
Слайд 9 Форма орбиталей и облаков характеризуется побочным (орбитальным) квантовым
Для орбиталей одного энергетического уровня l принимает значения
от 0 до n-1, число орбиталей = n2
Квантово-механическая теория строения атома
l=0
<
l=1
<
l=2
<
l=3
Слайд 10Магнитное квантовое число mi характеризует направление орбиталей в
пространстве . Может
Число значений mi определяет число орбиталей на подуровне
l
Квантово-механическая теория строения атома
Слайд 11Квантово-механическая теория строения атома
Спиновое квантовое число ms характеризует вращение электрона вокруг
своей оси и принимает значения: +½ ↑ и -½ ↓
Правило Хунда. Электроны заполняют с одинаковой энергией орбитали одиночными электронами с одинаково направленными спинами, лишь после этого идет заполнение этих орбиталей вторым электроном.
Запись, отражающая распределение электронов в атоме химического элемента по энергетическим уровням и подуровням, называется электронной конфигурацией этого атома.
Слайд 12Принцип Паули: В атоме не может быть двух электронов с одинаковым
Слайд 13Квантово-механическая теория строения атома
Правило Клечковского «Принцип наименьшей энергии»:
Электроны в основном
В Последовательность заполнения орбиталей зависит от значения главного квантового числа (n) и побочного квантового числа (l).