- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад диссоциация неорганических соединений
Содержание
- 1. Презентация диссоциация неорганических соединений
- 2. Диссоциация кислот При диссоциации кислот роль катионов играют ионы
- 3. Отрицательные ионы (анионы), отщепляемые от молекулы кислоты,
- 4. Диссоциация оснований При диссоциации оснований роль анионов играют гидроксид-ионы(ОH-),
- 5. Многокислотные основания диссоциируют, по аналогии с кислотами,
- 6. Диссоциация солей Соли диссоциируют в воде на анионы
- 7. Диссоциация нормальной соли: K3PO4 ↔ 3K+ +
- 8. Задания Напишите уравнения процессов диссоциации: HCL, Ca(OH)2 ,
- 9. ОтветыHCl ↔ H + + Cl-Ca(OH)2 ↔
Диссоциация кислот При диссоциации кислот роль катионов играют ионы водорода(H+), других катионов при диссоциации кислот не образуется:HF ↔ H+ + F- HNO3 ↔ H+ + NO3-
Слайд 2Диссоциация кислот
При диссоциации кислот роль катионов играют ионы водорода(H+), других катионов при
диссоциации кислот не образуется:
HF ↔ H+ + F- HNO3 ↔ H+ + NO3-
HF ↔ H+ + F- HNO3 ↔ H+ + NO3-
Слайд 3 Отрицательные ионы (анионы), отщепляемые от молекулы кислоты, составляеют кислотный остаток.
Одной из характеристик
диссоциации кислот является их основность - число ионов водорода, содержащихся в молекуле кислоты, которые могут образоываваться при диссоциации:
одноосновные кислоты: HCl, HF, HNO3;
двухосновные кислоты: H2SO4, H2CO3;
трехосновные кислоты: H3PO4.
Процесс отщепления катионов водорода в многоосновных кислотах происходит ступенчато.
одноосновные кислоты: HCl, HF, HNO3;
двухосновные кислоты: H2SO4, H2CO3;
трехосновные кислоты: H3PO4.
Процесс отщепления катионов водорода в многоосновных кислотах происходит ступенчато.
Слайд 4Диссоциация оснований
При диссоциации оснований роль анионов играют гидроксид-ионы(ОH-), других анионов при диссоциации
оснований не образуется:
NaOH ↔ Na+ + OH-
Кислотность основания определяется кол-вом гидроксид-ионов, образующихся при диссоциации одной молекулы основания:
однокислотные основания - KOH, NaOH;
двухкислотные основания - Ca(OH)2;
трехкислотные основания - Al(OH)3.
NaOH ↔ Na+ + OH-
Кислотность основания определяется кол-вом гидроксид-ионов, образующихся при диссоциации одной молекулы основания:
однокислотные основания - KOH, NaOH;
двухкислотные основания - Ca(OH)2;
трехкислотные основания - Al(OH)3.
Слайд 5 Многокислотные основания диссоциируют, по аналогии с кислотами, также ступенчато - на
каждом этапе отщепляется по одному гидроксид-иону:
Zn(OH)2 ↔ ZnOH+ + OH- ZnOH+ ↔ Zn2+ + OH-
Некоторые вещества, в зависимости от условий, могут выступать, как в роли кислот, так и в роли оснований. Такие вещества называются амфотерными.
Диссоциация Zn(OH)2, как основания:
Zn(OH)2 ↔ ZnOH+ + OH- ZnOH+ ↔ Zn2+ + OH- Диссоциация Zn(OH)2, как кислоты:
Zn(OH)2 + 2H2O ↔ 2H+ + [Zn(OH)4]2-
Zn(OH)2 ↔ ZnOH+ + OH- ZnOH+ ↔ Zn2+ + OH-
Некоторые вещества, в зависимости от условий, могут выступать, как в роли кислот, так и в роли оснований. Такие вещества называются амфотерными.
Диссоциация Zn(OH)2, как основания:
Zn(OH)2 ↔ ZnOH+ + OH- ZnOH+ ↔ Zn2+ + OH- Диссоциация Zn(OH)2, как кислоты:
Zn(OH)2 + 2H2O ↔ 2H+ + [Zn(OH)4]2-
Слайд 6Диссоциация солей
Соли диссоциируют в воде на анионы кислотных остатков и катионы
металлов.
Классификация диссоциации солей:
Нормальные (средние) соли диссоциируют на катионы металла и однокислотного остатка: NaNO3, Fe2(SO4)3, K3PO4.
Кислые соли диссоциируют ступенчато с образованием катионов металла, анионов кислотного остатка и катиона водорода: NaHCO3, KH2PO4, NaH2PO4.
Основные соли диссоциируют с образованием катионов металла, анионов кислотного остатка и гидроксид-иона: (CuOH)2CO3, Mg(OH)Cl.
Двойные соли получаются одновременным замещением атомов водорода в кислоте на атомы различных металлов: KAl(SO4)2.
Смешанные соли диссоциируют на катионы металла и анионы нескольких кислотных остатков: CaClBr.
Классификация диссоциации солей:
Нормальные (средние) соли диссоциируют на катионы металла и однокислотного остатка: NaNO3, Fe2(SO4)3, K3PO4.
Кислые соли диссоциируют ступенчато с образованием катионов металла, анионов кислотного остатка и катиона водорода: NaHCO3, KH2PO4, NaH2PO4.
Основные соли диссоциируют с образованием катионов металла, анионов кислотного остатка и гидроксид-иона: (CuOH)2CO3, Mg(OH)Cl.
Двойные соли получаются одновременным замещением атомов водорода в кислоте на атомы различных металлов: KAl(SO4)2.
Смешанные соли диссоциируют на катионы металла и анионы нескольких кислотных остатков: CaClBr.
Слайд 7 Диссоциация нормальной соли:
K3PO4 ↔ 3K+ + PO43-
Диссоциация кислой соли:
NaHCO3 ↔ Na+ + HCO3- HCO3- ↔ H+ + CO32-
Диссоциация основной соли:
Mg(OH)Cl ↔ Mg(OH)+ + Cl- Mg(OH)+ ↔ Mg2+ + OH-
Диссоциация двойной соли:
KAl(SO4)2 ↔ K+ + Al3+ + 2SO42-
Диссоциация смешанной соли:
CaClBr ↔ Ca2+ + Cl- + Br-
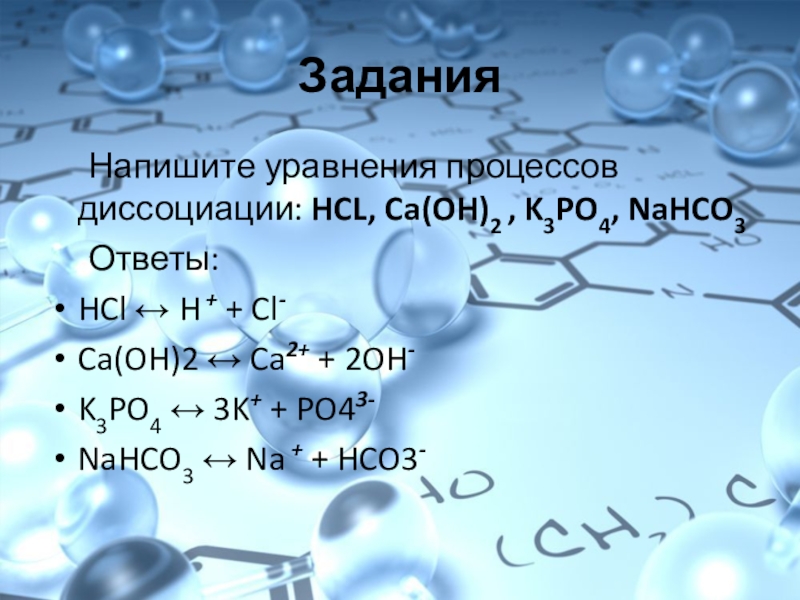
Слайд 8Задания
Напишите уравнения процессов диссоциации: HCL, Ca(OH)2 , K3PO4, NaHCO3
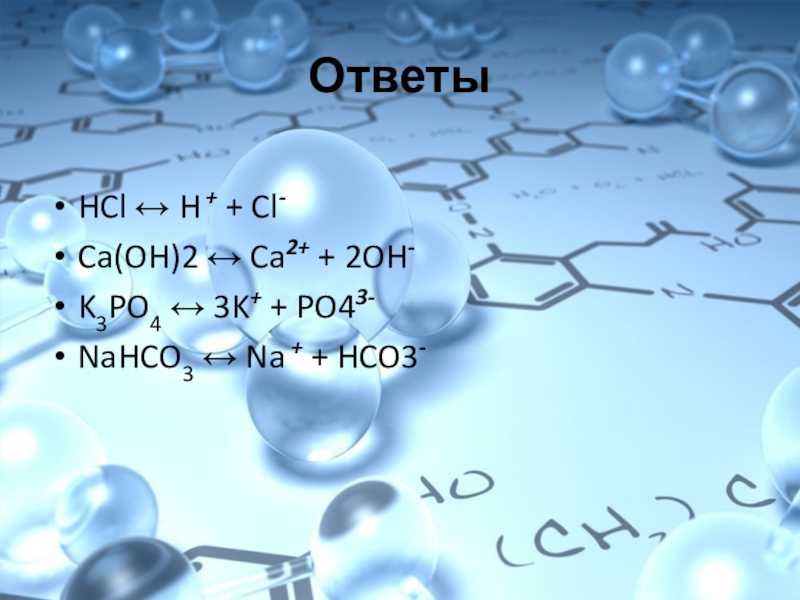
Ответы:
HCl ↔ H
+ + Cl-
Ca(OH)2 ↔ Ca2+ + 2OH-
K3PO4 ↔ 3K+ + PO43-
NaHCO3 ↔ Na + + HCO3-
Ca(OH)2 ↔ Ca2+ + 2OH-
K3PO4 ↔ 3K+ + PO43-
NaHCO3 ↔ Na + + HCO3-