- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Общая характеристика НеМе
Содержание
- 1. Общая характеристика НеМе
- 2. Из 109 известных элементов более 20 относятся
- 3. ПОЛОЖЕНИЕ НЕМе В ПЕРИОДИЧЕСКЙ СИСТЕМЕ НеМе в
- 4. Характеристика неметалличности Особенности:-высокие заряды ядер;-большое число электронов
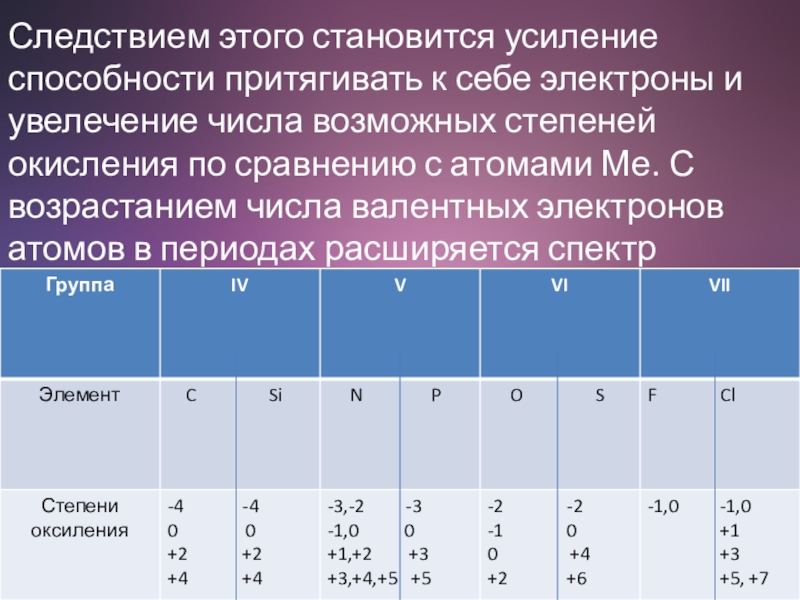
- 5. Следствием этого становится усиление способности притягивать к
- 6. ФИЗИЧЕСКИЕ СВОЙСТВАФиз. свойства НеМе в отличие от
- 7. 7 элементов НеМе существуют в виде двухатомных
- 8. Слайд 8
- 9. ХИМИЧЕСКИЕ СВОЙСТВАI НеМе как окислители:1.При взаимодействие с
- 10. 1.4 Проявляется в реакциях со сложными веществами.
- 11. II НеМеталлы как восстановители НеМе (кроме фтора)
- 12. 2.2 Многие НеМе выступают в роли восстановителей
- 13. РЕАКЦИИ САМООКИСЛЕНИЯ-САМОВОССТАНОВЛЕНИЯВ реакциях один и тот же
- 14. КРАТКАЯ ХАР-КА ОКСИДОВ И ГИДРОКСИДОВ НЕМЕТАЛЛОВОксиды НеМе
- 15. Краткая хар-ка водородных соединений НеМе Водородные соединения
- 16. РАБОТА В КЛАССЕ
- 17. Слайд 17
- 18. Слайд 18
- 19. Домашняя работа:1.Учить все2.Доделать работу в классе
Из 109 известных элементов более 20 относятся к неметаллам. НеМе составляют : 84 % от массы почвы.98,5% от массы растения.97,6 % от массы тела человека.Шесть НеМе – С, Н, N, P, S, О являются органогенными, так
Слайд 2Из 109 известных элементов более 20 относятся к неметаллам.
НеМе составляют
:
84 % от массы почвы.
98,5% от массы растения.
97,6 % от массы тела человека.
Шесть НеМе – С, Н, N, P, S, О являются органогенными, так как входят в состав молекул белков, жиров, углеводов и нуклеиновых кислот.
Воздух которым мы дышим, представляет собой смесь простых и сложных веществ (О2, N2, CO2, Ar и др. благородные газы. )
84 % от массы почвы.
98,5% от массы растения.
97,6 % от массы тела человека.
Шесть НеМе – С, Н, N, P, S, О являются органогенными, так как входят в состав молекул белков, жиров, углеводов и нуклеиновых кислот.
Воздух которым мы дышим, представляет собой смесь простых и сложных веществ (О2, N2, CO2, Ar и др. благородные газы. )
Слайд 3ПОЛОЖЕНИЕ НЕМе В ПЕРИОДИЧЕСКЙ СИСТЕМЕ
НеМе в периодической системе расположены справа
от диагонали “бор-астат”. Это элементы главных подгрупп III, IV, V, VI, VII и VIII групп.
К неметаллами также относятся благородные газы.
Среди НеМе два элемента – водород и гелий относятся к s-семейству, все остальные принадлежат к p-семейству.
К неметаллами также относятся благородные газы.
Среди НеМе два элемента – водород и гелий относятся к s-семейству, все остальные принадлежат к p-семейству.
Слайд 4Характеристика неметалличности
Особенности:
-высокие заряды ядер;
-большое число электронов на внешнем энергетическом уровне
(кроме H, B, He);
-маленькие радиусы;
-высокие энергии ионизации и относительные электроотрицательности.
-маленькие радиусы;
-высокие энергии ионизации и относительные электроотрицательности.
Слайд 5Следствием этого становится усиление способности притягивать к себе электроны и увелечение
числа возможных степеней окисления по сравнению с атомами Ме. С возрастанием числа валентных электронов атомов в периодах расширяется спектр степеней окисления атомов.
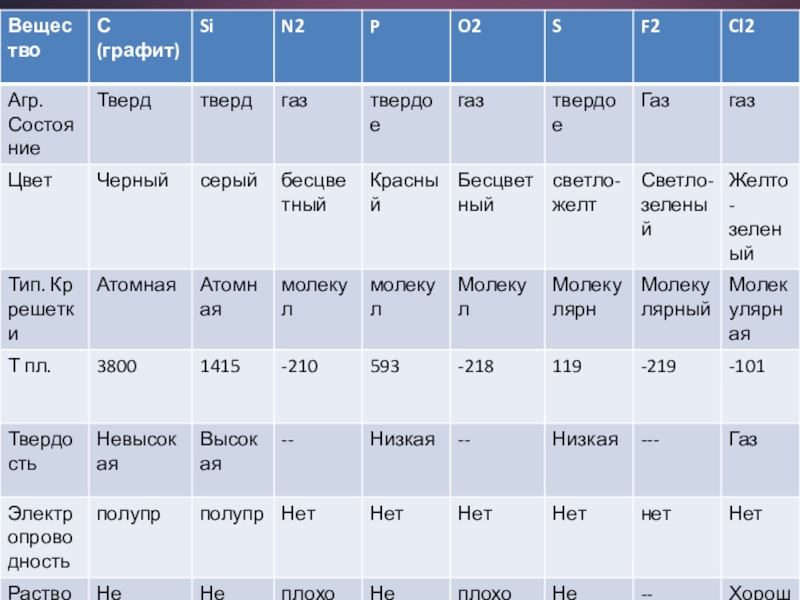
Слайд 6ФИЗИЧЕСКИЕ СВОЙСТВА
Физ. свойства НеМе в отличие от Ме, довольно разнообразны, поскольку
среди неметаллов есть вещества молекулярного и немолекулярного строения.
Элементы НеМе образуют простые в-ва, которые при н.у. образуют разные агрегатные состояния:
1.Газы (благородные (VIIIA, H2, O2, N2, F2, Cl2)
2.Жидкость (Br2)
3.Твердые вещества (I2, C, Si, S, P и др.)
Элементы НеМе образуют простые в-ва, которые при н.у. образуют разные агрегатные состояния:
1.Газы (благородные (VIIIA, H2, O2, N2, F2, Cl2)
2.Жидкость (Br2)
3.Твердые вещества (I2, C, Si, S, P и др.)
Слайд 77 элементов НеМе существуют в виде двухатомных молекул: F2, Cl2, Br2,
I2, H2, O2, N2.
В кристаллической решетки НеМе нет свободных электронов. В связи с этим твердые вещества-неметаллы в отличие от металлов плохо проводят тепло и электричество, не обладают пластичностью.
Углерод, фосфор, кислород, сера имеют аллотропные модификации, отличающиеся структурой (углерод, фосфор, сера) или число атомов в молекуле (озон О3 или кислород О2)
В кристаллической решетки НеМе нет свободных электронов. В связи с этим твердые вещества-неметаллы в отличие от металлов плохо проводят тепло и электричество, не обладают пластичностью.
Углерод, фосфор, кислород, сера имеют аллотропные модификации, отличающиеся структурой (углерод, фосфор, сера) или число атомов в молекуле (озон О3 или кислород О2)
Слайд 9ХИМИЧЕСКИЕ СВОЙСТВА
I НеМе как окислители:
1.При взаимодействие с металлами (см. тему Ме)
1.2
При взаимодействие с водородом (см. тему ВОДОРОД)
1.3 Любой НеМе выступает в роли окислителя в реакциях с теми неметаллами, которые имеют более низкую ЭО:
2Р (0) + 5S(0) = P(+5)2S(-2)5
Сера-окислитель, а фосфор – восстановитель.
1.3 Любой НеМе выступает в роли окислителя в реакциях с теми неметаллами, которые имеют более низкую ЭО:
2Р (0) + 5S(0) = P(+5)2S(-2)5
Сера-окислитель, а фосфор – восстановитель.
Слайд 101.4 Проявляется в реакциях со сложными веществами. В основном это касается
кислорода (горение, окисление)
CH4 + 2O2 = CO2 + 2H2O (t)
4NH3 + 5O2 = 4NO + 6H2O (t, кат.)
1.5 Не только кислород, но и др. НеМе (F, Cl, Br и др.) могут играть роль окислителя.
2FeCl2 + Cl2 = 2FeCl3
Разной окислительной активностью обусловлена способность одних НеМе вытеснять другие из растворов их солей. Например бром, как более сильный оксилитель (ЭО(Br)>ЭО(I)) вытесняет йод в свободном виде из раствора йодида калия:
2KI + Br2 = 2KBr + I2
CH4 + 2O2 = CO2 + 2H2O (t)
4NH3 + 5O2 = 4NO + 6H2O (t, кат.)
1.5 Не только кислород, но и др. НеМе (F, Cl, Br и др.) могут играть роль окислителя.
2FeCl2 + Cl2 = 2FeCl3
Разной окислительной активностью обусловлена способность одних НеМе вытеснять другие из растворов их солей. Например бром, как более сильный оксилитель (ЭО(Br)>ЭО(I)) вытесняет йод в свободном виде из раствора йодида калия:
2KI + Br2 = 2KBr + I2
Слайд 11II НеМеталлы как восстановители
НеМе (кроме фтора) могут проявлять восстановительные свойства.
В образующихся соединениях НеМе проявляют положительные степени окисления. Высшая положит. Степень окисления равно номеру группы.
2.1 Все НеМе выступают в роли восстановителей при взаимодействие с кислородом.
4Р + 5О2 = 2Р2О5
2.1 Все НеМе выступают в роли восстановителей при взаимодействие с кислородом.
4Р + 5О2 = 2Р2О5
Слайд 122.2 Многие НеМе выступают в роли восстановителей в реакциях со сложными
веществами-окислителями:
-с кислотами окислителями
S + 6HNO3 = H2SO4 + 6 NO2 + 2H2O
-взаимодействие с солями-окислителями
6Р + 5КСlO3 = 5KCl + 3P2O5
Наиболее сильные восстановительные свойства имеют НеМе - C и H2
ZnO + C = Zn + CO
SiO2 + 2C = Si + 2CO
CuO + H2 = Cu + H2O
-с кислотами окислителями
S + 6HNO3 = H2SO4 + 6 NO2 + 2H2O
-взаимодействие с солями-окислителями
6Р + 5КСlO3 = 5KCl + 3P2O5
Наиболее сильные восстановительные свойства имеют НеМе - C и H2
ZnO + C = Zn + CO
SiO2 + 2C = Si + 2CO
CuO + H2 = Cu + H2O
Слайд 13РЕАКЦИИ САМООКИСЛЕНИЯ-САМОВОССТАНОВЛЕНИЯ
В реакциях один и тот же НеМе является одновременно и
окислителем, и восстановителем.
Сl2 + H2O = HCl + HClO
Cl2(0) +2e 2Cl(-1)
Cl2(0) 2Cl (+1)
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
Сl2 + H2O = HCl + HClO
Cl2(0) +2e 2Cl(-1)
Cl2(0) 2Cl (+1)
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
Слайд 14КРАТКАЯ ХАР-КА ОКСИДОВ И ГИДРОКСИДОВ НЕМЕТАЛЛОВ
Оксиды НеМе делятся на 2 группы:
-несолеобразующие
(SiO, N2O, NO, CO)
-солеобразующие (все остальные) .
В большинстве кислотные оксиды.
Кислотные оксиды – это ангидриды кислот.
CO2 – H2CO3
P2O5 – H3PO4 и т.п.
-солеобразующие (все остальные) .
В большинстве кислотные оксиды.
Кислотные оксиды – это ангидриды кислот.
CO2 – H2CO3
P2O5 – H3PO4 и т.п.
Слайд 15Краткая хар-ка водородных соединений НеМе
Водородные соединения представляют собой летучие газообразные
соединения (кроме H2O).
Они характеризуются различным отношениям к воде. Метан (СН4) и Силан (SiH4) в воде плохо растворимы.
Аммиак (NH3) и фосфин (PH3) в воде растворяются, образуя слабые основания NH4OH и PH4OH.
При растворение в воде сероводорода (H2S) , селеноводорода (H2Se) , телуроводорода (H2Te) и галогеноводородов образуются кислоты такого же состава.
Они характеризуются различным отношениям к воде. Метан (СН4) и Силан (SiH4) в воде плохо растворимы.
Аммиак (NH3) и фосфин (PH3) в воде растворяются, образуя слабые основания NH4OH и PH4OH.
При растворение в воде сероводорода (H2S) , селеноводорода (H2Se) , телуроводорода (H2Te) и галогеноводородов образуются кислоты такого же состава.