- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Исходная презентация Благородные газы для подготовки урока химии на повышенном уровне
Содержание
- 1. Исходная презентация Благородные газы для подготовки урока химии на повышенном уровне
- 2. Элементы 18 группыHe – гелий, Ne –
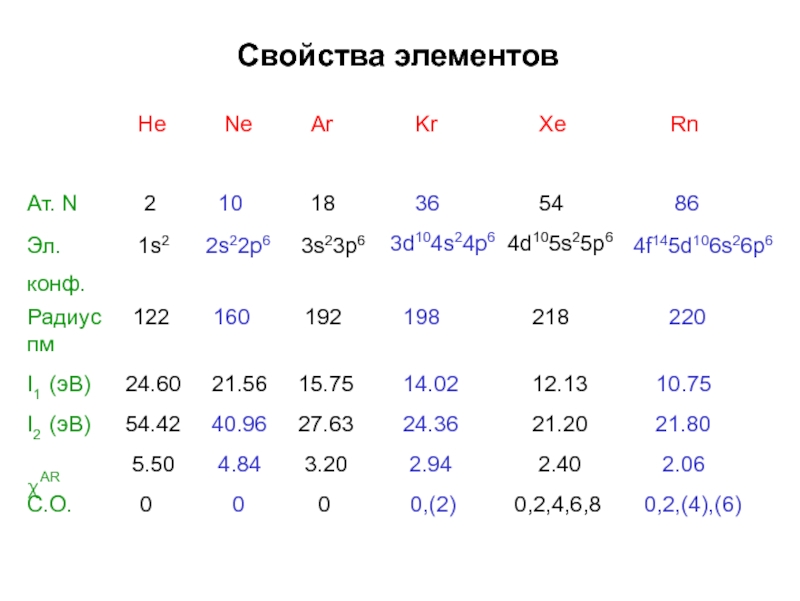
- 3. Свойства элементовHeNeArKrXeRn
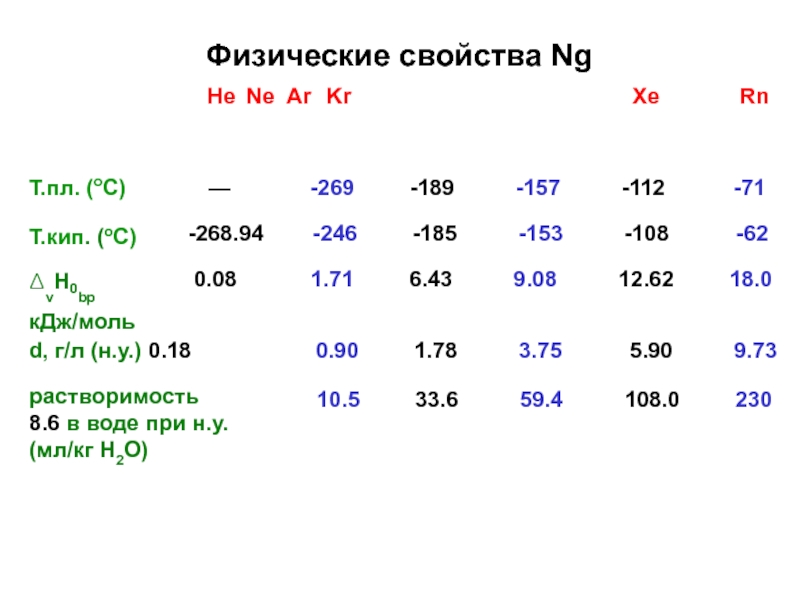
- 4. Физические свойства NgHe Ne Ar KrXeRnТ.пл. (оС)Т.кип. (оС)ΔvH0bpкДж/моль—-269-189-157-112-71-268.94-246-185-153-108-620.081.716.439.0812.6218.0d, г/л (н.у.) 0.180.9010.51.7833.63.7559.45.90108.09.73230растворимость 8.6 в воде при н.у. (мл/кг H2O)
- 5. Открытие Ng1. Аргон (ленивый, недеятельный) непрореагировавший остаток
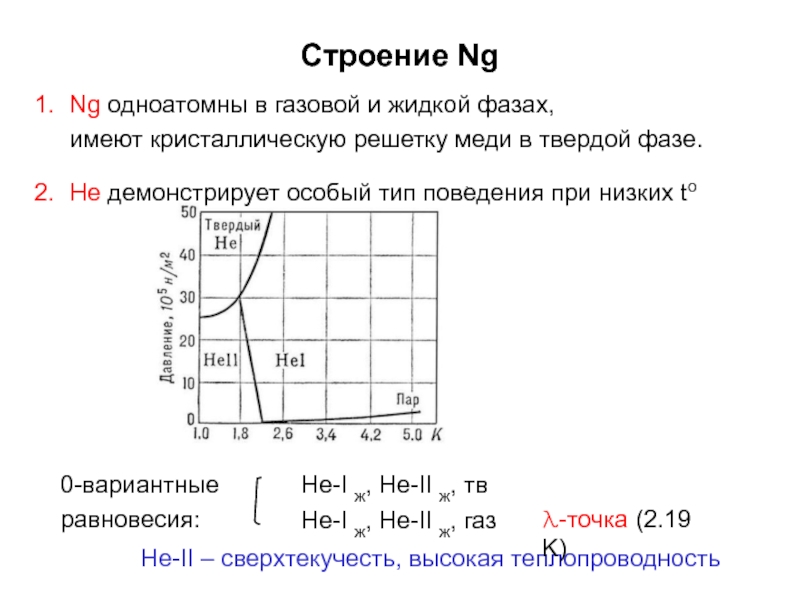
- 6. Строение NgHe-II – сверхтекучесть, высокая теплопроводностьNg одноатомны
- 7. Распространение NgHe – 2й по распространенности элемент
- 8. Получение и применение Ng1. He, Arиз природного
- 9. Соединения NgКороткоживущие ионы, содержащие Ng. Существуют только
- 10. Открытие химии Xe1. Первое истинное соединение Ng
- 11. Фториды XeXeF2140-109200линейнаяXeF4117-216195квадратнаяXeF649-294189октаэдрическаяТ.пл., оСΔfH0298, кДж/мольd(Xe–F), пм молекулярнаягеометрия2. Фториды Xe – наиболее стабильные соединения Xe
- 12. Фториды Xe3. ПолучениеXe (газ) + F2 (газ)XeF2
- 13. Фториды Xe4. РазделениеXeF2 XeF4 XeF6[Xe2F3][AsF6] XeF4 [XeF5][AsF6]AsF5
- 14. Фториды Xe6. Фторирующие агенты, окислителиXeF6 > XeF4
- 15. Фториды Xe7. Строение XeF2Строение всех фторидов Xe → метод ГиллеспиИонизация под давлением
- 16. Фторокомплексы Xe1. Фторокатионы Xe2XeF2 + SbF5 =
- 17. Фторокомплексы XeXeOF4XeF6 + H2O XeF4 + H2O
- 18. Кислородные соединения Xe1. Оксиды XeXeO3бесцветные кристаллы нелетучXeO4светло-желтый
- 19. Кислородные соединения XeПолучениеXeF6 + 3H2O = XeO3
- 20. 4. Окислители5XeO3 + 6MnSO4 + 9H2O =
- 21. Другие соединения XeСоли Xe2+[XeF]ClO4 + HClO4 (конц)
- 22. Другие соединения Xe3. Комплексные соединения(C6F5)3B + 3XeF2[C6F5Xe][BF4]
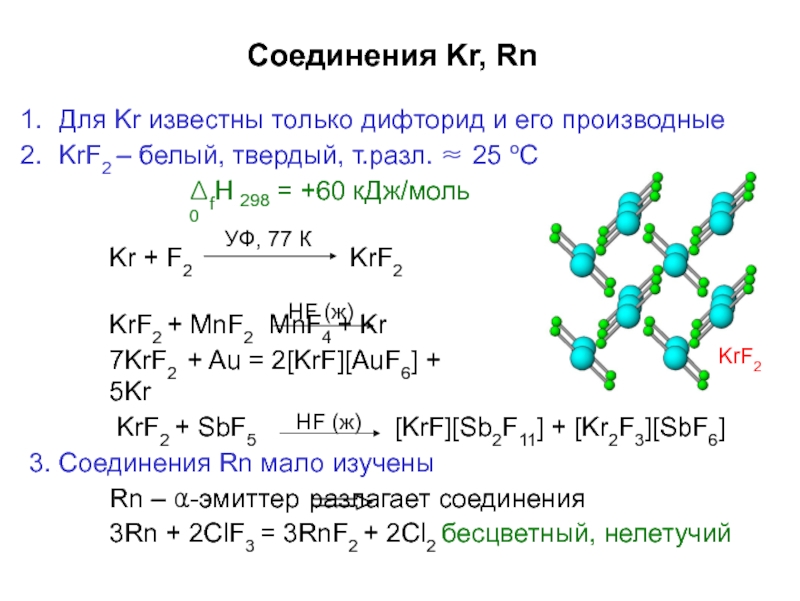
- 23. Соединения Kr, RnДля Kr известны только дифторид
Слайд 4Физические свойства Ng
He Ne Ar Kr
Xe
Rn
Т.пл. (оС)
Т.кип. (оС)
ΔvH0bp
кДж/моль
—
-269
-189
-157
-112
-71
-268.94
-246
-185
-153
-108
-62
0.08
1.71
6.43
9.08
12.62
18.0
d, г/л (н.у.) 0.18
0.90
10.5
1.78
33.6
3.75
59.4
5.90
108.0
9.73
230
растворимость 8.6 в воде при н.у.
Слайд 5Открытие Ng
1. Аргон (ленивый, недеятельный) непрореагировавший остаток воздуха Рамсэй, Рэлей, 1892
2.
анализ солнечного спектра. Локьер, 1894
3. Криптон (скрытный, секретный)
фракционирование воздуха. Рамсэй, 1898
4. Неон (новый)
спектральный анализ фракционированного воздуха
Рамсэй, 1898
5. Ксенон (чужой, странный)
спектральный анализ фракционированного воздуха
Рамсэй, 1898
6. Радон (аналог радия)
в продуктах распада радия. Резерфорд, Содди, 1901
Слайд 6Строение Ng
He-II – сверхтекучесть, высокая теплопроводность
Ng одноатомны в газовой и жидкой
имеют кристаллическую решетку меди в твердой фазе.
He демонстрирует особый тип поведения при низких to
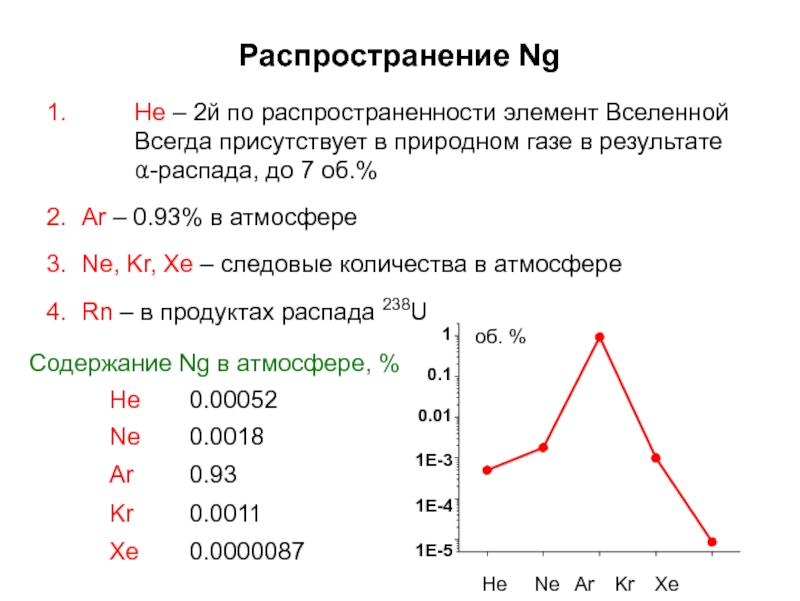
Слайд 7Распространение Ng
He – 2й по распространенности элемент Вселенной Всегда присутствует в
Ar – 0.93% в атмосфере
Ne, Kr, Xe – следовые количества в атмосфере
Rn – в продуктах распада 238U
Cодержание Ng в атмосфере, %
0.01
1E-3
1E-4
1E-5
He Ne Ar Kr Xe
0.1
1
об. %
Слайд 8Получение и применение Ng
1. He, Ar
из природного газа, после сжижения остальных
остаток после сжижения воздуха селективная адсорбция воздуха углем
Ne
Kr, Xe
He, Ar – создание инертной атмосферы в лаборатории и на производстве
He – как легкий, негорючий газ, охладитель, в дыхательной смеси для глубоководных работ
Ne, Kr, Xe – в разрядных лампах
Ar – наполнитель ламп накаливания
Rn – в медицине
XeF2 – как лабораторный окислитель
Xe – в ракетном топливе нового поколения
Слайд 9Соединения Ng
Короткоживущие ионы, содержащие Ng. Существуют только в газовой фазе при
Клатраты Ng. Устойчивы при н.у. Не содержат химической связи между атомами Ng и клатратной решеткой, кроме ван-дер-Ваальсова взаимодействия.
Истинные химические соединения. Образованы в основном Xe с наиболее электроотрицательными элементами – F, O, реже – N, Cl, C.
Слайд 10Открытие химии Xe
1. Первое истинное соединение Ng (Бартлетт, 1962)
Xe + PtF6
По аналогии с O2 + PtF6 = [O2][PtF6] I1(Xe) ≈ E(O2 → O2 ) ≈ 12.1 эВ
+
Эксперимент Бартлетта
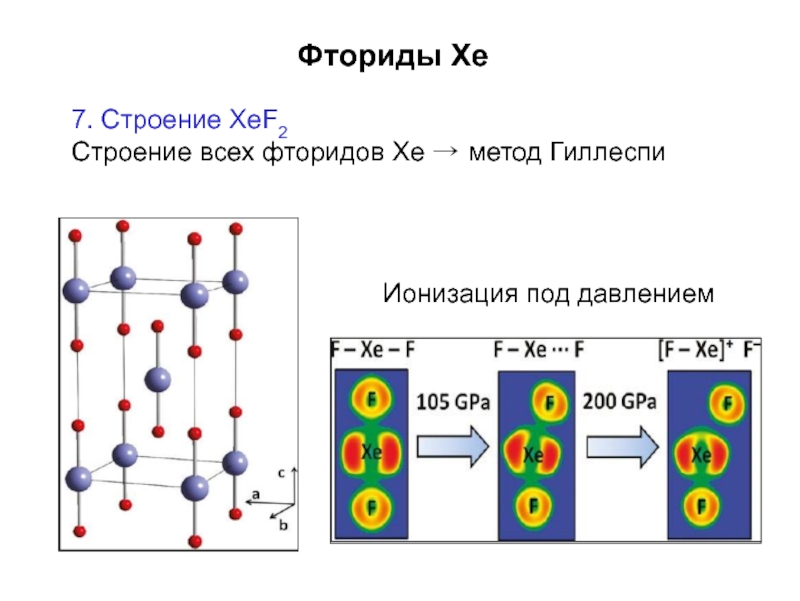
Слайд 11Фториды Xe
XeF2
140
-109
200
линейная
XeF4
117
-216
195
квадратная
XeF6
49
-294
189
октаэдрическая
Т.пл., оС
ΔfH0
298
, кДж/моль
d(Xe–F), пм молекулярная
геометрия
2. Фториды Xe – наиболее стабильные
Слайд 12Фториды Xe
3. Получение
Xe (газ) + F2 (газ)
XeF2 (тв)
ΔrH0
298
= -175 кДж/моль
Xe + 3F2
XeF6
Xe
XeF4
20 оС УФ
NiF2 100 оС
NiF2 300 оС
Всегда с примесью
XeF
2
Слайд 13Фториды Xe
4. Разделение
XeF2 XeF4 XeF6
[Xe2F3][AsF6] XeF4 [XeF5][AsF6]
AsF5 BrF3 (ж)
XeF5+
5. Гидролиз
2XeF2 +
медленно
6XeF4 + 12H2O = 2XeO3 + 4Xe + 24HF + 3O2 XeF6 + 3H2O = XeO3 + 6HF
Слайд 14Фториды Xe
6. Фторирующие агенты, окислители
XeF6 > XeF4 > XeF2
только в лаборатории
S
SF6 + 3Xe
HF (ж)
2Ir + 5XeF2 2IrF5 + 5Xe
5XeF2 + 2MnSO4 + 2H2O = 5Xe + 2HMnO4 + 10HF + 2H2SO4 RCOOH + XeF2 = RF + Xe + O2 + HF
2XeF6 + SiO2 = 2XeOF4 + SiF4
не red/ox !
HF (ж)
Слайд 16Фторокомплексы Xe
1. Фторокатионы Xe
2XeF2 + SbF5 = [Xe2F3][SbF6] XeF6 + SbF5
XeF2 + 2BiF5 = [XeF][Bi2F11]
(77 K)
Xe2F3
+
Mg(XeF2)(XeF4)(AsF6)4
[XeF][Bi2F11]
Слайд 17Фторокомплексы Xe
XeOF4
XeF6 + H2O XeF4 + H2O CsF + XeO3
XeOF4 +
устойчив
2. Оксофториды Xe
HF
HF
HF
XeF82–
3. Фтороксенаты
2CsF + XeF6 = Cs2[XeF8] т.разл. ≈ 450 оС
2CsF + XeF4 = Cs2[XeF6] т.разл. ≈ 600 оС
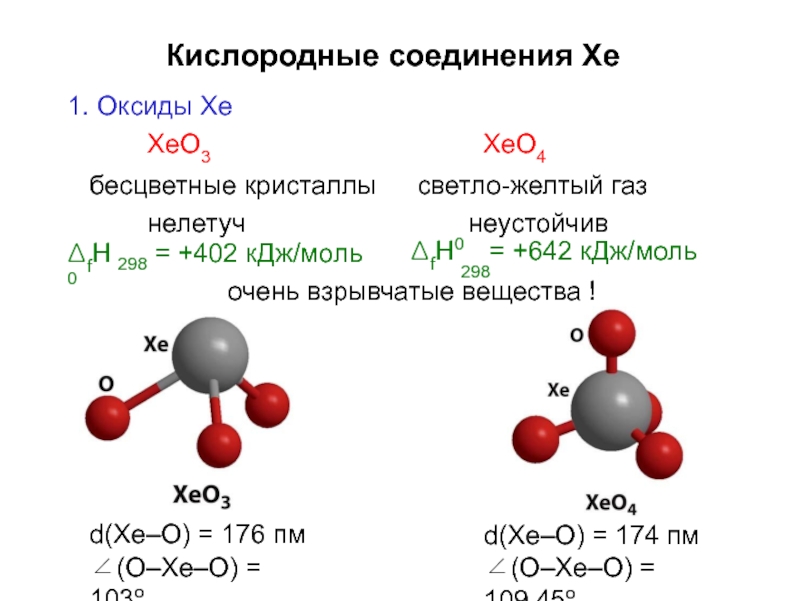
Слайд 18Кислородные соединения Xe
1. Оксиды Xe
XeO3
бесцветные кристаллы нелетуч
XeO4
светло-желтый газ неустойчив
ΔfH0
298
= +402 кДж/моль
ΔfH0 =
298
очень взрывчатые вещества !
d(Xe–O) = 176 пм
∠(O–Xe–O) = 103o
d(Xe–O) = 174 пм
∠(O–Xe–O) = 109.45o
Слайд 19Кислородные соединения Xe
Получение
XeF6 + 3H2O = XeO3 + 6HF
Na4XeO6 + 4H2SO4
Свойства
XeO3 + KOH = K[HXeO4]
гидроксоксенат
2K[HXeO4] + 2KOH (к) = Xe + O2 + K4XeO6 + H2O
перксенат
4XeF6 + 18Ba(OH)2 = 3Ba2XeO6 + Xe + 12BaF2 + 18H2O K4XeO6 + 2Na2SO4 + 8H2O = Na4XeO6·8H2O↓ + 2K2SO4
Слайд 204. Окислители
5XeO3 + 6MnSO4 + 9H2O = 5Xe + 6HMnO4 +
Кислородные соединения Xe
0
2 4 6
степень окисления
8
18
15
12
9
6
3
0
nE0
XeO
3
Xe
H4XeO4
HXeO6
3–
HXeO4
–
Слайд 21Другие соединения Xe
Соли Xe2+
[XeF]ClO4 + HClO4 (конц) = Xe(ClO4)2 + HF
Соединения со связью Xe–Cl, Xe–N
XeF2 + NaCl + 2SbF5 = [XeCl][Sb2F11] + NaF XeF2 + HN(SO2F)2 = FXeN(SO2F)2 + HF
Слайд 22Другие соединения Xe
3. Комплексные соединения
(C6F5)3B + 3XeF2
[C6F5Xe][BF4] + 2[C6F5Xe]F
Также известны: [AuXe4][Sb2F11]2
[AuXe4]2+
Xe2[Sb4F21]
Xe2 d(Xe–Xe)
парамагнитен устойчив до –60 оС
+
HF
d(Au–Xe) = 274 пм
Xe2OH2
Слайд 23Соединения Kr, Rn
Для Kr известны только дифторид и его производные
KrF2 –
ΔfH0
298
= +60 кДж/моль
Kr + F2
KrF2
KrF2 + MnF2 MnF4 + Kr
7KrF2 + Au = 2[KrF][AuF6] + 5Kr
KrF2 + SbF5
[KrF][Sb2F11] + [Kr2F3][SbF6]
3. Соединения Rn мало изучены
Rn – α-эмиттер разлагает соединения
3Rn + 2ClF3 = 3RnF2 + 2Cl2 бесцветный, нелетучий
УФ, 77 К
HF (ж)
HF (ж)
KrF2





![Исходная презентация Благородные газы для подготовки урока химии на повышенном уровне Открытие химии Xe1. Первое истинное соединение Ng (Бартлетт, 1962)Xe + PtF6 Открытие химии Xe1. Первое истинное соединение Ng (Бартлетт, 1962)Xe + PtF6 = Xe[PtF6] (оказалось смесью [XeF][Pt2F11] + …)По](/img/thumbs/82a3527d2f53e320d15280f1c34d8cc7-800x.jpg)


![Исходная презентация Благородные газы для подготовки урока химии на повышенном уровне Фториды Xe4. РазделениеXeF2 XeF4 XeF6[Xe2F3][AsF6] XeF4 [XeF5][AsF6]AsF5 BrF3 (ж)XeF5+5. Гидролиз2XeF2 + Фториды Xe4. РазделениеXeF2 XeF4 XeF6[Xe2F3][AsF6] XeF4 [XeF5][AsF6]AsF5 BrF3 (ж)XeF5+5. Гидролиз2XeF2 + 2H2O = 2Xe + 4HF +](/img/thumbs/b14b68fe3f5fe74f6ed8d12858873009-800x.jpg)

![Исходная презентация Благородные газы для подготовки урока химии на повышенном уровне Фторокомплексы Xe1. Фторокатионы Xe2XeF2 + SbF5 = [Xe2F3][SbF6] XeF6 + SbF5 Фторокомплексы Xe1. Фторокатионы Xe2XeF2 + SbF5 = [Xe2F3][SbF6] XeF6 + SbF5 = [XeF5][SbF6] XeF2 + HClO4 =](/img/thumbs/e8ee32ba7939ce430c1a3a949a34929f-800x.jpg)
![Исходная презентация Благородные газы для подготовки урока химии на повышенном уровне Фторокомплексы XeXeOF4XeF6 + H2O XeF4 + H2O CsF + XeO3XeOF4 + Фторокомплексы XeXeOF4XeF6 + H2O XeF4 + H2O CsF + XeO3XeOF4 + 2HF XeOF2 + 2HF Cs[XeO3F]устойчив2. Оксофториды](/img/thumbs/34bc47d1ad156094847a905d095df672-800x.jpg)


![Исходная презентация Благородные газы для подготовки урока химии на повышенном уровне Другие соединения XeСоли Xe2+[XeF]ClO4 + HClO4 (конц) = Xe(ClO4)2 + HF Другие соединения XeСоли Xe2+[XeF]ClO4 + HClO4 (конц) = Xe(ClO4)2 + HF XeF2 + HSO3F = Xe(SO3F)2Соединения со](/img/thumbs/2c5eb3e1069c9ffc966aec2a09333737-800x.jpg)
![Исходная презентация Благородные газы для подготовки урока химии на повышенном уровне Другие соединения Xe3. Комплексные соединения(C6F5)3B + 3XeF2[C6F5Xe][BF4] + 2[C6F5Xe]FТакже известны: [AuXe4][Sb2F11]2[AuXe4]2+Xe2[Sb4F21]Xe2 d(Xe–Xe) Другие соединения Xe3. Комплексные соединения(C6F5)3B + 3XeF2[C6F5Xe][BF4] + 2[C6F5Xe]FТакже известны: [AuXe4][Sb2F11]2[AuXe4]2+Xe2[Sb4F21]Xe2 d(Xe–Xe) = 309 пмпарамагнитен устойчив до –60](/img/thumbs/55a783176cdb300ed041d0e31b996cdd-800x.jpg)