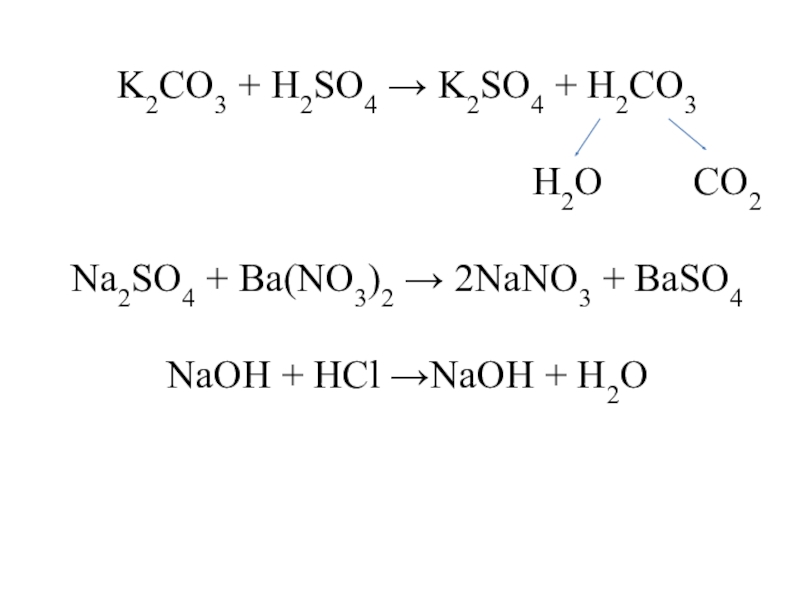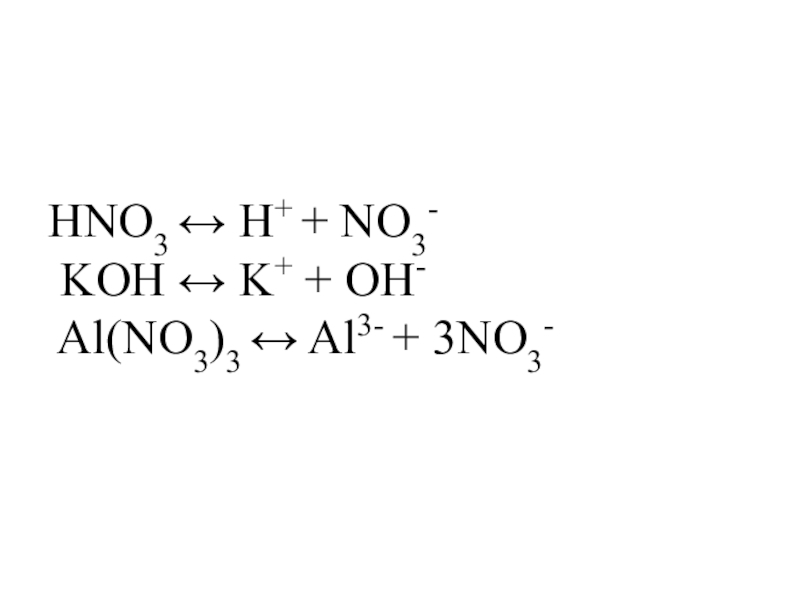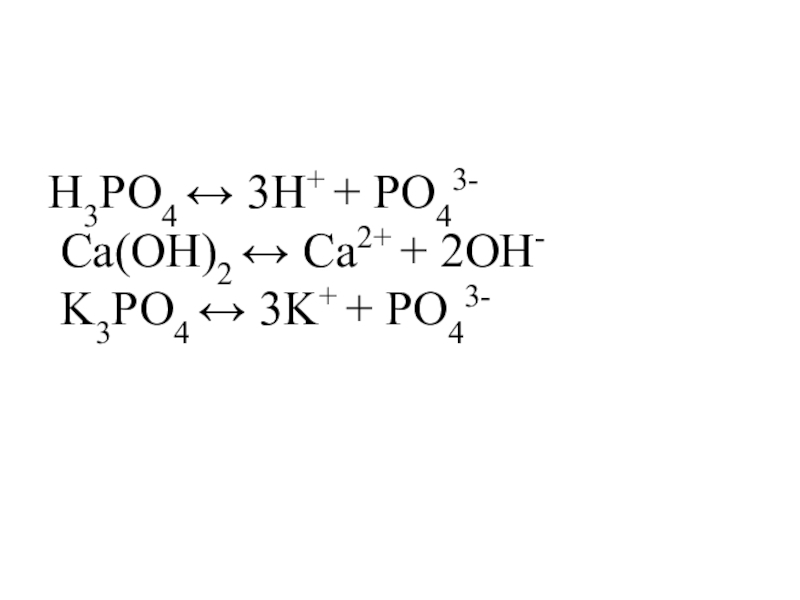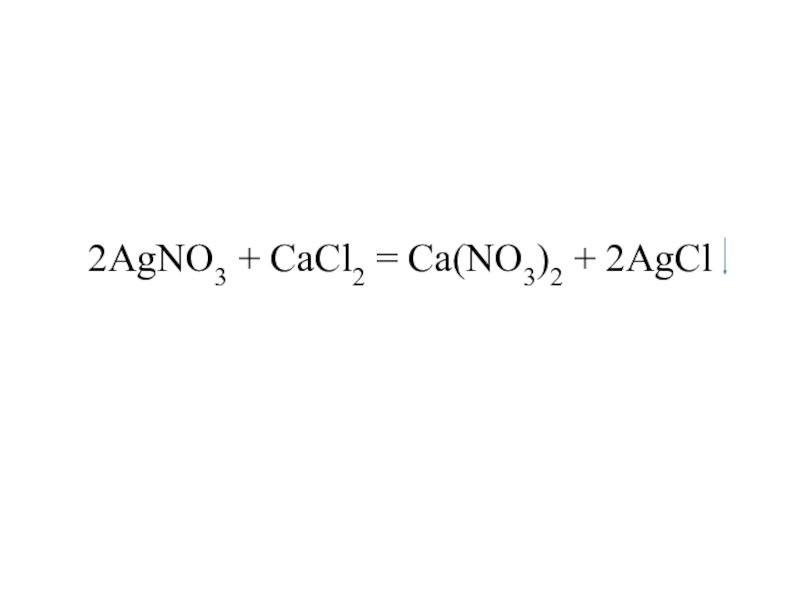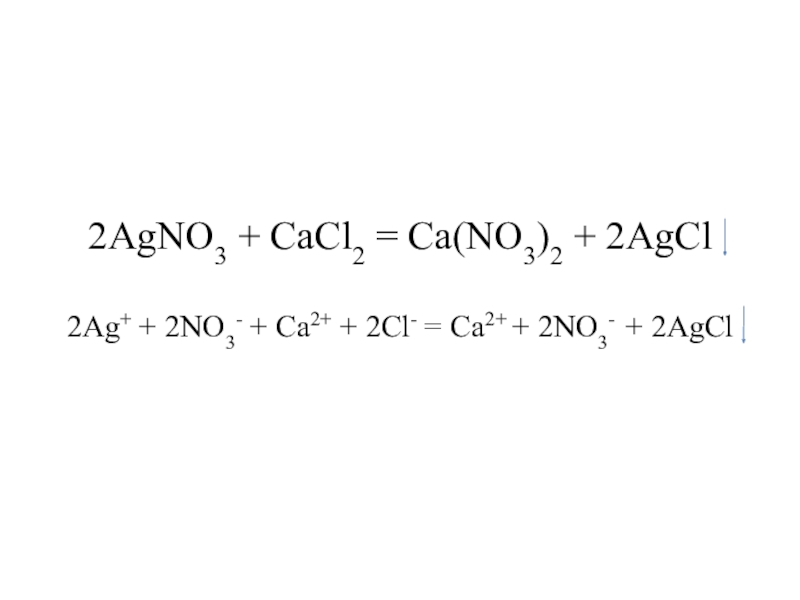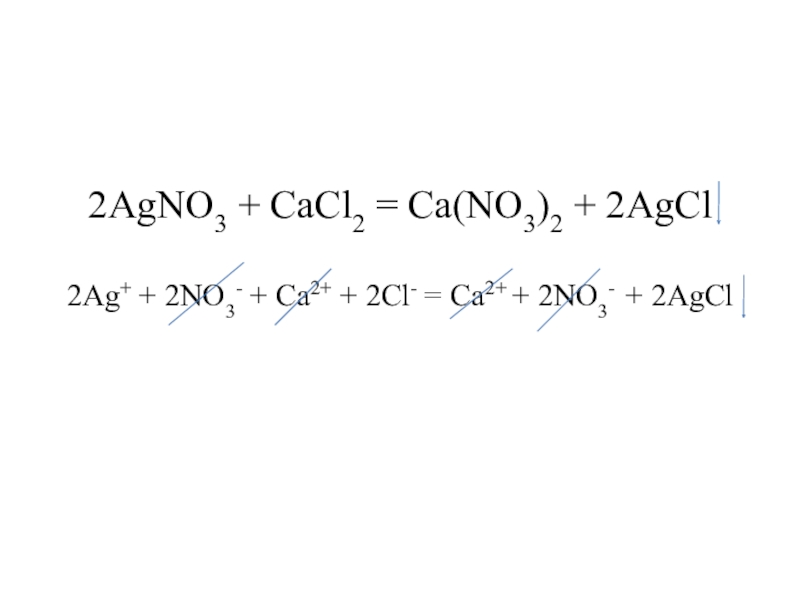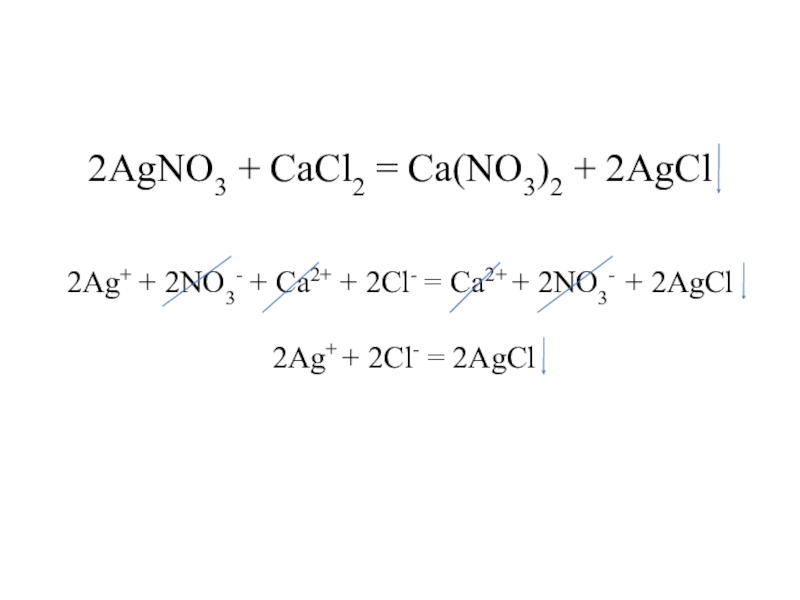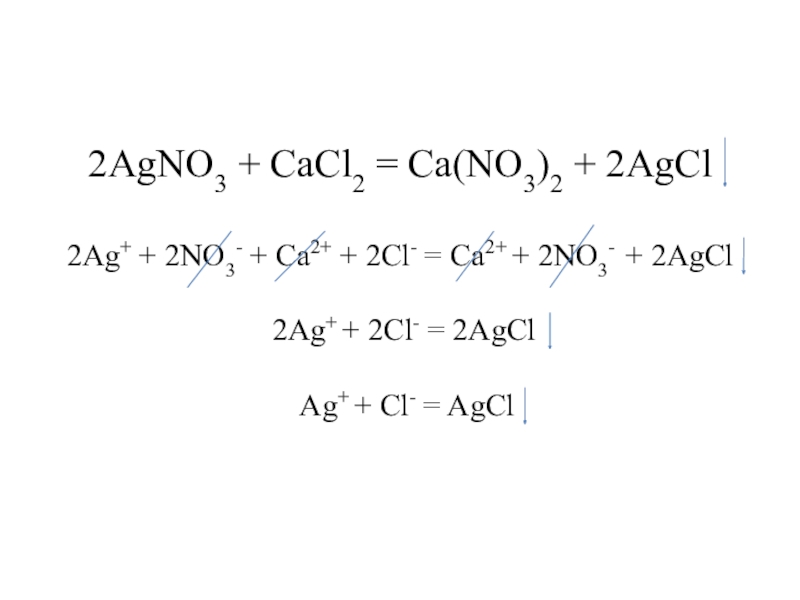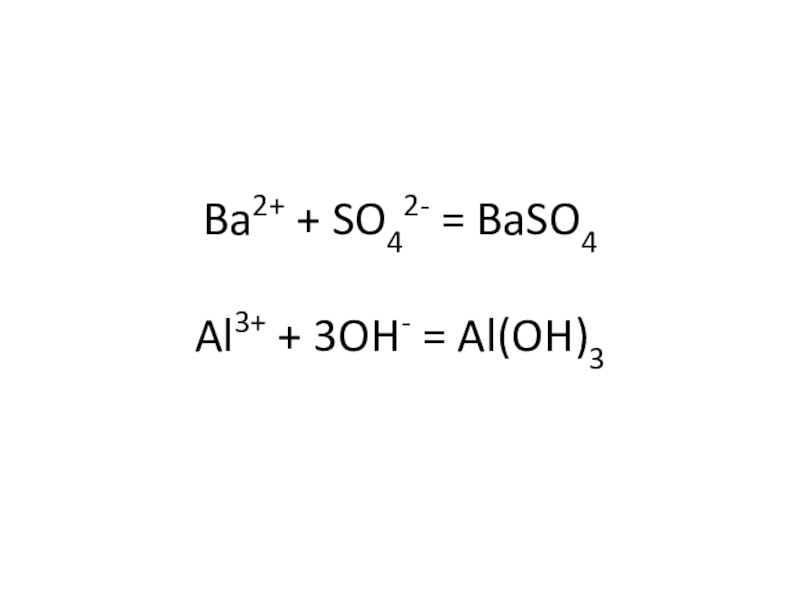, H2CO3 , AgNO3 , H2SiO3 , NaOH , Fe(OH)3 , HCl , AgCl
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Ионные уравнения (презентация к уроку)
Содержание
- 1. Ионные уравнения (презентация к уроку)
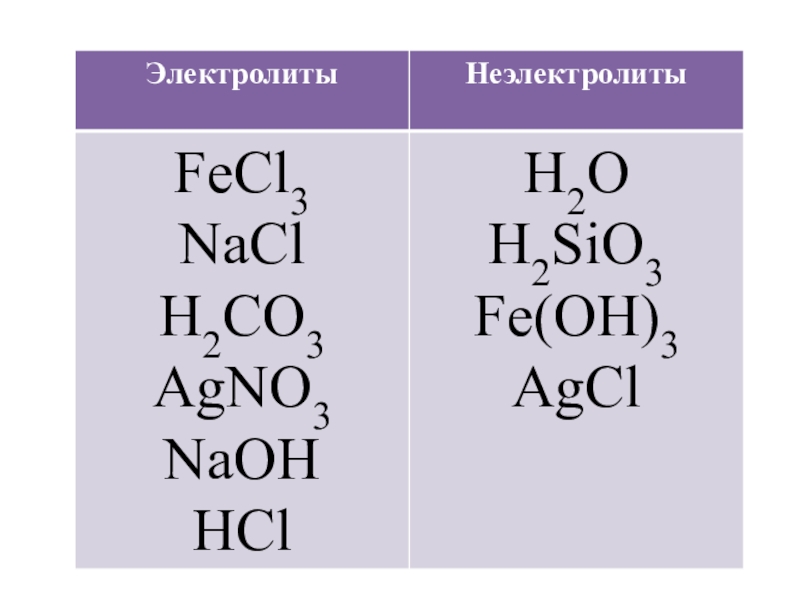
- 2. Разделите данные вещества на 2 группыFeCl3 ,
- 3. Слайд 3
- 4. Критерии оценки 10 правильных ответов –
- 5. Найдите среди предложенных реакций реакции обмена и
- 6. K2CO3 + H2SO4 → K2SO4 + H2CO3
- 7. Запишите уравнения электролитической диссоциации следующих веществH2SO4
- 8. H2SO4 ↔ 2H+ + SO42- NaOH
- 9. HNO3 ↔ H+ + NO3- KOH
- 10. H3PO4 ↔ 3H+ + PO43- Ca(OH)2
- 11. Ионные уравнения
- 12. Реакции, идущие с образованием нерастворимых веществВ пробирку
- 13. 2AgNO3 + CaCl2 = Ca(NO3)2 + 2AgCl
- 14. 2AgNO3 + CaCl2 = Ca(NO3)2 + 2AgCl
- 15. 2AgNO3 + CaCl2 = Ca(NO3)2 + 2AgCl
- 16. 2AgNO3 + CaCl2 = Ca(NO3)2 + 2AgCl
- 17. 2AgNO3 + CaCl2 = Ca(NO3)2 + 2AgCl
- 18. Ионное уравнение – это уравнение реакции между ионами.
- 19. Реакции с образованием газообразных веществВ пробирку с
- 20. K2CO3 + H2SO4 = K2SO4 + H2O + CO2
- 21. Реакции, идущие с образованием слабого электролитаВ пробирку
- 22. 2NaOH + H2SO4 = Na2SO4 + 2H2O
- 23. Реакцию взаимодействия сильной кислоты со щелочью называют реакцией нейтрализации.
- 24. Обратимое взаимодействие между ионамиВ пробирку с нитратом
- 25. Домашнее задание § 37 прочитать вопрос 4 карточки
- 26. Меткий стрелок Выпишите ионы, которые попадут в
- 27. Ba2+ + SO42- = BaSO4 Al3+ + 3OH- = Al(OH)3
- 28. Игра «Морской бой»
- 29. 1. Какие из перечисленных ниже веществ могут
- 30. 2. Газ выделяется в результате взаимодействия ионов
- 31. 3. Могут одновременно находится в растворе ионы
- 32. 4. Наибольшее число ионов образуется при диссоциации
- 33. 5. Не могут одновременно находиться в растворе
- 34. Слайд 34
- 35. В сточных водах животноводческих ферм отмечено повышенное
Разделите данные вещества на 2 группыFeCl3 , H2O , NaCl , H2CO3 , AgNO3 , H2SiO3 , NaOH , Fe(OH)3 , HCl , AgCl
Слайд 5Найдите среди предложенных реакций реакции обмена и продолжите их
K2CO3 + H2SO4
→
Mg + HCl →
Na2SO4 + Ba(NO3)2 →
NaOH + HCl →
MgO + SO3 →
Mg + HCl →
Na2SO4 + Ba(NO3)2 →
NaOH + HCl →
MgO + SO3 →
Слайд 6K2CO3 + H2SO4 → K2SO4 + H2CO3
H2O CO2
Na2SO4 + Ba(NO3)2 → 2NaNO3 + BaSO4
NaOH + HCl →NaOH + H2O
Слайд 7Запишите уравнения электролитической диссоциации следующих веществ
H2SO4
HNO3 H3PO4
NaOH KOH Ca(OH)2
NaCl Al(NO3)3 K3PO4
NaOH KOH Ca(OH)2
NaCl Al(NO3)3 K3PO4
Слайд 12Реакции, идущие с образованием нерастворимых веществ
В пробирку с раствором хлорида кальция
добавьте несколько капель нитрата серебра.
Что наблюдаете?
Запишите молекулярное уравнение химической реакции.
Что наблюдаете?
Запишите молекулярное уравнение химической реакции.
Слайд 162AgNO3 + CaCl2 = Ca(NO3)2 + 2AgCl 2Ag+ + 2NO3- + Ca2+
+ 2Cl- = Ca2+ + 2NO3- + 2AgCl
2Ag+ + 2Cl- = 2AgCl
Слайд 172AgNO3 + CaCl2 = Ca(NO3)2 + 2AgCl 2Ag+ + 2NO3- + Ca2+
+ 2Cl- = Ca2+ + 2NO3- + 2AgCl
2Ag+ + 2Cl- = 2AgCl
Ag+ + Cl- = AgCl
Слайд 19Реакции с образованием газообразных веществ
В пробирку с раствором карбоната калия добавьте
несколько капель серной кислоты.
Запишите молекулярное и ионное уравнения реакций.
Запишите молекулярное и ионное уравнения реакций.
Слайд 21Реакции, идущие с образованием слабого электролита
В пробирку прилейте 1 – 2
мл раствора гидроксида натрия, добавьте 2 – 3 капли фенолфталеина. Прилейте серной кислоты до полного обесцвечивания раствора.
Почему раствор обесцветился?
Запишите молекулярное и ионные уравнения.
Почему раствор обесцветился?
Запишите молекулярное и ионные уравнения.
Слайд 24Обратимое взаимодействие между ионами
В пробирку с нитратом калия прилейте 1 –
2 мл раствора хлорида натрия.
Что наблюдаете?
Составьте молекулярное и ионное уравнения реакции.
Что наблюдаете?
Составьте молекулярное и ионное уравнения реакции.
Слайд 291. Какие из перечисленных ниже веществ могут образоваться в ходе реакции
ионного обмена?
а) Na3PO4 б) CaCO3 в) Fe(OH)3 г) NaOH д) KOH
Слайд 302. Газ выделяется в результате взаимодействия ионов а) Ba2+ и CO32-
б) 2H+ и CO32-
в) H+ и OH-
г) CO32- и Ca2+
д) 2H+ и SiO32-
Слайд 313. Могут одновременно находится в растворе ионы а) Al3+ и PO43- б) Na+
и NO3-
в) K+ и OH-
г) H+ и Cl-
д) Ag+ и Cl-
Слайд 324. Наибольшее число ионов образуется при диссоциации электролита а) K2SO4 б) LiOH в) H3PO4 г)
Al2(SO4)3
д) Na3PO4
Слайд 335. Не могут одновременно находиться в растворе ионы а) Ba2+ и OH-
б) Pl2+ и Cl-
в) Hg2+ и PO43-
г) Mn2+ и OH-
д) Zn2+ и NO3-
Слайд 35В сточных водах животноводческих ферм отмечено повышенное содержание катионов Са2+ и
Zn2+ . Предложите реактивы, с помощью которых можно очистить воду от этих ионов.