- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Именные реакции в органической химии
Содержание
- 1. Именные реакции в органической химии
- 2. Каждый школьник, изучающий органическую химию в школьном
- 3. Основой создания теории химического строения органических соединений
- 4. Широкое изучение органических соединений началось в XVIII
- 5. 1. Атомы, образующие молекулу органического вещества, связаны
- 6. Изомеры – это вещества, обладающие одинаковым качественным
- 7. 3. На химические свойства органических соединений оказывают
- 8. Реакция Вюрца — действие металлического натрия на моногалогенопроизводные
- 9. Реакция Коновалова: при действии разбавленной азотной кислоты
- 10. Именные реакции алкенов:Присоединение по правилу Марковникова:π – связь в
- 11. правило Зайцева — при нагривании спиртов в присутствии
- 12. Реакция Лебедева – первый представитель гомологического ряда
- 13. Именные реакции алкинов:реакция Кучерова (гидратация) – важное значение
- 14. реакция Зелинского – впервые подобную реакцию в
- 15. Арены В 1865 году выдающийся немецкий химик
- 16. реакция Зинина — открыта в 1842 году, реакция,
- 17. Реакция Фриделя-Крафтца — самым известным примером реакции
- 18. И это далеко не полный перечень выдающихся
Слайд 1Именные реакции
Подготовила Сохибова К.И.,
учитель химии
МБОУ «Теплоключевская СОШ» Томпонского района
Слайд 2Каждый школьник, изучающий органическую химию в школьном курсе, знает и правило
А вот то, что таких реакций несколько сотен, что знакомая многим реакция «серебряного зеркала» – это именная реакция, известно немногим.
Проведя изучение доступных мне источников, я предлагаю Вам ребята своеобразный банк именных реакций, с которыми Вы может встретиться как в школьном курсе массовой школы, так и при подготовке к олимпиаде.
Для реакций, даны словесные характеристики и их уравнения.
Отметим при этом, что не все химические превращения получили фамилии своих первооткрывателей. Таким образом, на самом деле именных реакций значительно больше, чем нам это обычно кажется.
Предисловие
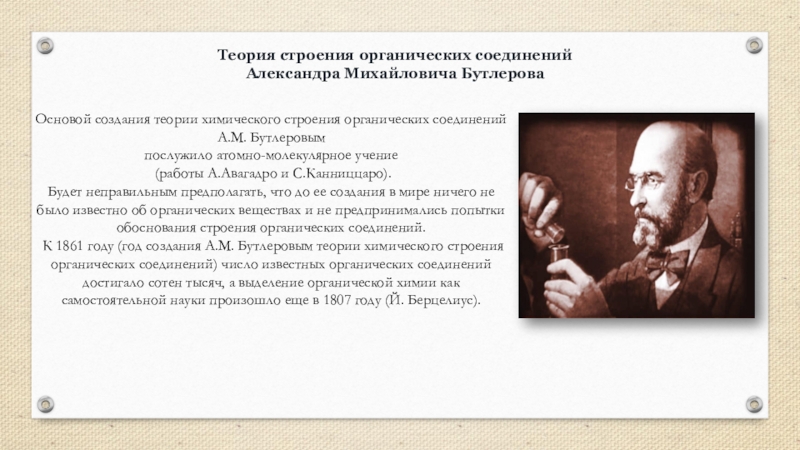
Слайд 3Основой создания теории химического строения органических соединений А.М. Бутлеровым
послужило атомно-молекулярное
(работы А.Авагадро и С.Канниццаро).
Будет неправильным предполагать, что до ее создания в мире ничего не было известно об органических веществах и не предпринимались попытки обоснования строения органических соединений.
К 1861 году (год создания А.М. Бутлеровым теории химического строения органических соединений) число известных органических соединений достигало сотен тысяч, а выделение органической химии как самостоятельной науки произошло еще в 1807 году (Й. Берцелиус).
Теория строения органических соединений
Александра Михайловича Бутлерова
Слайд 4Широкое изучение органических соединений началось в XVIII веке с работ А.Лавуазье,
Термин «химическое строение», а также основы классической теории химического строения были впервые обнародованы А.М. Бутлеровым 19 сентября 1861 года в его докладе на Съезде немецких естествоиспытателей и врачей в Шпейере.
Предпосылки теории строения органических соединений
Слайд 51. Атомы, образующие молекулу органического вещества, связаны между собой в определенном
Последовательность соединения атомов Бутлеров назвал «химическим строением».
Графически связи между атомами обозначаются чертой или точкой
Основные положения теории строения органических соединений А.М. Бутлерова
2. Свойства органических соединений зависят от химического строения молекул, т.е. свойства органических соединений зависят от порядка соединения атомов в молекуле. Изучив свойства, можно изобразить вещество.
Пример: вещество имеют брутто-формулу C2H6O. Известно, что при взаимодействии этого вещества с натрием выделяется водород, а при действии на него кислоты образуется вода.
C2H6O + Na = C2H5ONa + H2 ↑
C2H6O + HCl = C2H5Cl + H2O
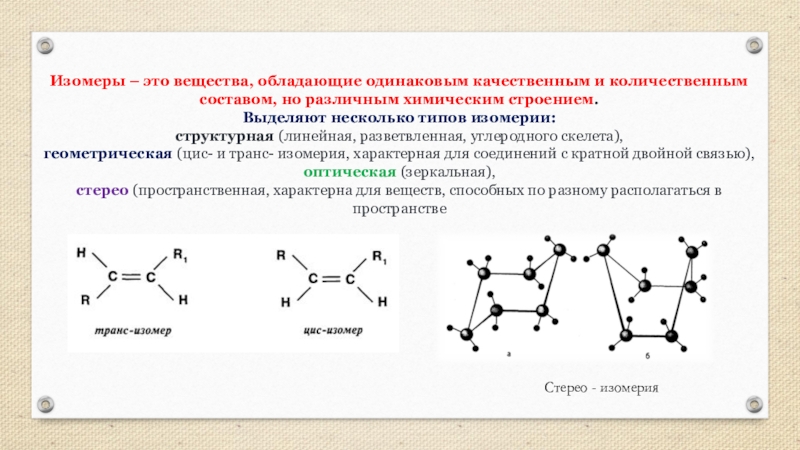
Слайд 6Изомеры – это вещества, обладающие одинаковым качественным и количественным составом, но
Выделяют несколько типов изомерии:
структурная (линейная, разветвленная, углеродного скелета),
геометрическая (цис- и транс- изомерия, характерная для соединений с кратной двойной связью),
оптическая (зеркальная),
стерео (пространственная, характерна для веществ, способных по разному располагаться в пространстве
Стерео - изомерия
Слайд 73. На химические свойства органических соединений оказывают влияние и другие атомы,
Такие группы атомов получили название функциональных групп, за счет того, что их наличие в молекуле вещества придает ему особые химические свойства.
Например: -OH (гидроксо-группа), -SH (тио-группа), -CO (карбонильная группа),
-COOH (карбоксильная группа).
Причем химические свойства органического вещества в меньшей степени зависят от углеводородного скелета, чем от функциональной группы.
Именно функциональные группы обеспечивают многообразие органических соединений, засчет чего их классифицируют (спирты, альдегиды, карбоновые кислоты и т.д.).
К числу функциональных групп иногда относят и
углерод-углеродные связи (кратные двойные и тройные).
Если в молекуле органического вещества несколько одинаковых функциональных групп,
то его называют гомополифунцкиональным (CH2 (OH)-CH(OH)-CH2(OH) – глицерин),
если несколько, но разных – гетерополифункциональным (NH2-CH(R)-COOH – аминокислоты).
4. Валентность углерода в органических соединениях всегда равна четырем.
Слайд 8Реакция Вюрца — действие металлического натрия на моногалогенопроизводные углеводородов. Происходит удвоение углеродного
Реакция подходит для получения симметричных алканов.
Именные реакции алканов:
ШАРЛЬ АДОЛЬФ ВЮРЦ (1817–1884),
французский химик-органик и педагог.
Родился 26 ноября 1817 в Страсбурге.
2CH3–CH2 -Br
+ 2Na = CH3–CH2–CH2–CH3 + 2NaBr
2CH3–CH2 -Br
В качестве галогеналканов берут I, Br, или Cl-производные.
Практическое значение этот способ имеет только для получения симметричных алканов с четным числом атомов.
При использовании в качестве исходных веществ 2х различных галогеналканов образуется смесь 3х предельных углеводродов:
CH3–CH2 Br + Na + Br – CH3 = C4H10 + C3H8 + C2 H6 + 2NaBr
бромэтан
бромметан
пропан
н-бутан
этан
t
н-бутан
бромэтан
Слайд 9 Реакция Коновалова: при действии разбавленной азотной кислоты на алканы при t
нитропропан
H
|
CH3 - C - CH3 + HО - NO2 = CH3 - CH - CH3 + Н2O
| |
H NO2
пропан
При нитровании алканов также соблюдается порядок реакционной способности С-Н-связей, характерный для реакций радикального замещения:
Стрет.– Н > Свтор.– Н > Cперв.– Н
Михаил Иванович КОНОВАЛОВ
13 ноября 1858 г. – 25 декабря 1906 г.
химик-органик
Сформулировал в 1888 году
Слайд 10Именные реакции алкенов:
Присоединение по правилу Марковникова:
π – связь в молекулах алкенов очень чувствительна
СH2=CH-CH3 + HCl = CH3 - CH - CH3
│
Cl
R → CH ═ CH2
δ+
δ-
Этим объясняется правило, сформулированное выдающимся русским химиком В.В. Морковниковым.
При присоединении полярных молекул типа НХ (Hgl, OH, CN)
к алкенам водород преимущественно присоединяется к наиболее
гидрогенизированному атому водорода по двойной связи
Владимир Васильевич Марковников,
25 .12.1837 г -11.02.1904 г.
выдающийся русский химик-органик
сформулировано в 1869 году
пропен
2 хлорпропан
Слайд 11правило Зайцева — при нагривании спиртов в присутствии H2SO4(конц) до t═180°С происходит
Если существует возможность отщепления молекулы воды несколькими различными способами, строение образующегося алкена определяется правилом Зайцева.
При дегидратации спиртов атом водорода отщепляется от наименее
гидрогенизированного (с меньшим числом атомов водорода)
атом углерода, т.е. образуется алкен
с наибольшим числом алкильных заместителей при «═» связи.
CH3 ─CH ─CH2 ─CH3 CH3 ─ CH ═ CH ─ CH3
│
OH
не CH2 ═ CH─ CH2 ─ CH3
Правило предложено русским химиком А. М. Зайцевым в 1875 году.
Александр Михайлович Зайцев
2.07.1841 г. – 01.09.1910 г.
Русский химик-органик
н2so4
- H2O
Слайд 12Реакция Лебедева – первый представитель гомологического ряда алкадиенов с сопряженными
двойными связями
в 1932 году выдающимся советским химиком С.В. Лебедевым.
Этот способ заключается в дегидратации этилового спирта с одновременным дегидрированием.
Получение бутадиена пиролизом этанола
Лебедев Сергей Васильевич
(1874—1934),
химик, исследователь полимеризационных процессов.
2C2H5OH CH2 = CH – CH = CH2
Al2O3, ZnO, 425°C
-H2, -2H2O
В синтезе при расщеплении (разложении) 2 молекул этилового спирта, благодаря дегидратирующе-дегидрирующим катализаторам, от них отрываются 2 молекулы воды и 1 молекула газообразного водорода.
Согласно механизму реакции Лебедева,
алкильные остатки присоединяются друг другу,
образуя две непредельные сопряженные двойные связи в 1,3–положениях.
Этиловый
спирт
бутадиен 1,3
(дивинил)
Слайд 13Именные реакции алкинов:
реакция Кучерова (гидратация) – важное значение для получения кислородсодержащих органических
O
CH ≡ CH + H2O → [CH2 ═ CH - OH]→ CH3 ─ C
H
Вода присоединяется по « ≡ » связи алкина с образованием на первой стадии непредельного спирта – енола. Енолы крайне неустойчивы. В данном случае образующийся виниловый спирт изомеризуется в более стабильное соединение – уксусный альдегид. При этом атом водорода ОН группы переходит к дальнейшему sp- гибридному атому С, «═» связь перемещается к атому О.
Hg2+, H+
Михаил Григорьевич
КУЧЕРОВ
3 июня 1850 г. – 26 июня 1911 г.
русский химик-органик.
Альдегиды получаются только при гидратации ацетилена. Другие ацетиленовые у/в в подобных условиях образуют кетоны, поскольку присоединение воды идет по правилу Марковникова:
CH ≡ C─СH3 + H2O → [CH2 ═ C – СH3] → CH3 ─ C ─ CH3
│ ║
ОН О
Hg2+, H+
Соли ртути (II) в качестве катализатора процесса гидратации алкинов были
впервые использованы выдающимся химиком М.Г. Кучеровым в 1881 году.
Слайд 14реакция Зелинского – впервые подобную реакцию в 1886 году осуществил Марселен
При нагревании ацетилена до 600°С ему удалось получить небольшое количество бензола.
Русский химик Николай Дмитриевич Зелинский обнаружил, что катализатором данной реакции является
Сактив. Даже при более низкой температуре скорость реакции значительно возрастало,
Выход бензола увеличился до 90%. С тех пор эта реакции носит имя Н.Д. Зелинского.
Николай Дмитриевич
Зелинский
6 февраля 1861г. – 31 июля 1953 г.
Русский и советский химик - органик
Слайд 15 Арены
В 1865 году выдающийся немецкий химик Август Кекуле после долгих
Это открытие было исключительно важным: в первом приближении раскрылось строение молекулы бензола, а вместе с ним и всех его производных, играющих чрезвычайно существенную роль в органико-химическом производстве. Этот класс органических веществ (ароматических) долгое время упорно не поддавался теории химического строения. И только благодаря открытию Кекуле этот научный бастион был взят.
Фридрих Август КЕКУЛЕ (Kekule),
7 сентября 1829 г. – 13 июля 1896 г
немецкий химик
Слайд 16реакция Зинина — открыта в 1842 году, реакция, которая вошла в историю
Принципы реакции Зинина лежат в основе синтеза разнообразных ароматических аминов, многие из которых служат исходными продуктами в производстве синтетических красителей, фармацевтических препаратов, взрывчатых, душистых, лекарственных и др. веществ. Широкое применение Зинина реакции в значительной степени определило пути развития органического синтеза.
Впоследствии для восстановления ароматических нитросоединений стали применять чугунные стружки в кислой среде. Однако сернистый аммоний, использовавшийся Зининым, как восстановитель, сохранил некоторое значение для получения аминов ряда антрахинона и, главным образом, для частичного восстановления ди- и полинитросоединений.
R-NO2+ 6H = R-NH2+2H2O.
C6H5NO2 + 3(NH4)2S ═> C6H5NH2 + 6NH3 + 3S + 2H2O
Николай Николаевич Зинин
25.08.1812—18.02.1880
российский химик-органик
Слайд 17Реакция Фриделя-Крафтца — самым известным примером реакции
Фриделя‒Крафтса является взаимодействие хлористого
в присутствии хлористого алюминия (AlCl3), где на выходе получают толуол (C7H9).
Эту реакцию получили в 1877 г. двое ученых - Чарльз Фридель и Джеймс Крафтс.
Она впоследствии стала одной из важных составляющих для промышленного производства алкиларенов.
Шарль ФРИДЕЛЬ
12.03. 1832 г. – 20.04.1899 г.
французский химик-органик
и минералог
Джеймс Мейсон
Крафтс
8.03.1839— 20.06.1917
американский химик
Слайд 18И это далеко не полный перечень выдающихся умов России, активно способствовавших
Спасибо за внимание