- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Идем на урок химии: Сероводород (2017 год)
Содержание
- 1. Идем на урок химии: Сероводород (2017 год)
- 2. ПОНЯТИЕСероводоро́д (серни́стый водоро́д, сульфи́д водоро́да) — бесцветный газ
- 3. ФИЗИЧЕСКИЕ СВОЙСТВАH2S Молекулярная масса (в а.е.м.): 34,08
- 4. ХИМИЧЕСКИЕ СВОЙСТВАСобственная ионизация жидкого сероводорода ничтожно мала.В
- 5. Получение Взаимодействие разбавленных кислот на сульфиды Взаимодействие
- 6. Применение Сероводород из-за своей токсичности находит ограниченное
- 7. ТоксикологияОчень токсичен. Вдыхание воздуха с содержанием сероводорода
- 8. ВЛИЯНИЕ НА ОРГАНИЗМВ результате прямого раздражающего действия
- 9. ПОЯВЛЕНИЕ В АТМОСФЕРЕ НА ПРИМЕРЕ РОССИЙСКИХ ГОРОДОВВ
- 10. ОТКРЫТИЕПристли (Joseph Priestley) - знаменитый английский химик,
- 11. Пристли по праву его можно считать одним
- 12. ЛАВУАЗЬЕ
- 13. Так же открыл сероводород, изучая газ, который выделяется из чанов во время брожения пива
- 14. http://images.yandex.ru/yandsearch?ed=1&rpt=simage&text=%D1%81%D0%B5%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4&img_url=0.tqn.com%2Fd%2Fchemistry%2F1%2F7%2F_%2Fa%2Fhydrogensulfide.jpg&p=2http://ru.wikipedia.org/wiki/%D0%A1%D0%B5%D1%80%D0%BE%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%D0%BE%D0%B4http://www.chemport.ru/chemical_substance_806.htmlhttp://revolution.allbest.ru/ecology/00162565_1.htmlhttp://ru.wikipedia.org/wiki/%D0%94%D0%B6%D0%BE%D0%B7%D0%B5%D1%84_%D0%9F%D1%80%D0%B8%D1%81%D1%82%D0%BB%D0%B8http://images.yandex.ru/yandsearch?ed=1&rpt=simage&img_url=0.tqn.com%2Fd%2Fchemistry%2F1%2F0%2Fo%2Fc%2Fnitrousoxide.jpg&text=%D0%BE%D0%BA%D0%B8%D1%81%D1%8C%20%D0%B0%D0%B7%D0%BE%D1%82%D0%B0&p=1http://images.yandex.ru/yandsearch?text=%D0%90%D0%BD%D1%82%D1%83%D0%B0%D0%BD+%D0%9B%D0%B0%D0%B2%D1%83%D0%B0%D0%B7%D1%8C%D0%B5&stype=imagehttp://images.yandex.ru/yandsearch?text=%D0%9A%D0%B0%D1%80%D0%BB+%D0%A8%D0%B5%D0%B5%D0%BB%D0%B5&stype=imagehttp://day.sibnet.ru/upload/attach-47375.jpghttp://images.yandex.ru/yandsearch?ed=1&rpt=simage&img_url=dro.hs.columbia.edu%2Fced2%2Fvernalb.jpg&text=%D0%BA%D0%B5%D1%80%D0%B0%D1%82%D0%BE%D0%BA%D0%BE%D0%BD%D1%8A%D1%8E%D0%BD%D0%BA%D1%82%D0%B8%D0%B2%D0%B8%D1%82&p=3http://images.yandex.ru/yandsearch?ed=1&rpt=simage&img_url=medpractik.ru%2Fwp-content%2Fuploads%2F2010%2F04%2Fostraja-serdechnaja-nedostatochnost-otek-legkih1.jpg&text=%D0%BE%D1%82%D0%B5%D0%BA%20%D0%BB%D0%B5%D0%B3%D0%BA%D0%B8%D1%85&p=26
Слайд 2ПОНЯТИЕ
Сероводоро́д (серни́стый водоро́д, сульфи́д водоро́да) — бесцветный газ с запахом тухлых яиц
В природе встречается очень редко в виде смешанных веществ нефти и газа. Входит в состав вулканического пепла. Сероводород используют в лечебных целях, например, в сероводородных ваннах
Слайд 3ФИЗИЧЕСКИЕ СВОЙСТВА
H2S Молекулярная масса (в а.е.м.): 34,08 Температура плавления (в °C):
Слайд 4ХИМИЧЕСКИЕ СВОЙСТВА
Собственная ионизация жидкого сероводорода ничтожно мала.
В воде сероводород мало растворим,
H2S → HS− + H+ Ka = 6.9×10−7 моль/л; pKa = 6.89.
Реагирует с основаниями:
H2S + 2NaOH = Na2S + 2H2O (обычная соль, при избытке NaOH)
H2S + NaOH = NaHS + H2O (кислая соль, при отношении 1:1)
Сероводород — сильный восстановитель. На воздухе горит синим пламенем:
2H2S + ЗО2 = 2Н2О + 2SO2
при недостатке кислорода:
2H2S + O2 = 2S + 2H2O (на этой реакции основан промышленный способ получения серы).
Сероводород реагирует также со многими другими окислителями, при его окислении в растворах образуется свободная сера или SO42−, например:
3H2S + 4HClO3 = 3H2SO4 + 4HCl
2H2S + SO2 = 2Н2О + 3S
H2S + I2 = 2HI + S
Слайд 5Получение
Взаимодействие разбавленных кислот на сульфиды
Взаимодействие сульфида алюминия с водой (эта
Слайд 6Применение
Сероводород из-за своей токсичности находит ограниченное применение.
В аналитической химии сероводород и
В медицине — в составе природных и искусственных сероводородных ванн, а также в составе некоторых минеральных вод.
Сероводород применяют для получения серной кислоты, элементной серы, сульфидов.
Используют в органическом синтезе для получения тиофена и меркаптанов.
В последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моря, в качестве энергетического (сероводородная энергетика) и химического сырья.
Слайд 7Токсикология
Очень токсичен. Вдыхание воздуха с содержанием сероводорода вызывает головокружение, головную боль,
При большой концентрации ввиду паралича обонятельного нерва запах сероводорода не ощущается.
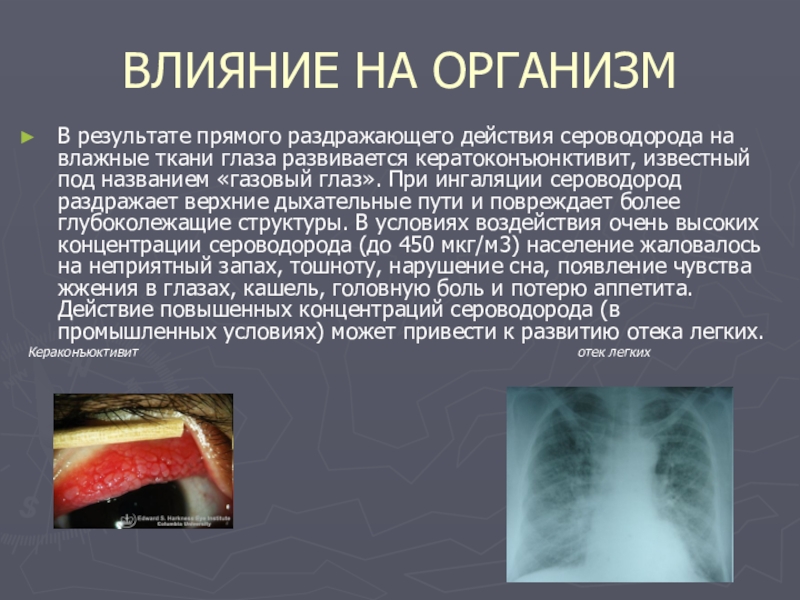
Слайд 8ВЛИЯНИЕ НА ОРГАНИЗМ
В результате прямого раздражающего действия сероводорода на влажные ткани
Кераконъюктивит отек легких
Слайд 9ПОЯВЛЕНИЕ В АТМОСФЕРЕ
НА ПРИМЕРЕ РОССИЙСКИХ ГОРОДОВ
В воздушный бассейн городов России сероводород
Слайд 10ОТКРЫТИЕ
Пристли (Joseph Priestley) - знаменитый английский химик, философ и богослов (1733
Слайд 11
Пристли по праву его можно считать одним из основоположников современной химии.
В 1772 г. Пристли, действуя разбавленной азотной кислотой на медь, впервые получил окись азота — «селитряный воздух» — и нашёл, что окись азота при соприкосновении с воздухом буреет вследствие образования двуокиси азота. Пользуясь для собирания газов ртутной ванной, Пристли в 1772—74 гг. впервые получил хлороводород — «соляно-кислый воздух» и аммиак — «щелочной воздух». ОКИСЬ АЗОТА(I)
Слайд 12ЛАВУАЗЬЕ
Кавендиш
Вместе с другими учеными, такими, как Антуан Лавуазье, Генри Кавендиш, Карл Шееле, он способствовал утверждению представлений о сложном составе воздуха. Пристли принадлежит честь открытия в 1774 году кислорода. Нагревая окись ртути, он выделил кислород — «бесфлогистонный воздух». Кроме того, Пристли в 1775 г. получил в чистом виде фтористый кремний, сернистый газ, а в 1799 г. окись углерода. Обогатив науку многими новыми фактами, Пристли, однако, не смог правильно объяснить их и до конца жизни оставался последователем ошибочной теории флогистона, отвергнутой трудами Лавуазье, поэтому его теоретические идеи не шли ни в какое сравнение с описанными им остроумными и убедительными экспериментами. Кроме химии, его исследования относятся также и к оптике. Пристли — автор книги «История и современное состояние открытий, относящихся к зрению, свету и цветам», опубликованной в 1772 г.
Работы Пристли получили широкую известность в научных кругах. Он был избран почетным доктором Эдинбургского университета, членом Лондонского королевского общества, иностранным членом Парижской и Петербургской академий наук