- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Гидролиз органических и неорганических соединений (11 класс, базовый уровень)
Содержание
- 1. Гидролиз органических и неорганических соединений (11 класс, базовый уровень)
- 2. Общие понятияГидролиз (от греч. hydro – «вода»
- 3. ☼☼Гидролиз органических веществиспользуют дляустановления строения сложных веществиспользуют
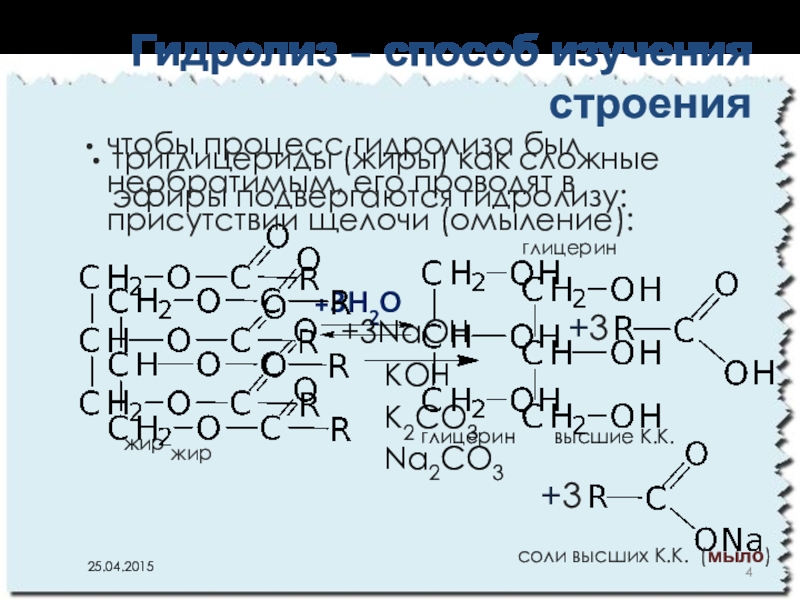
- 4. триглицериды (жиры) как сложные эфиры подвергаются гидролизу:
- 5. Гидролиз – способ изучения строения гидролиз белков
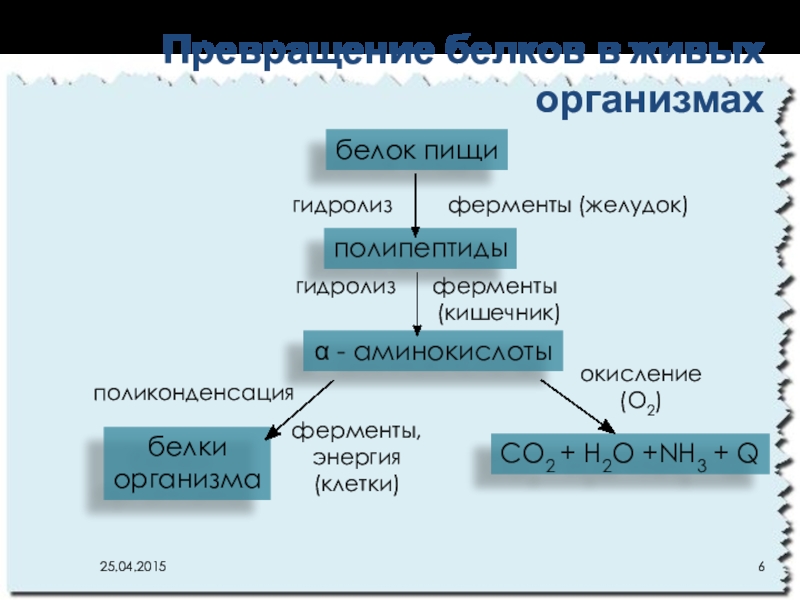
- 6. Превращение белков в живых организмахбелок пищиполипептидыα -
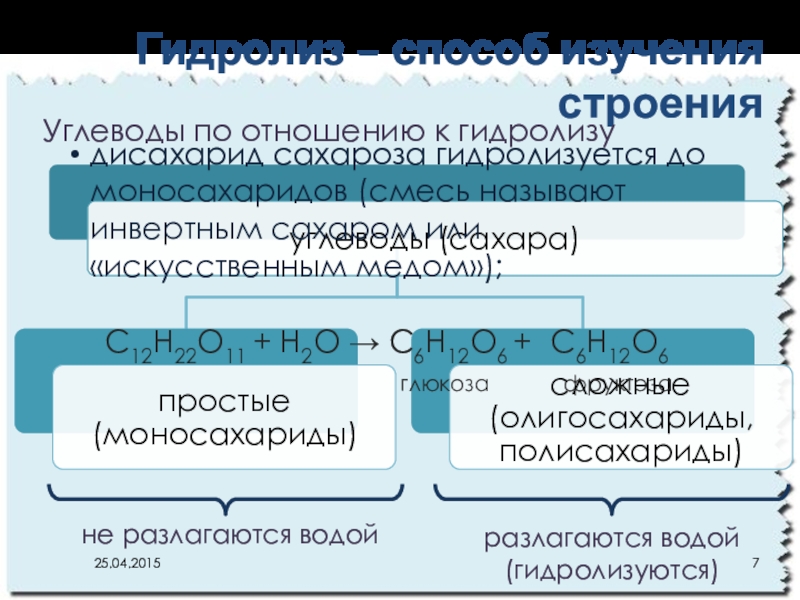
- 7. Гидролиз – способ изучения строения С12Н22О11 +
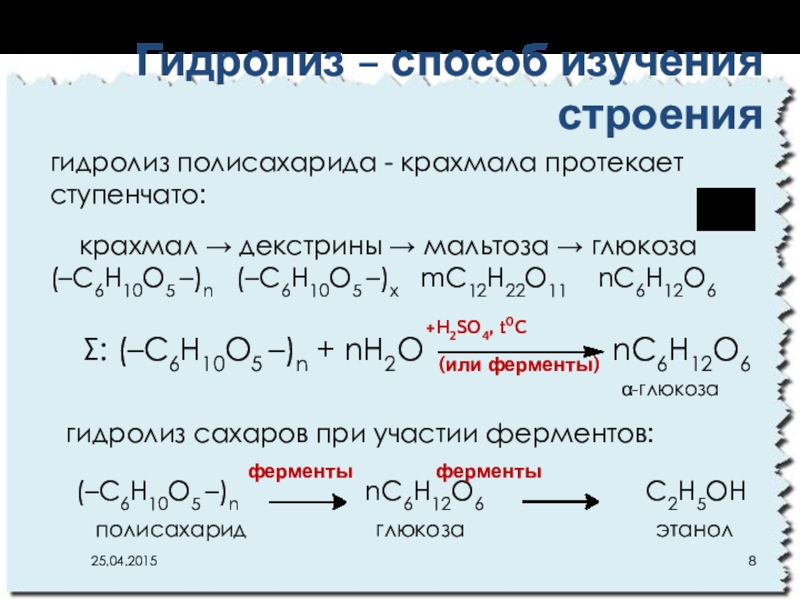
- 8. : (–C6H10O5 –)n + nH2O
- 9. (–C6H10O5 –)n + nH2O
- 10. Превращение углеводов живых организмахкрахмал пищи(–C6H10O5 –)nмальтозаmC12H22O11глюкозаnC6H12O6CO2 +
- 11. АТФ + Н2О
- 12. Гидролиз бинарных соединенийгидролиз карбидов (лабораторный способ)
- 13. объясняет прочерки в таблице растворимости:используется для получения
- 14. Гидролиз солейсильные и слабые электролиты (определение, представители
- 15. Какая среда в водных р-рах кислот?Какая среда
- 16. Исследуйте индикаторами растворы данных солей
- 17. т.е, образуются при взаимодействии кислоты и основания:Соли
- 18. только растворимые в воде соли, образованные разными
- 19. Реакции, происходящие в растворах солейрассмотрим 4 типа
- 20. Соль, образованная сильным основанием и слабой кислотойNa2CO3
- 21. Соль, образованная слабым основанием и сильной кислотойFeSO4
- 22. Соль, образованная сильным основанием и сильной кислотойBaCl2
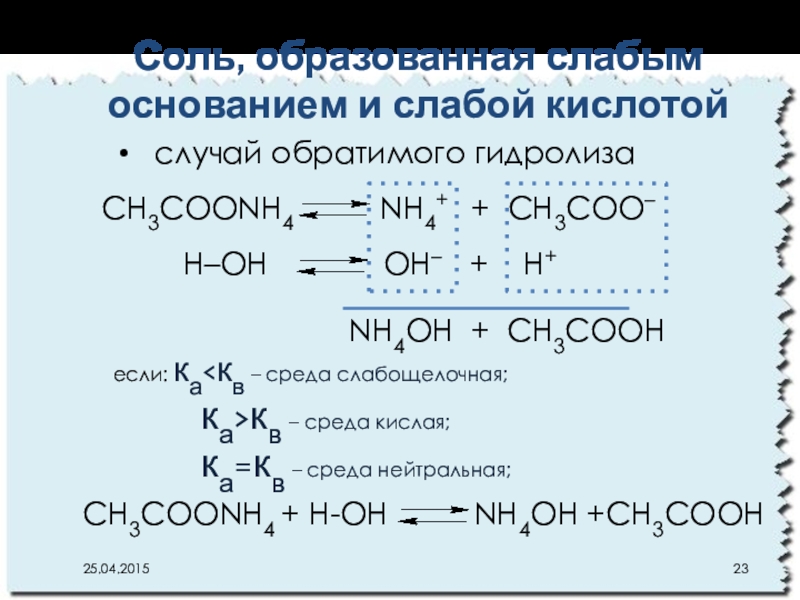
- 23. CН3СOОNH4 NН4+
- 24. Упражнения:1. Кислую среду имеет водный раствор2. Щелочную
- 25. в древности в качестве моющего средства использовали
- 26. NН4+ + H2O
- 27. в составе крови содержатся NaНCO3, Na2НРO4; их
- 28. Домашнее задание§ 18Упр.1-11ТПО стр. 114-122
Слайд 1Гидролиз органических и неорганических соединений
11 класс
базовый уровень
Трухина О.Е.
http://Учительский.сайт/Трухина-Ольга-Евгеньевна
Слайд 2Общие понятия
Гидролиз (от греч. hydro – «вода» и lisis – «разложение»,
гидролизу подвергаются как органические так и неорганические соединения.
гидролиз может обратимым и необратимым.
Слайд 3☼
☼
Гидролиз органических веществ
используют для
установления строения сложных веществ
используют для
получения веществ
среди органических соединений
Слайд 4триглицериды (жиры) как сложные эфиры подвергаются гидролизу:
Гидролиз – способ изучения
глицерин высшие К.К.
жир
+3
+3H2O
чтобы процесс гидролиза был необратимым, его проводят в присутствии щелочи (омыление):
глицерин
жир
+3NaOH
КОН
К2СО3
Na2CO3
+3
cоли высших К.К. (мыло)
Слайд 5Гидролиз – способ изучения строения
гидролиз белков под действием растворов кислот
при этом образуется смесь α–А.К., что позволяет сделать заключение о составе белков;
идет с участием ферментов;
расщепляются строго определенные хим. связи;
позволяет установить строение белка
+nH2O, H+
n
полипептид
смесь α–А.К.
Слайд 6Превращение белков в живых организмах
белок пищи
полипептиды
α - аминокислоты
CO2 + H2O +NH3
белки
организма
гидролиз ферменты (желудок)
гидролиз ферменты
(кишечник)
окисление (О2)
ферменты,
энергия
(клетки)
поликонденсация
Слайд 7Гидролиз – способ изучения строения
С12Н22О11 + Н2О → С6Н12О6 +
глюкоза фруктоза
не разлагаются водой
разлагаются водой
(гидролизуются)
Углеводы по отношению к гидролизу
дисахарид сахароза гидролизуется до моносахаридов (смесь называют инвертным сахаром или «искусственным медом»);
Слайд 8: (–C6H10O5 –)n + nH2O
гидролиз полисахарида - крахмала протекает ступенчато:
крахмал декстрины мальтоза глюкоза
(–C6H10O5 –)n (–C6H10O5 –)х mC12H22O11 nC6H12O6
+H2SO4, t0C
(или ферменты)
α-глюкоза
Гидролиз – способ изучения строения
гидролиз сахаров при участии ферментов:
(–C6H10O5 –)n nC6H12O6 C2H5OН
ферменты ферменты
полисахарид глюкоза этанол
Слайд 9(–C6H10O5 –)n + nH2O
целлюлоза, в отличие от крахмала не подвергается ферментативному гидролизу
гидролиз целлюлозы протекает при длительном кипячении в присутствии H2SO4
+H2SO4, t0C
β-глюкоза
Гидролиз – способ изучения строения
кислотный гидролиз называется осахариванием:
отходы древесины глюкоза этанол
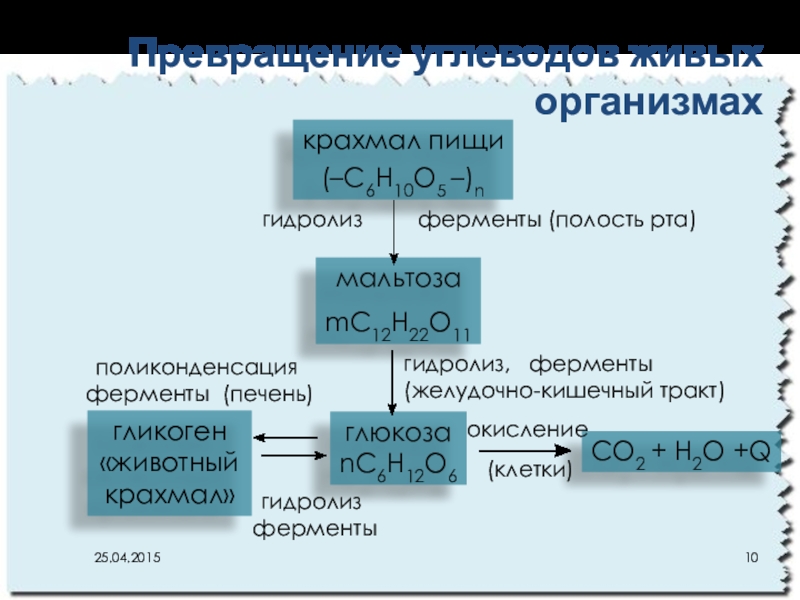
Слайд 10Превращение углеводов живых организмах
крахмал пищи
(–C6H10O5 –)n
мальтоза
mC12H22O11
глюкоза
nC6H12O6
CO2 + H2O +Q
гликоген
«животный
крахмал»
гидролиз
гидролиз, ферменты
(желудочно-кишечный тракт)
окисление
(клетки)
гидролиз
ферменты
поликонденсация
ферменты (печень)
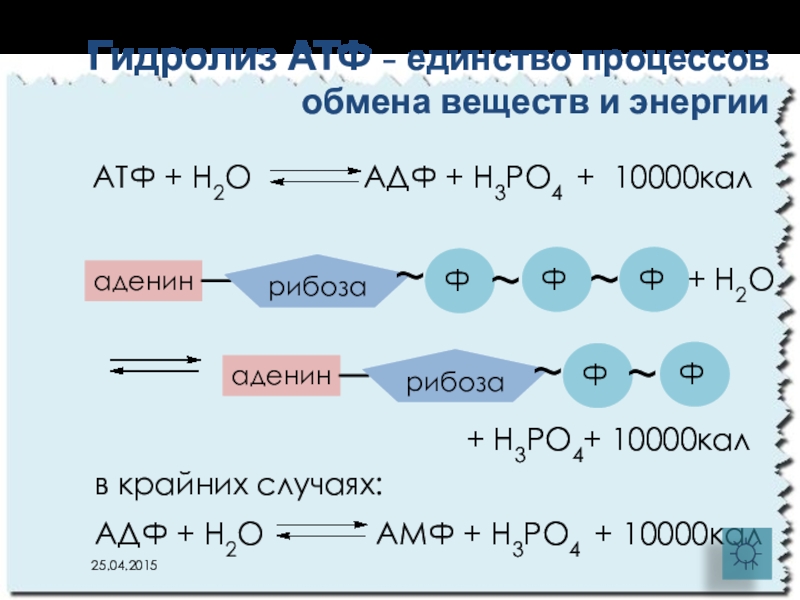
Слайд 11АТФ + Н2О АДФ +
Гидролиз АТФ - единство процессов обмена веществ и энергии
+ Н3РО4+ 10000кал
аденин
рибоза
Ф
~
~
Ф
~
Ф
+ Н2О
аденин
рибоза
Ф
~
~
Ф
в крайних случаях:
АДФ + Н2О АМФ + Н3РО4 + 10000кал
☼
Слайд 12Гидролиз бинарных соединений
гидролиз карбидов (лабораторный способ)
C
Ca III
CaC2 + 2HOH → HC≡СН↑ + Ca(ОH)2↓
CaC2 + 2HCl → HC≡СН↑ + CaCl2
Al4C3 + 12HOH → 3СН4↑ + 4Al(ОH)3↓
Al4C3 + 12HCl → 3СН4↑ + 4AlCl3
Слайд 13объясняет прочерки в таблице растворимости:
используется для получения водорода в полевых условиях:
применяется
Гидролиз бинарных соединений
Al2S3 + 6HOH → 3H2S↑ + 2Al(ОH)3↓
CaH2 + 2HOH → Н2↑ + Ca(ОH)2↓
Zn3P2 + 6HOH → 2PН3↑ + 3Zn(OH)2↓
Слайд 14Гидролиз солей
сильные и слабые электролиты (определение, представители классов неорганических соединений);
соли (определение
Na2SO4
NaH2PO4
(MgOH)2SO4
NaKSO4
CaClBr
Na[Al(OH)4]
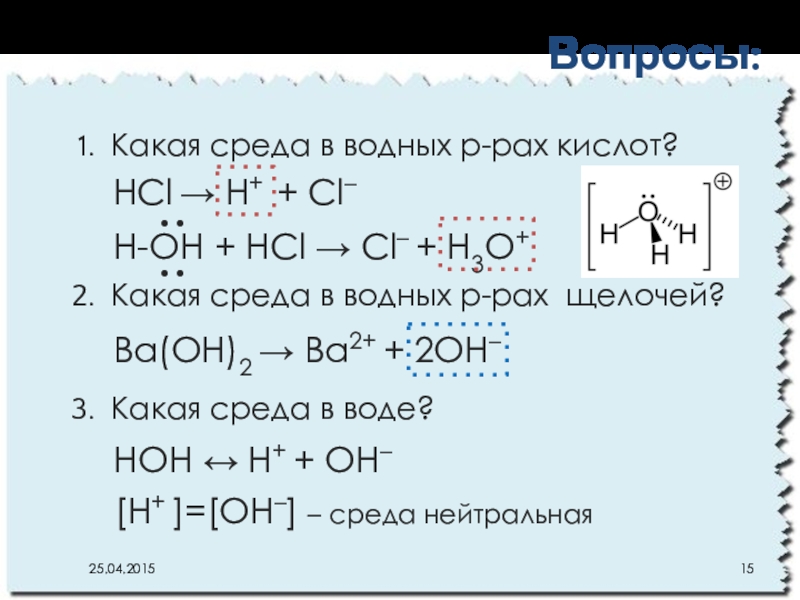
Слайд 15Какая среда в водных р-рах кислот?
Какая среда в водных р-рах щелочей?
Какая
Вопросы:
Ba(OH)2 → Ba2+ + 2ОH–
HOH ↔ Н+ + ОH–
..
H-OH + HCl → Cl– + H3O+
..
HCl → Н+ + Cl–
[Н+ ]=[ОH–] – среда нейтральная
Слайд 17т.е, образуются при взаимодействии кислоты и основания:
Соли – продукты реакции нейтрализации
Na2CO3
NaОН
FeSO4
Fe(ОН)2 + Н2SO4
KI
KОН + НI
CH3COONH4
NH4OН + CН3СOОН
Слайд 18только растворимые в воде соли, образованные разными по силе кислотой и
реакция среды водного раствора соответствует сильному компоненту;
гидролиз протекает по иону от слабого электролита (по катиону или по аниону)
Гидролизу подвергаются
Слайд 19Реакции, происходящие в растворах солей
рассмотрим 4 типа солей:
образованных сильным основанием и
образованных слабым основанием и сильной кислотой;
образованных сильным основанием и сильной кислотой;
образованных слабым основанием и слабой кислотой
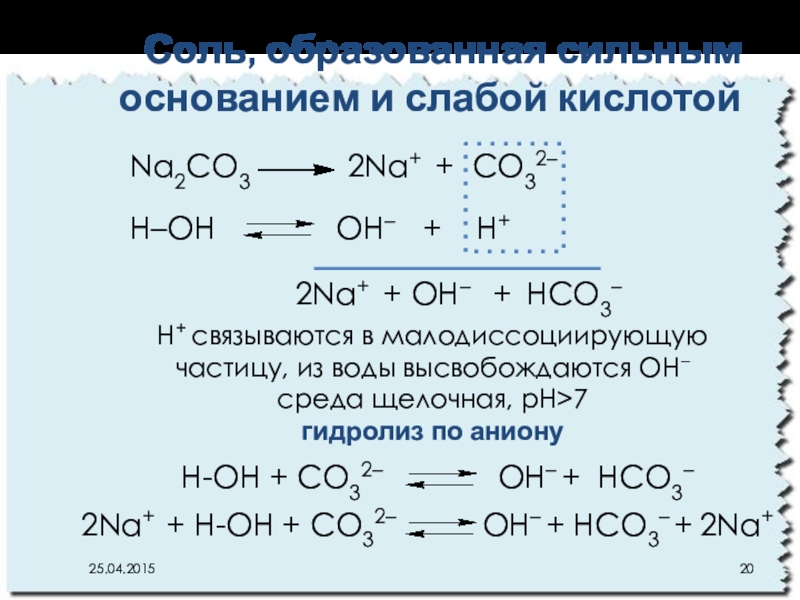
Слайд 20Соль, образованная сильным основанием и слабой кислотой
Na2CO3
Н–ОН OН– + Н+
2Na+ + OН– + НCO3–
Н+ связываются в малодиссоциирующую частицу, из воды высвобождаются OН–
среда щелочная, рН>7
гидролиз по аниону
Н-ОН + CO32– OН– + НCO3–
2Na+ + Н-ОН + CO32– OН– + НCO3– + 2Na+
Слайд 21Соль, образованная слабым основанием и сильной кислотой
FeSO4
Н–ОН OН– + Н+
FeOН+ + Н+ + SO42–
OН– связываются в малодиссоциирующую частицу, из воды высвобождаются Н+
среда кислая, рН<7
гидролиз по катиону
Н-ОН + Fe2+ FeOН+ + Н+
SO42– + Н-ОН + Fe2+– FeOН++ Н+ + SO42–
Слайд 22Соль, образованная сильным основанием и сильной кислотой
BaCl2
Н–ОН OН– + Н+
[Н+ ]=[ОH–] – среда нейтральная;
рН=7
в растворе нет ионов, которые могли бы связываться с молекулами воды в малодиссоциирующую частицу,
гидролиза нет
Слайд 23CН3СOОNH4 NН4+ + CН3СOО–
Н–ОН
NH4OН + CН3СOОН
если: ка<кв – среда слабощелочная;
ка>кв – среда кислая;
ка=кв – среда нейтральная;
CН3СOОNH4 + Н-ОН NH4OН +CН3СOОН
Соль, образованная слабым основанием и слабой кислотой
случай обратимого гидролиза
Слайд 24Упражнения:
1. Кислую среду имеет водный раствор
2. Щелочную среду имеет водный раствор
3.
☼
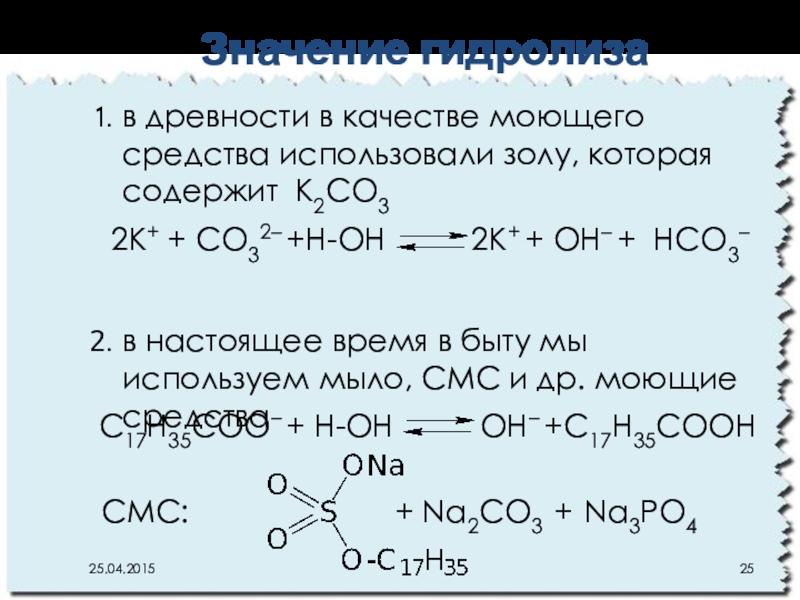
Слайд 25в древности в качестве моющего средства использовали золу, которая содержит К2CO3
в
Значение гидролиза
2К+ + CO32– +Н-ОН 2К+ + OН– + НCO3–
C17H35COO– + Н-ОН OН– +C17H35COOН
СМС: + Na2CO3 + Na3PO4
Слайд 26NН4+ + H2O NН3•H2O +
в фотографическом проявителе содержатся соли, создающие щелочную среду: К2CO3, Na2CO3, Na2В4O7
если кислотность почвы недостаточна, у растений появляется болезнь – хлороз (пожелтение листьев, отставание в росте); если рН>7,5, то в почву вносят (NH4)2SO4
Значение гидролиза
Слайд 27в составе крови содержатся NaНCO3, Na2НРO4; их роль заключается в поддержании
при избытке ионов Н+ , они связываются с ОН– и Х.Р. смещается вправо;
при избытке ионов ОН– Х.Р. смещается влево;
НCO3– + H2O Н2CO3 + ОН–
Значение гидролиза
НРO42–+ H2O Н2РO4– + ОН–