нашей жизни
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Физические свойства воды, Полякова Лариса Сергеевна, г.Евпатория
Содержание
- 1. Физические свойства воды, Полякова Лариса Сергеевна, г.Евпатория
- 2. ВодаБлаговолилаЛиться!ОнаБлисталаСтоль чиста,Что - ни напиться,Ни умыться,И это
- 3. История первая Так ли проста вода?«Вода - простейшее устойчивое соединение водорода с кислородом» (Краткая химическая энциклопедия)
- 4. В 1805 году немец Александр Гумбольдт и
- 5. Физические свойства тяжелой воды Различить тяжелую и обычную
- 6. Тяжелая водаСобственно тяжелая вода D2O в природе
- 7. Сверхтяжелая водаВскоре после открытия тяжелой воды была
- 8. Тяжелокислородная вода Всем этим не исчерпывается
- 9. Существование пяти водородных и девяти кислородных изотопов
- 10. Со всей научной строгостью классической
- 11. История вторая. Строение молекул воды и их
- 12. В отдельно рассматриваемой молекуле воды ядра атомов
- 13. Вода – универсальный растворительПод воздействием диполей воды
- 14. Полярность молекул воды порождает склонность к группировке
- 15. История третья Об аномалиях физических свойств воды
- 16. В периодической системе элементов Д.И.Менделеева кислород, сера,
- 17. Температура кипения и плавления гидридов элементов VI-й
- 18. Оказывается, водородные связи увеличили энергию
- 19. Почему лед не тонет?Кристаллы льда из-за водородных
- 20. Интересно свойство воды «прилипать» ко многим предметам,
- 21. Удивительно высокая удельная теплота парообразования Ассоциативность воды
- 22. Вода – наиболее теплоёмкое вещество на землеОказывается,
- 23. Среди необычных свойств воды трудно обойти вниманием
- 24. Высокое поверхностное натяжение позволяет воде принимать шарообразную
- 25. Прочнее стали Струя химически чистой воды сечением 1
- 26. Благодаря поверхностному натяжению и способности к смачиванию,
- 27. Итак, мы выяснили, что в основе всех
- 28. Тобою наслаждаются не ведая, что ты такое…Антуан де Сент-Экзюпери
ВодаБлаговолилаЛиться!ОнаБлисталаСтоль чиста,Что - ни напиться,Ни умыться,И это было неспроста.Ей Не хваталоИвы, талаИ горечи цветущих лоз.Ейводорослей не хваталоИ рыбы, жирной от стрекоз.ЕйНе хватало быть волнистой,Ей не хватало течь везде.Ей жизни не хватало -Чистой,ДистиллированнойВоде!Леонид Мартынов, 1946 год
Слайд 2Вода
Благоволила
Литься!
Она
Блистала
Столь чиста,
Что - ни напиться,
Ни умыться,
И это было неспроста.
Ей
Не хватало
Ивы,
тала
И горечи цветущих лоз.
Ей
водорослей не хватало
И рыбы, жирной от стрекоз.
Ей
Не хватало быть волнистой,
Ей не хватало течь везде.
Ей жизни не хватало -
Чистой,
Дистиллированной
Воде!
Леонид Мартынов, 1946 год
И горечи цветущих лоз.
Ей
водорослей не хватало
И рыбы, жирной от стрекоз.
Ей
Не хватало быть волнистой,
Ей не хватало течь везде.
Ей жизни не хватало -
Чистой,
Дистиллированной
Воде!
Леонид Мартынов, 1946 год
Слайд 3История первая
Так ли проста вода?
«Вода - простейшее устойчивое соединение водорода с
кислородом»
(Краткая химическая энциклопедия)
(Краткая химическая энциклопедия)
Слайд 4В 1805 году немец Александр Гумбольдт и француз Жозеф-Луи Гей-Люссак установили,
что вода состоит из молекул, каждая из которых содержит два атома водорода и один атом кислорода
В 1932 году мир облетела сенсация: кроме воды обычной, в природе существует еще и тяжелая вода. В молекулах такой воды место водорода занимает его тяжелый изотоп – дейтерий.
Тяжелую воду открыли американские физики Гарольд Юри и Эльберт Осборн. А в 1933 году их соотечественники Герберт Льюис и Ричард Макдональд впервые выделили её в чистом виде.
В 1932 году мир облетела сенсация: кроме воды обычной, в природе существует еще и тяжелая вода. В молекулах такой воды место водорода занимает его тяжелый изотоп – дейтерий.
Тяжелую воду открыли американские физики Гарольд Юри и Эльберт Осборн. А в 1933 году их соотечественники Герберт Льюис и Ричард Макдональд впервые выделили её в чистом виде.
Слайд 5Физические свойства тяжелой воды
Различить тяжелую и обычную воды можно только по
физическим характеристикам.
В молекулу тяжелой воды входят атомы не легкого водорода - протия ( 1Н ), а его изотопа – дейтерия ( 2D ), атом которого на единицу тяжелее протиевого, следовательно, молекулярная масса (Mr) тяжелой воды (D2O) на 2 единицы больше: 20, а не 18.
Эта вода на 10% плотнее обычной, её вязкость выше на 23%. Кипит она при +101,42о С, замерзает при +3,8о С
В молекулу тяжелой воды входят атомы не легкого водорода - протия ( 1Н ), а его изотопа – дейтерия ( 2D ), атом которого на единицу тяжелее протиевого, следовательно, молекулярная масса (Mr) тяжелой воды (D2O) на 2 единицы больше: 20, а не 18.
Эта вода на 10% плотнее обычной, её вязкость выше на 23%. Кипит она при +101,42о С, замерзает при +3,8о С
Слайд 6Тяжелая вода
Собственно тяжелая вода D2O в природе находится в ничтожных количествах
– в миллионных долях процента. Преобладает ее разновидность, состав которой можно выразить формулой HDO. В мировом океане содержится 1015 тонн HDO.
Тяжелая вода играет немалую роль в различных биологических процессах. Она действует отрицательно на многие жизненные функции у растений и животных.
Тяжелая вода играет немалую роль в различных биологических процессах. Она действует отрицательно на многие жизненные функции у растений и животных.
Слайд 7Сверхтяжелая вода
Вскоре после открытия тяжелой воды была обнаружена сверхтяжелая вода T2O.
В её составе место водорода занимает его природный изотоп, еще более тяжелый, чем дейтерий. Это тритий (Т), он радиоактивен, его атомная масса (Ar) равна 3.
Во всей гидросфере одновременно насчитывается лишь около 20 кг T2O. По своим свойствам сверхтяжелая вода еще заметнее отличается от обычной: кипит при +104о С, замерзает при +9о С; имеет плотность 1330 кг/м3
Перечень изотопов водорода не кончается тритием. Искусственно получены и более тяжелые - 4Н и 5Н.
Таким образом, возможно существование молекул воды, в которых содержатся любые из 5 водородных изотопов в любом сочетании.
Во всей гидросфере одновременно насчитывается лишь около 20 кг T2O. По своим свойствам сверхтяжелая вода еще заметнее отличается от обычной: кипит при +104о С, замерзает при +9о С; имеет плотность 1330 кг/м3
Перечень изотопов водорода не кончается тритием. Искусственно получены и более тяжелые - 4Н и 5Н.
Таким образом, возможно существование молекул воды, в которых содержатся любые из 5 водородных изотопов в любом сочетании.
Слайд 8Тяжелокислородная вода
Всем этим не исчерпывается сложность изотопного состава воды,
т.к. существуют также изотопы кислорода.
В природных водах в среднем на каждые 10 тысяч атомов изотопа 16О приходится 4 атома изотопа 17О и 20 атомов изотопа 18О.
По физическим свойствам тяжелокислородная вода меньше отличается от обычной, чем тяжеловодородная.
Помимо природных, существуют и шесть искусственно созданных изотопов кислорода (они недолговечны и радиоактивны). Это 13О, 14О, 15О, 19О,20О, 24О.
В природных водах в среднем на каждые 10 тысяч атомов изотопа 16О приходится 4 атома изотопа 17О и 20 атомов изотопа 18О.
По физическим свойствам тяжелокислородная вода меньше отличается от обычной, чем тяжеловодородная.
Помимо природных, существуют и шесть искусственно созданных изотопов кислорода (они недолговечны и радиоактивны). Это 13О, 14О, 15О, 19О,20О, 24О.
Слайд 9Существование пяти водородных и девяти кислородных изотопов говорит о том, что
изотопных разновидностей воды может быть 135.
Наиболее распространены в природе 9 устойчивых разновидностей воды:
H216O HD16O D216O
H217O HD17O D217O
H218O HD18O D218O
Основную массу природной воды – свыше 99% - составляет протиевая вода - H216O. Только миллионные доли процента составляет D2O, еще реже встречаются девять радиоактивных естественных видов воды, содержащих тритий:
T216O HT16O DT16O
T217O HT17O DT17O
T218O HT18O DT18O
Наиболее распространены в природе 9 устойчивых разновидностей воды:
H216O HD16O D216O
H217O HD17O D217O
H218O HD18O D218O
Основную массу природной воды – свыше 99% - составляет протиевая вода - H216O. Только миллионные доли процента составляет D2O, еще реже встречаются девять радиоактивных естественных видов воды, содержащих тритий:
T216O HT16O DT16O
T217O HT17O DT17O
T218O HT18O DT18O
Слайд 10 Со всей научной строгостью классической водой следует считать протиевую
воду H216O в чистом виде, т.е. без малейших примесей остальных 134 изотопных разновидностей. По понятным причинам, в естественных условиях такой воды не существует. Во всем мире её можно отыскать лишь в немногих специальных лабораториях. Её получают очень сложным путем и хранят с величайшими предосторожностями.
Вот какое непростое это «простейшее соединение» - вода. Теперь, говоря о воде и называя её общепринятую формулу H2O, будем иметь в виду, что состав воды, даже полностью освобожденной от примесей, сложен и многообразен.
Вот какое непростое это «простейшее соединение» - вода. Теперь, говоря о воде и называя её общепринятую формулу H2O, будем иметь в виду, что состав воды, даже полностью освобожденной от примесей, сложен и многообразен.
Слайд 11История вторая.
Строение молекул воды и их ассоциаты
Едва ли не все многообразие
свойств воды и необычность их проявления определяется в конечном счете физической природой этих атомов, способом их объединения в молекулу и группировкой образовавшихся молекул.
Слайд 12 В отдельно рассматриваемой молекуле воды ядра атомов водорода и кислорода расположены
в виде равнобедренного треугольника, в вершине которого – кислородное ядро, а в углах, прилегающих к основанию – по одному ядру водорода.
Пять электронных пар образуют электронное облако → у кислородного ядра создается избыток электронной плотности, а у водородных ядер – протонов наблюдается её недостаток. Поэтому, почти шарообразная молекула воды имеет заметно выраженную полярность, т.к. электрические заряды расположены в ней ассиметрично. По сути, каждая молекула воды является миниатюрным диполем.
Пять электронных пар образуют электронное облако → у кислородного ядра создается избыток электронной плотности, а у водородных ядер – протонов наблюдается её недостаток. Поэтому, почти шарообразная молекула воды имеет заметно выраженную полярность, т.к. электрические заряды расположены в ней ассиметрично. По сути, каждая молекула воды является миниатюрным диполем.
Слайд 13Вода – универсальный растворитель
Под воздействием диполей воды в 80 раз ослабевают
межатомные или межмолекулярные силы на поверхности погруженного в неё вещества. Во многом благодаря этому вода проявляет себя почти как универсальный растворитель – её растворяющему действию в той или иной мере подвластны и твердые тела, и жидкости, и газы.
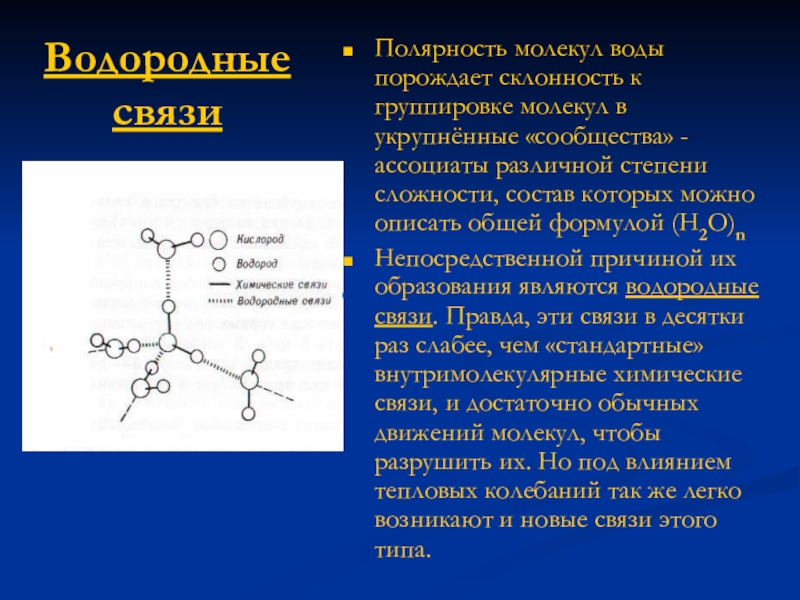
Слайд 14Полярность молекул воды порождает склонность к группировке молекул в укрупнённые «сообщества»
- ассоциаты различной степени сложности, состав которых можно описать общей формулой (H2O)n
Непосредственной причиной их образования являются водородные связи. Правда, эти связи в десятки раз слабее, чем «стандартные» внутримолекулярные химические связи, и достаточно обычных движений молекул, чтобы разрушить их. Но под влиянием тепловых колебаний так же легко возникают и новые связи этого типа.
Непосредственной причиной их образования являются водородные связи. Правда, эти связи в десятки раз слабее, чем «стандартные» внутримолекулярные химические связи, и достаточно обычных движений молекул, чтобы разрушить их. Но под влиянием тепловых колебаний так же легко возникают и новые связи этого типа.
Водородные связи
Слайд 16В периодической системе элементов Д.И.Менделеева кислород, сера, селен и теллур образуют
отдельную подгруппу. Они и их соединения имеют много общего в физических и химических свойствах.
Почему вода жидкая?
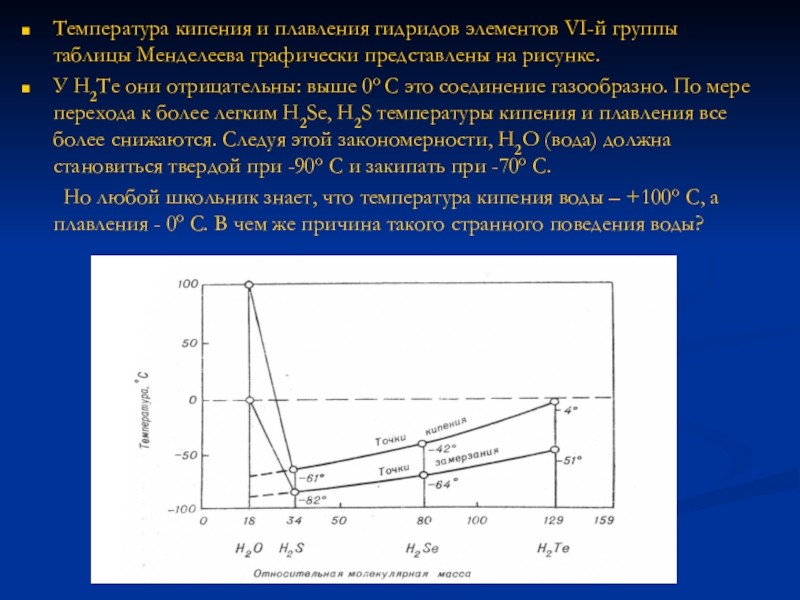
Слайд 17Температура кипения и плавления гидридов элементов VI-й группы таблицы Менделеева графически
представлены на рисунке.
У H2Te они отрицательны: выше 0о С это соединение газообразно. По мере перехода к более легким H2Se, H2S температуры кипения и плавления все более снижаются. Следуя этой закономерности, H2O (вода) должна становиться твердой при -90о С и закипать при -70о С.
Но любой школьник знает, что температура кипения воды – +100о С, а плавления - 0о С. В чем же причина такого странного поведения воды?
У H2Te они отрицательны: выше 0о С это соединение газообразно. По мере перехода к более легким H2Se, H2S температуры кипения и плавления все более снижаются. Следуя этой закономерности, H2O (вода) должна становиться твердой при -90о С и закипать при -70о С.
Но любой школьник знает, что температура кипения воды – +100о С, а плавления - 0о С. В чем же причина такого странного поведения воды?
Слайд 18 Оказывается, водородные связи увеличили энергию взаимодействия молекул воды настолько,
что её истинная температура кипения почти на 170о С выше, чем та, которая полагается по теории, не учитывающей существование таких связей. Благодаря этому факту вода - единственное вещество, существующее в условиях нашей планеты сразу в трех агрегатных состояниях.
Слайд 19Почему лед не тонет?
Кристаллы льда из-за водородных связей похожи по структуре
на алмаз. Каркас водородных связей удерживает молекулы воды в структуре льда на несколько большем расстоянии, чем в жидкой воде. В результате – еще одно отклонение от общепринятого поведения: если при понижении температуры плотность большинства веществ обычно возрастает, то здесь картина другая – плотность льда составляет 920 кг/м3, в то время как плотность воды при 4о С равна 1000 кг/м3. Таким образом, при образовании льда объем увеличивается на 10% по сравнению с объемом, занимаемым той же массой воды.
Свойство твердого льда становится легче жидкости того же химического состава оказалось необычайно важным для жизни природы, т.к. с наступлением холодов вода в реках и озерах покрывается льдом только на поверхности, и прочный ледяной панцирь, не опускаясь, защищает от замерзания глубинные слои воды, спасая жизнь водным растениям и животным.
Свойство твердого льда становится легче жидкости того же химического состава оказалось необычайно важным для жизни природы, т.к. с наступлением холодов вода в реках и озерах покрывается льдом только на поверхности, и прочный ледяной панцирь, не опускаясь, защищает от замерзания глубинные слои воды, спасая жизнь водным растениям и животным.
Слайд 20Интересно свойство воды «прилипать» ко многим предметам, то есть смачивать их.
При изучении данной аномалии установили, что все вещества, которые легко смачиваются водой (глина, песок, стекло, бумага и др.), непременно имеют в своем составе атомы кислорода. Для объяснения природы смачивания этот факт оказался ключевым: энергетически неуравновешенные молекулы поверхностного слоя воды получают возможность образовывать дополнительные водородные связи с «посторонними» атомами кислорода.
Слайд 21Удивительно высокая удельная теплота парообразования
Ассоциативность воды сказывается и на очень
высокой удельной теплоте ее парообразования. Чтобы испарить воду, уже нагретую до 100о С, требуется вшестеро больше количества теплоты, чем для нагрева этой же массы воды на 80о С (от 20о С до 100о С)
Каждую минуту миллион тонн воды гидросферы испаряется от солнечного нагрева. В результате в атмосферу поступает колоссальное количество теплоты, эквивалентное тому, которое вырабатывали бы 40 тысяч электростанций мощностью по 1 млрд. кВатт каждая!
При плавлении льда тоже немало энергии уходит на преодоление связей ледяных кристаллов, хотя и вшестеро меньше, чем при испарении воды. Это и понятно – ведь молекулы Н2О фактически остаются в той же среде, меняется лишь фазовое состояние воды.
Каждую минуту миллион тонн воды гидросферы испаряется от солнечного нагрева. В результате в атмосферу поступает колоссальное количество теплоты, эквивалентное тому, которое вырабатывали бы 40 тысяч электростанций мощностью по 1 млрд. кВатт каждая!
При плавлении льда тоже немало энергии уходит на преодоление связей ледяных кристаллов, хотя и вшестеро меньше, чем при испарении воды. Это и понятно – ведь молекулы Н2О фактически остаются в той же среде, меняется лишь фазовое состояние воды.
Слайд 22Вода – наиболее теплоёмкое вещество на земле
Оказывается, вода обладает еще одной
замечательной способностью – высокой теплоемкостью. Поглощая огромное количество теплоты, сама вода существенно не нагревается, т.к тепло, подводимое к воде, с большим трудом разрывает сетку водородных связей. Эта способность воды накапливать большие запасы тепловой энергии позволяет сглаживать капризы погоды на земной поверхности в различные времена года и в разное время суток.
Слайд 23 Среди необычных свойств воды трудно обойти вниманием и еще одно –
её исключительно высокое поверхностное натяжение – 0,073 Н/м (при 20о С). Из всех жидкостей более высокое поверхностное натяжение имеет только ртуть. Это свойство проявляется в том, что вода постоянно стремится «стянуть», сократить свою поверхность. Она лишь кажется бесформенной, растекаясь по любой поверхности. Сила поверхностного натяжения заставляет молекулы её наружного слоя «сцепляться», создавая внешнюю упругую плёнку, свойство которой также определяется замкнутыми и разомкнутыми водородными связями, т.е ассоциатами. Благодаря плёнке многие насекомые (водомерки, ногохвостки) не только передвигаются по поверхности воды, но взлетают с нее и садятся, как на твердую опору.
Слайд 24 Высокое поверхностное натяжение позволяет воде принимать шарообразную форму при свободном падении
или в состоянии невесомости: ведь такая геометрическая форма имеет минимальную для данного объема поверхность.
Слайд 25Прочнее стали
Струя химически чистой воды сечением 1 см2 по прочности на
разрыв не уступает стали того же сечения. Водную струю как бы цементирует сила поверхностного натяжения.
Слайд 26Благодаря поверхностному натяжению и способности к смачиванию, вода может подниматься в
узких вертикальных каналах на высоту гораздо большую, чем та, которую допускает сила тяжести, т.е. вода обладает свойством капиллярности, что имеет огромное значение в жизнедеятельности растений.
Слайд 27 Итак, мы выяснили, что в основе всех вышеперечисленных неожиданных свойств воды
лежит самая главная особенность её строения – водородные связи, благодаря которым образуются ассоциаты.
И теперь мы можем с полной уверенностью утверждать, что и причиной гибели «Титаника» в конечном счёте были водородные связи.
И теперь мы можем с полной уверенностью утверждать, что и причиной гибели «Титаника» в конечном счёте были водородные связи.