- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Электронный учебный модуль информационного типа на тему: Растворы
Содержание
- 1. Электронный учебный модуль информационного типа на тему: Растворы
- 2. Содержание ЭДМВведениеРекомендации по работе с ЭДМТребования ГОСЦели
- 3. ВведениеУчебный материал представлен в соответствии с
- 4. Рекомендации по работе с ЭДМОзнакомьтесь с требованиями
- 5. Требования ГОСпосле изучения темы «Растворы». Студент должен
- 6. Цели занятияРазвивающая: формирование навыков самообразования, развитие речи,
- 7. Истинные растворы Истинным раствором называется термодинамически устойчивая
- 8. Истинные растворыКомпонент, агрегатное состояние которого не изменяется
- 9. Вода – как растворительСамым распространенным растворителем на
- 10. Вода – как растворительВследствие высокой теплоемкости (75,3
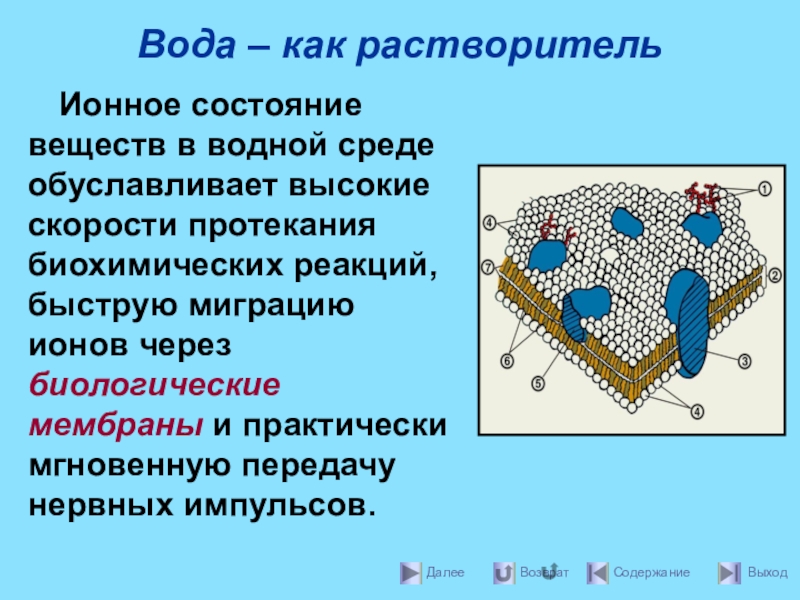
- 11. Вода – как растворительИонное состояние веществ в
- 12. Вода – как растворительводорода, а к двум
- 13. Вода – как растворительЗа счет двух атомов
- 14. Вода – как растворительВ соответствии с принципом
- 15. Вода – как растворительК гидрофильным относятся ионы
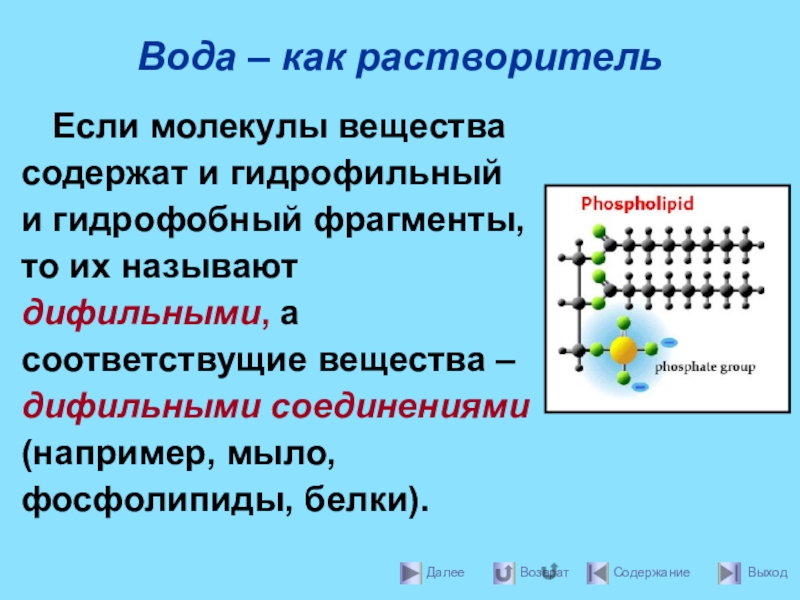
- 16. Вода – как растворительЕсли молекулы вещества содержат
- 17. Классификация растворовРастворы веществ с молярной массой 5000г/моль
- 18. Классификация растворовРастворы НМС – электролитов и неэлектролитов
- 19. РастворимостьВследствие диффузии, частицы равномерно распределяются по всему
- 20. РастворимостьМассу растворенного вещества, приходящуюся в насыщенном растворе
- 21. Коэффициент растворимостиЧисленно растворимость вещества равна концентрации его
- 22. Коэффициент растворимостиНеполярные и малополярные соединения хорошо растворимы
- 23. Если к равновесной системе «твердое вещество +
- 24. Влияние давленияПри растворении твердых и жидких веществ
- 25. Коллигативные свойства растворовКоллигативными свойствами называются свойства растворов,
- 26. Коллигативные свойства растворовКоллигативными свойствами разбавленных растворов являются:скорость
- 27. ДиффузияДиффузией в растворе называется самопроизвольный направленный процесс
- 28. ОсмосОсмосом называется самопроизвольная диффузия молекул растворителя сквозь
- 29. Осмос Вследствие уменьшения разности концентрации растворителя в
- 30. Осмос В результате изменения скоростей диффузий в системе
- 31. ОсмосПоявляющееся избыточное гидростатистическое давление в системе является
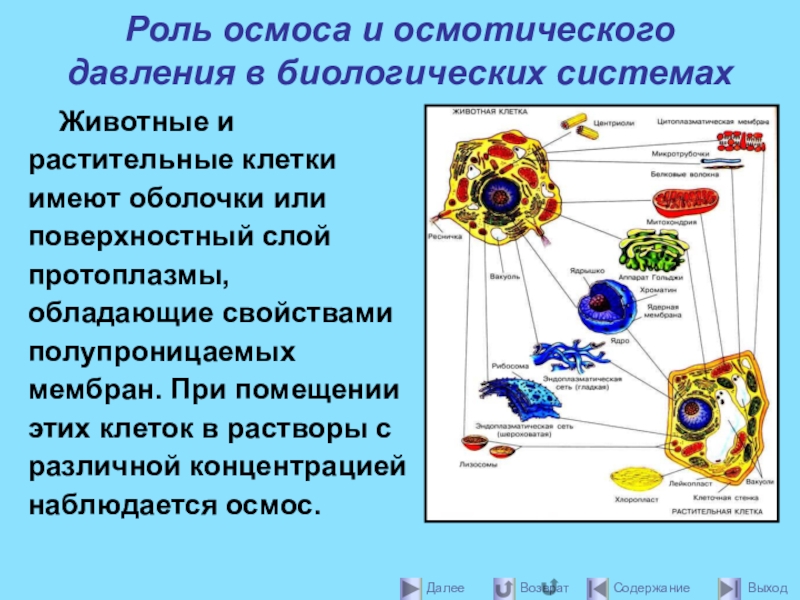
- 32. Роль осмоса и осмотического давления в биологических
- 33. Роль осмоса и осмотического давления в биологических
- 34. Роль осмоса и осмотического давления в биологических
- 35. Роль осмоса и осмотического давления в биологических
- 36. Роль осмоса и осмотического давления в биологических
- 37. Роль осмоса и осмотического давления в биологических
- 38. Роль осмоса и осмотического давления в биологических
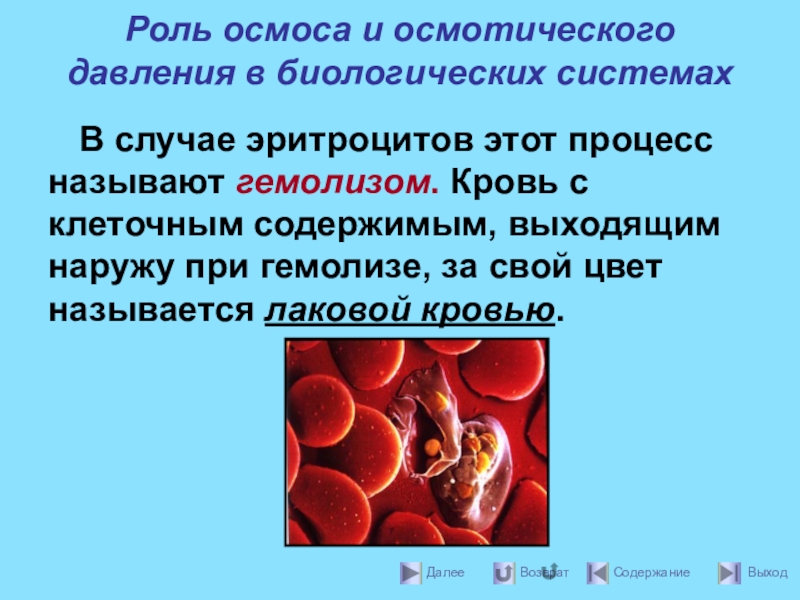
- 39. Роль осмоса и осмотического давления в биологических
- 40. Роль осмоса и осмотического давления в биологических
- 41. Гипертонические растворы соли (рассол) и сахара (сироп)
- 42. ПриложениеРоль осмоса и осмотического давления в биологических системах
- 43. Термины определения Гидрофильные функциональные группы - ионы и
- 44. Термины определенияИзотонические растворы - растворы, имеющие одинаковое
- 45. Термины определения Истинный раствор - термодинамически устойчивая гомогенная
- 46. Термины определения Насыщенный раствор - растворы содержащие при
- 47. Термины определенияОсмос - самопроизвольная диффузия молекул растворителя
- 48. Термины определения Растворение – физико-химический процесс, в котором
- 49. Термины определенияРастворитель - компонент, агрегатное состояние которого
- 50. ЛитератураОбщая химия: учеб. для 11 кл.
- 51. Литература3. Общая химия / Л.М. Пустовалова, И.Е.
- 52. Конец работы. Вы действительно хотите закончить работу с информационным учебным материалом темы «Растворы»?ДаНет
Слайд 1ГАПОУ «Казанский медицинский колледж»
Электронный учебный модуль информационного типа на тему:
«Растворы»
Специальность: «Фармация»
Слайд 2Содержание ЭДМ
Введение
Рекомендации по работе с ЭДМ
Требования ГОС
Цели занятия
Истинные растворы
Вода как
Классификация растворов
Растворимость
Коэффициент растворимости
Коллигативные свойства раствора.
Диффузия
Осмос
Роль осмоса и осмотического давления в биологической системе
Приложение
Термины и определения
Литература
Слайд 3Введение
Учебный материал представлен в соответствии с требованиями Государственного образовательного стандарта
Электронный дидактический материал информационного типа на тему: «Растворы» предназначен для проведения теоретического занятия и самостоятельной работы студентов медицинских училищ и колледжей СМОУ РТ и РФ.
Слайд 4Рекомендации по работе с ЭДМ
Ознакомьтесь с требованиями ГОС по данной теме.
1.
2. Выучите термины и определения.
3. Выполните задания для закрепления знаний.
Ерохин Ю.М. (Сборник задач и упражнений.- 2010.-304с.).
Ответить на вопросы стр. 26, 11-17, стр. 32, 4-14.
Выполнить упражнения стр.27, 1-6, стр. 33 2-5; 14-22.
Слайд 5Требования ГОС
после изучения темы «Растворы».
Студент должен знать:
определение растворов и их
механизм образования растворов;
две основные теории растворов;
растворимость веществ;
роль диффузии в процессах переноса веществ в биологических системах;
роль осмоса и осмотического давления в биологических системах.
Слайд 6Цели занятия
Развивающая: формирование навыков самообразования, развитие речи, памяти, мышления, самореализации личности.
Учебная:
Воспитательная: формирование у студентов общечеловеческих ценностей; целостного миропонимания и современного научного мировоззрения.
Слайд 7Истинные растворы
Истинным раствором называется термодинамически устойчивая
состава, состоящая из двух и более
компонентов, между которыми существуют достаточно сильные взаимодействия.
Слайд 8Истинные растворы
Компонент, агрегатное состояние которого не изменяется при образовании раствора, принято
Слайд 9Вода – как растворитель
Самым распространенным растворителем на нашей планете является вода.
Слайд 10Вода – как растворитель
Вследствие высокой теплоемкости (75,3 Дж/(моль·К)) и большой теплоты
Слайд 11Вода – как растворитель
Ионное состояние веществ в водной среде обуславливает высокие
Слайд 12Вода – как растворитель
водорода, а к двум другим направлены атомные орбитали
Геометрически молекула воды представляет собой угловую систему, в центре которой находится атом кислорода с sp3-гибридизацией валентных атомных орбиталей. При этом в двух вершинах тетраэдра находятся атомы
Слайд 13Вода – как растворитель
За счет двух атомов водорода, несущих частично положительный
Слайд 14Вода – как растворитель
В соответствии с принципом «подобное в подобном» в
В зависимости от сродства к воде функциональные группы подразделяют на гидрофильные («любящие воду») и гидрофобные («боящиеся воды»).
Слайд 15Вода – как растворитель
К гидрофильным относятся ионы и полярные группы: гидроксильная
К гидрофобным относятся неполярные группы: углеводородные радикалы предельных (–CnH2n+1), непредельных (–CnH2n-1) и ароматических (–С6Н5) соединений.
Слайд 16Вода – как растворитель
Если молекулы вещества содержат и гидрофильный и гидрофобный
Слайд 17Классификация растворов
Растворы веществ с молярной массой
По наличию или отсутствию электролитической диссоциации растворы НМС подразделяют на растворы электролитов и неэлектролитов.
Слайд 18Классификация растворов
Растворы НМС – электролитов и неэлектролитов – называют истинными в
Растворы ВМС, в состав которых входит большое число функциональных групп, способных к ионизации, называют растворами полиэлектролитов (растворы белков, нуклеиновых кислот).
Слайд 19Растворимость
Вследствие диффузии, частицы равномерно распределяются по всему объему растворителя. Растворение идет
Растворы, содержащие при данной температуре максимальное количество растворенного вещества и находящиеся в равновесии с избытком растворенного вещества, называют насыщенным.
Слайд 20Растворимость
Массу растворенного вещества, приходящуюся в насыщенном растворе при данной температуре на
Слайд 21Коэффициент растворимости
Численно растворимость вещества равна концентрации его насыщенного раствора. Растворимость зависит
Слайд 22Коэффициент растворимости
Неполярные и малополярные соединения хорошо растворимы в неполярных и малополярных
Высокая растворимость веществ довольно часто обусловлена образованием межмолекулярных, в частности водородных, связей (спирт в воде).
Слайд 23Если к равновесной системе «твердое вещество + растворитель» применить принцип Ле
Влияние температуры
Слайд 24Влияние давления
При растворении твердых и жидких веществ в воде объем системы
Слайд 25Коллигативные свойства растворов
Коллигативными свойствами называются свойства растворов, не зависящие от природы
Слайд 26Коллигативные свойства растворов
Коллигативными свойствами разбавленных растворов являются:
скорость диффузии;
осмотическое давление;
давление насыщенного пара
температура кристаллизации раствора;
температура кипения раствора.
Слайд 27Диффузия
Диффузией в растворе называется самопроизвольный направленный процесс переноса частиц растворенного вещества
Слайд 28Осмос
Осмосом называется самопроизвольная диффузия молекул растворителя сквозь мембран с избирательной проницаемостью.
В
Слайд 29Осмос
Вследствие уменьшения разности концентрации растворителя в разделенных частях системы и
Слайд 30Осмос
В результате изменения скоростей диффузий в системе наступит состояние динамического физико-химического
Vр-ля = Vр-ля.
Слайд 31Осмос
Появляющееся избыточное гидростатистическое давление в системе является следствием осмоса, поэтому это
Осмотическим давлением (π) называют избыточное гидростатистическое давление, возникающее в результате осмоса и приводящее к выравниванию скоростей взаимного проникновения молекул растворителя сквозь мембрану с избирательной проницаемостью.
Слайд 32Роль осмоса и осмотического давления в биологических системах
Животные и растительные клетки
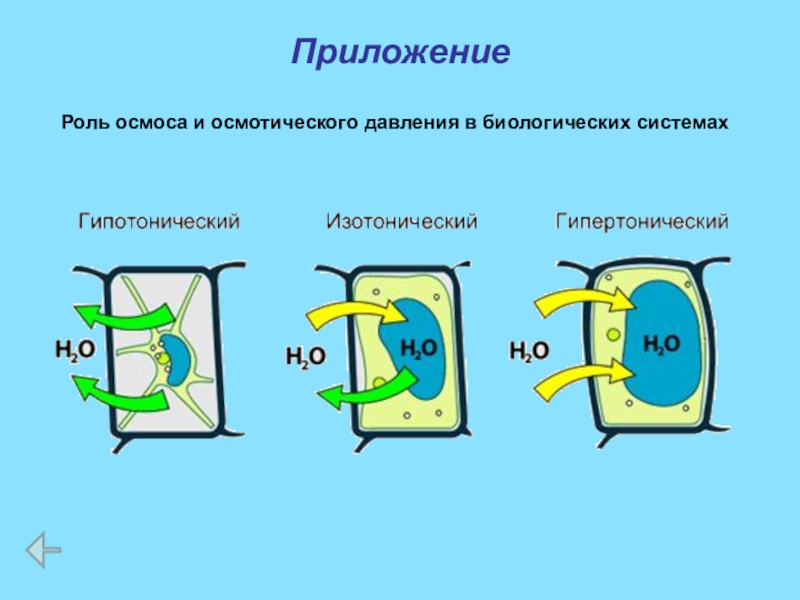
Слайд 33Роль осмоса и осмотического давления в биологических системах
Растворы, имеющие одинаковое осмотическое
Слайд 34Роль осмоса и осмотического давления в биологических системах
Если два раствора имеют
При помещении клеток в изотонический раствор клетки сохраняют свой размер и нормально функционируют.
Слайд 35Роль осмоса и осмотического давления в биологических системах
При помещении клеток в
(Ссылка)
Слайд 36Роль осмоса и осмотического давления в биологических системах
В случае эритроцитов этот
Слайд 37Роль осмоса и осмотического давления в биологических системах
При помещении клеток в
Слайд 38Роль осмоса и осмотического давления в биологических системах
Действие слабительных – горькой
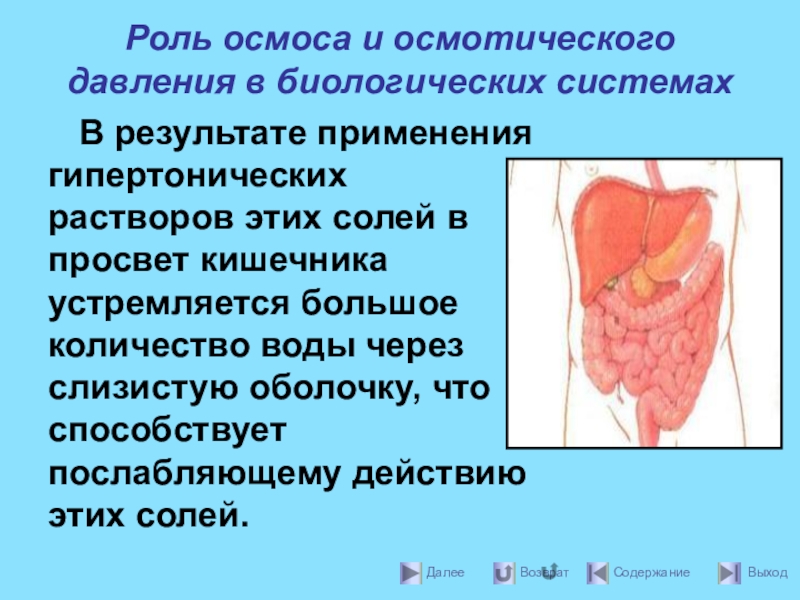
Слайд 39Роль осмоса и осмотического давления в биологических системах
В результате применения гипертонических
Слайд 40Роль осмоса и осмотического давления в биологических системах
Гипертонические растворы в небольших
Слайд 41Гипертонические растворы соли (рассол) и сахара (сироп) используют при консервировании продуктов,
Роль осмоса и осмотического давления в биологических системах
Слайд 43Термины определения
Гидрофильные функциональные группы - ионы и полярные группы: гидроксильная –ОН,
Гидрофобным функциональные группы - неполярные группы: углеводородные радикалы предельных (–CnH2n+1), непредельных (–CnH2n-1) и ароматических (–С6Н5) соединений.
Слайд 44Термины определения
Изотонические растворы - растворы, имеющие одинаковое осмотическое давление.
Слайд 45Термины определения
Истинный раствор - термодинамически устойчивая гомогенная система переменного состава, состоящая
Слайд 46Термины определения
Насыщенный раствор - растворы содержащие при данной температуре максимальное количество
Ненасыщенный раствор – раствор, количество растворенного вещества в котором меньше, чем в насыщенном.
Слайд 47Термины определения
Осмос - самопроизвольная диффузия молекул растворителя сквозь мембран с избирательной
Перенасыщенный раствор – раствор, количество растворенного вещества в котором выше, чем в насыщенном.
Слайд 48Термины определения
Растворение – физико-химический процесс, в котором играют роль как физические,
Растворимость данного вещества - масса растворенного вещества, приходящаяся в насыщенном растворе при данной температуре на 100г растворителя.
Слайд 49Термины определения
Растворитель - компонент, агрегатное состояние которого не изменяется при образовании
Сольватация – процесс образования химических связей частиц растворенного вещества и растворителя
Теплота растворения – теплота, выделяемая или поглощаемая при растворении 1 моль вещества.
Слайд 50 Литература
Общая химия: учеб. для 11 кл. общеобразоват. Учреждений О-28 с
Практикум о общей химии. Биофизическая химия. Химия Биогенных элементов. Учеб. пособие для вузов/ А.В. Бабков, В.А. Попков, С.А. Пузаков, Л.И. Трофимова; Под. ред. В.А. Попкова, А.В. Бабкова, 2-е изд., перераб. и доп. – М.: высш. шк., 2001. – 237 с.: ил.
Слайд 51Литература
3. Общая химия / Л.М. Пустовалова, И.Е. Никанорова. – Ростов-на-Дону: Феникс,
4. Химия: Основы химии живого: учебник для вузов. – 3-е изд., испр. – СПб: Химиздат, 2005. – 784 с.: ил.
Слайд 52Конец работы. Вы действительно хотите закончить работу с информационным учебным материалом темы
Да
Нет