- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Тотығу-тотықсыздану реакциялары (10класс)
Содержание
- 1. Презентация по химии на тему Тотығу-тотықсыздану реакциялары (10класс)
- 2. «Өткенді ұмытпа, ол – болашақтың ұстазы »1.
- 3. ІІ. «Қайталау – оқу анасы» Топтарға тест сұрақтарын беру «Ротация» әдісі бойынша тексеріледі
- 4. «Кім жылдам» I-топ1. Тотығу дәрежесі +4 ке
- 5. «Кім жылдам» II-топ1. Тотығу дәрежесі +5 ке
- 6. «Кім жылдам» III-топ1. Тотығу дәрежесі +1 ге
- 7. Белгісіз элементті немесе индекстерін тап а) ?-3
- 8. Сабақтың тақырыбы:
- 9. тотықсыздандырғыш(тотығады)тотықтырғыш(тотықсызданады)4ē2ēтотықсыздандырғыш(тотығады)тотықтырғыш(тотықсызданады)2ēтотықсыздандырғыш(тотығады)тотықтырғыш(тотықсызданады)
- 10. Электрондар беру
- 11. ТТР екі реакциядан (жарты реакциялар): тотығу және
- 12. Ең маңызды тотықтырғыштар: күштілері – F2, O2,
- 13. ТТР теңдеулерін құрастыру, яғни реакция өнімдерін анықтау
- 14. ТТР-сы теңдеулерін теңестіру реті төмендегідей: 1. Химиялық
- 15. 4. Электрондық баланс теңдеуін құру.
- 16. ТТР теңдеулері күрделірек болғанда мына реттілікті қолдану.1
- 17. 4. Электрондық теңдеудің қасына тік сызық сызып,
- 18. ТТР-ның маңызы:ТТР өндірісте, тұрмыста жүзеге асып жататын
- 19. Мәтінмен жұмысСұрақтар: 1. Химиялық реакция типін тап.
- 20. Сабақты бекіту: “Кім
- 21. Слайд 21
- 22. Слайд 22
- 23. Үйге тапсырма: .§3.2. 72 беттегі 1-4 тапсырма.
Слайд 1Сабақтың тақырыбы: Тотығу-тотықсыздану реакциялары.
Сабақтың мақсаты:
а) білімділік. «Тотығу дәрежесі» ұғымын бекіту,
ә) дамытушылық: Оқушылардың ойлау қабілетін дамыту, бақылап, анализ жасау, салыстыру, себеп-салдарлы байланыстарды табу, қорытынды жасау, алгоритммен жұмыс жасау дағдасын дамыту, пәнге қызығушылығын қалыптастыру.
б) тәрбиелік. Оқушылардың ғылыми дүниетанымын қалыптастыру, еңбек ету дағдысын жетілдіру, оларды логикалық ойлауға, ізденімпаздыққа тәрбиелеу.
Слайд 2«Өткенді ұмытпа, ол – болашақтың ұстазы »
1. Реакцияға қатысқан және нәтижесінде
2.Тотығу-тотықсыздану реакциясының типтері қандай?
Молекулааралық: 2KMnO4 + 16 HCl--------5CL2+2KCl+2MnCl2+ 8H2O
Молекулаішілік: 2KClO3------2KCl+3O2
Диспропорциялану: 6KOH+ 3Cl2---------5KCl+KClO3+3H2O
3.Реакцияның қайтымдылығы бойынша қалай жіктеледі? (қайтымды, қайтымсыз)
4. Реакцияның жылу эффектісі бойынша қалай жіктеледі? ( экзотермиялық және эндотермиялық )
5. Әрекеттесетін заттардың агрегаттық күйіне қарай қалай жіктеледі? (гомогенді және гетерогенді)
6. Өршіткі қатысына қарай қалай жіктеледі? (катализдік, катализдік емес)
7. Қосылу реакциясы дегеніміз не?
8. Айырылу реакциясы дегеніміз не?
9. Алмасу реакциясы дегеніміз не?
10. Орынбасу реакциясы дегеніміз не?
ІІ. Үй тапсырмасын сұрау.
Слайд 4«Кім жылдам» I-топ
1. Тотығу дәрежесі +4 ке тең
а)
2. Қай қосылыста элементтің тотығу дәрежесі нольге тең ?
а) CuS ә) O2 б) CaS в) Ba3(PO4)2
3. Қосылыстардағы хлордың +7 тотығу дәрежесін анықта
а) KClO3 ә) KClO4 б) NaCl ) в) BaCl2
Слайд 5«Кім жылдам» II-топ
1. Тотығу дәрежесі +5 ке тең
а)
2. Қай қосылыста элементтің тотығу дәрежесі нольге тең ?
а) CuS ә) F2 б) BaS в) Ba3(PO4)2
3. Қосылыстардағы хлордың +5 тотығу дәрежесін анықта
а) KClO3 ә) KClO4 б) NaCl ) в) BaCl2
Слайд 6«Кім жылдам» III-топ
1. Тотығу дәрежесі +1 ге тең
а)
2. Қай қосылыста элементтің тотығу дәрежесі нольге тең ?
а) CuS ә) S8 б) BaS в) Ba3(PO4)2
3. Қосылыстардағы хлордың -1 тотығу дәрежесін анықта
а) KClO3 ә) KClO4 б) NaCl ) в) BaCl2
Слайд 7Белгісіз элементті немесе индекстерін тап
а) ?-3 H3+1
ә) Ca3+2 P?-3
б) Ca?
в) N2?
г) Na+1 F?
д) Na2+1S?O4-2
Слайд 8
Сабақтың тақырыбы:
Тотығу-тотықсыздану реакциялары.
ІІІ. Жаңа сабақты түсіндіру
1. Валенттілік электрондары электртерістілігі
Слайд 9тотықсыздандырғыш
(тотығады)
тотықтырғыш
(тотықсызданады)
4ē
2ē
тотықсыздандырғыш
(тотығады)
тотықтырғыш
(тотықсызданады)
2ē
тотықсыздандырғыш
(тотығады)
тотықтырғыш
(тотықсызданады)
Слайд 10
Электрондар беру процесі – тотығу,
Электрондарды қосып алатын атомдар немесе иондар тотықтырғыш, ал беретіндері тотықсыздандырғыш болады.
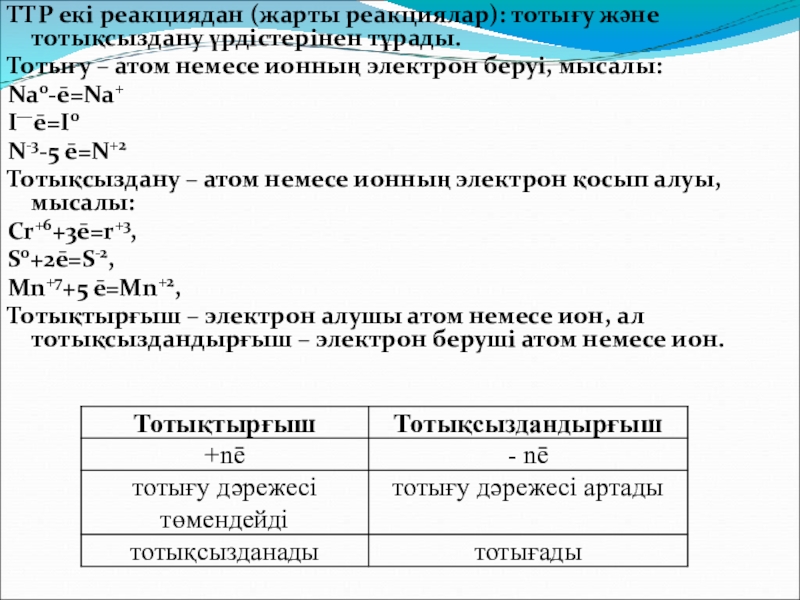
Слайд 11ТТР екі реакциядан (жарты реакциялар): тотығу және тотықсыздану үрдістерінен тұрады.
Тотығу –
Na0-ē=Na+
I—ē=I0
N-3-5 ē=N+2
Тотықсыздану – атом немесе ионның электрон қосып алуы, мысалы:
Cr+6+3ē=r+3,
S0+2ē=S-2,
Mn+7+5 ē=Mn+2,
Тотықтырғыш – электрон алушы атом немесе ион, ал тотықсыздандырғыш – электрон беруші атом немесе ион.
Слайд 12Ең маңызды тотықтырғыштар: күштілері – F2, O2, O3, H2O2, Cl2 (әсіресе
Маңызды тотықсыздандырғыштар: күштілері – сілтілік және сілтілік жер металдар, (әсіресе бөлінген күйінде), HI және иодидтер, H2S және сульфидтер, NH3, PH3, H3PO3, C, CO, Fe2+, Cr2+ және т.б.; әлсіздері – активтілігі төмен металдар (Pb, Cu, Ag,Hg), HCl және хлоридтер, SO2, HNO2 және т.б.
ТТР мынадай типтері бар:
1) тотықтырғыш пен тотықсыздандырғыш әр түрлі молекулалар құрамына кіретін молекулааралық реакциялар;
2) тотықтырғыш пен тотықсыздандырғыш бір молекуланың құрамына кіретін молекулаішілік реакциялар;
3) бір элемент атомының бір мезетте тотығу дәрежесінің әрі өсуі, әрі кемуі арқылы жүретін диспропорциялану реакциялары.
Слайд 13ТТР теңдеулерін құрастыру, яғни реакция өнімдерін анықтау және стехиометриялық коэффициенттерді табу
1) Тотықтырғыш пен тотықсыздандырғыш анықтап алу керек. Ол үшін типті тотықтырғыш пен тотықсыздандырғыштың тізімін пайдалану керек.
2) Реакциядан кейін тотықтырғыш пен тотықсыздандырғыш қандай тотығу дәрежелеріне ие болатынын анықтау керек. Реакцияға неғұрлым күшті тотықтырғыш қатысса, соғұрлым тотықсыздандырғыштың тотығу дәрежесі өседі. Мысалы, H2S әлсіз тотықтырғыштың әсерінен S0(S-2→ S0)-ке айналады, ал күшті тотықтырғыш әсер етсе, H2SO4-ке (S-2→ S+6) айналады.
Осыған ұқсас неғұрлым күшті тотықсыздандырғыш тотықтырғышпен әрекеттесе, соғұрлым тотықтырғыштың тотығу дәрежесі төмендейді.
Мысалы, H2SO4 әлсіз тотықсыздандырғыш әсерінен SO2-ге (S+6→ S+4), ал күшті тотықсыздандырғыш әсерінен H2S-ке (S+6→ S-2) айналады.
3) Берілген ортада (қышқыл, сілтілі және бейтарап) тотыққан және тотықсызданған элементтер қандай қосылыс күйінде болатынын анықтайды. Мысалы, Fe+3 қышқыл ортада Fe(III) тұзы күйінде, ал сілтілі ортада Fe(OH)3 күйінде болады.
4) ТТР теңдеуіндегі коэффициенттер электрондық және электронды-иондық баланс арқылы анықталады.
Слайд 14ТТР-сы теңдеулерін теңестіру реті төмендегідей:
1. Химиялық реакция теңдеулерін жазу.
Al+H2SO4 →Al2(SO4)3+H2↑
2. Теңдеулердің
3. Реакция нәтижесінде тотығу дәрежесі өзгерген элементтердің астын сызу.
0 +1+6-2 +3 +6 -2 0 Al + H2SO4 → Al2(SO4)3 + H2↑
Слайд 15 4. Электрондық баланс теңдеуін құру. (ағылшынша balance-
теңдестіру,
Al° - 3ē →Al0 +3 3 2 2H+1 + 2ē = H2 2 3
5. Таңдалған коэффиценттерді реакция теңдеуіне жазу.
2Al°+3H2+1S+6O4-2 =Al2+3(S+6O4-2)3+3H2°↑
6. Оттек атомдарының санын есептеу арқылы
коэффиценттердің дұрыс екендігін тексеру.
2 2Al°+3H2+1S+6O4-2 =Al2+3(S+6O4-2)3+3H2°↑
Слайд 16ТТР теңдеулері күрделірек болғанда мына реттілікті қолдану.
1 Тотығу дәрежесі өзгергендерінің астын
K+1Mn+7O4-2 + H+1Cl-1 → K+1Cl-1 + Mn+2Cl2 + Cl20 + H2+1O-2
2 Тотығу дәрежесі өзгерген атомдарды немесе иондарды бөліп
жазу.
Mn+7 → Mn+2
Cl-1 → Cl0
3. Атомдар немесе иондар қанша электрон беріп не қосып алатын санмен көрсетіп жазу.
Mn+7 +5ē = Mn+2
Cl-1 -ē = Cl0
Мұнда, Cl атомдарының молекула түзетінің ескеру керек.
2Cl-1 -2ē = Cl20
Слайд 174. Электрондық теңдеудің қасына тік сызық сызып, оның сыртына электрондардың алдында
Mn+7 +5e = Mn+2 2 ТТШ
2Cl-1 -2ē = Cl20 5 ТСШ
осы коэффициенттерді формуладағы атомдардың алдына жазу.
2KMnO4 +10HCl → KCl +2MnCl2 +5Cl2+H2O
5. Атомдар санын санап, коэффициенттерді койып, бағдаршаны теңдік белгісіне ауыстыру.
2KMnO4+16HCl = 2KCl+2MnCl2+5Cl2+8H2O
Слайд 18ТТР-ның маңызы:
ТТР өндірісте, тұрмыста жүзеге асып жататын процестер: газ пеште газдың
Сіріңке жақсақ, аспанға фейерверк атсақ – бәрі де тотығу тотықсыздану процестері. Ағартуға, дезинфекциялауға, сатек асқын тотығының, калий перманганатының, хлор немесе хлорлы ағартқыш ізбесттің тотығу қасиеттері қолданылады. Заттың бетін тазартуға сутегі асқын тотығы қолданылады. Ол, сонымен қатар, жібекті, жүнді ағарта алады. Ескі картиналарды қалпына келтіреді. Ағзаға зиянсыз болғандықтан тамақ өнеркәсібінде шоколадты, сосиска дайындайтын етті ағартуға қолданылады. Калий перманганатының дезинфекциялағыш қасиеті де тотықтырғыш қасиетіне негізделген. Хлорды күшті тотықтырғыш ретінде таза суды стерильдеуге және ағын суларды
залалсыздандыруға қолданады. Хлор көптеген бояуларды түссіздендіріп, ағартады. Сондықтан оны мата мен қағазды ағартуға қолданады. Табиғатта ТТР кеңінен таралған. Ол биохимиялық процестерде: тыныс алу, зат алмасу, жануарлар мен адамдардың жүйке қызметінде маңызды роль атқарады. ТТР нәтижесінде біздің ағзамыз тамақтан алатын энергияны жұмсау арқылы адамның іс-әрекеттері жүзеге асырылып жатады.
Слайд 19Мәтінмен жұмыс
Сұрақтар:
1. Химиялық реакция типін тап. Қажет жерлеріне коэффициенттер қойындар.
Hg + S→HgS
H2O + P2O5 → H3PO4
CuSO4 + NaOH → Na2SO4 + Cu(OH)2
Fe + HCl → FeCl2 + H2
Al(OH)3 → Al2O3 + H2O
2. Барлық жағдайларда тотығу дәрежесі өзгере ме?
3. Тотығу дәрежесінің өзгерісі реакция типіне байланысты ма?
4. Егер элемент қосылыста жоғары тотығу дәрежесін көрсетсе, онда тек тотықтырғыш болады.
5. Егер элемент қосылыста төмен тотығу дәрежесін көрсетсе, онда тек тотықсыздандырғыш болады
6. Егер элемент қосылыста аралық тотығу дәрежесін көрсетсе, онда тотықтырғыш та тотықсыздандыпғыш та болады.
Слайд 20Сабақты бекіту: “Кім тапқыр!”
І топ.
Cu + HNO3 = Cu(NO3)2 + NO + H2O
ІІ топ. Молекулаішілік ТТР
KClO3 = KCl + O2
ІІІ топ диспропорциялану реакциялары ТТР
HNO2 + HNO2 = HNO3+NO + H2O