- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Электронный образовательный ресурс для обучающихся 8 класса по химии Степень окисления
Содержание
- 1. Электронный образовательный ресурс для обучающихся 8 класса по химии Степень окисления
- 2. Задачи:Разобраться, что такое «степень окисления»;Научиться находить степень окисления по формуле.
- 3. Поваренная соль NaCl«Хлеб да соль» - пожелание
- 4. Влияние Na на организм человекаХранят простое вещество
- 5. Влияние Cl2 на организм человекаХлор – отравляющее вещество, применявшееся во время первой мировой войны
- 6. Образование сложного веществаNa0 +11 2е,8е,1е Cl0
- 7. Ковалентная полярная связьЗа счет чего дополняется внешний
- 8. Ковалентная неполярная связьМожно ли в простых веществах отнести общие пары к какому-то атому?
- 9. Сравним соединения:H - Cl Cl - Cl
- 10. Степень окисления – это условный заряд атомов
- 11. Правила определения с.о.С.о. атомов в простых веществах
- 12. Возможные с.о.Положительная «+» равна числу отданных электронов.
- 13. Промежуточные с.о.Рассмотрим возможные с.о. серы – SМаксимальная
- 14. Определение с.о.N2O3На первом месте стоит элемент с
- 15. Задание 1:Определите С.О. по формуламCl2O7, NaH, Na2S, MgO, H3N, N2, Al2S3, Cu2O
- 16. Домашнее задание:Стандартный минимум:Прочитать §20, выполнить упр. 2,4 стр.68.Творческое задание:Составить кроссворд с ключевым словом ОКСИДЫ.
Задачи:Разобраться, что такое «степень окисления»;Научиться находить степень окисления по формуле.
Слайд 2Задачи:
Разобраться, что такое «степень окисления»;
Научиться находить степень окисления по формуле.
Слайд 3Поваренная соль NaCl
«Хлеб да соль» - пожелание добра
«Надо вместе съесть
пуд соли, чтобы узнать человека»
За какое время это можно сделать?
Пуд – 16 кг
3,5 – 5,5 кг в год
Примерно 2 года
За какое время это можно сделать?
Пуд – 16 кг
3,5 – 5,5 кг в год
Примерно 2 года
Слайд 4Влияние Na на организм человека
Хранят простое вещество «натрий» как Кощееву смерть.
Как
может повлиять натрий на организм человека?
Слайд 5Влияние Cl2 на организм человека
Хлор – отравляющее вещество, применявшееся во время
первой мировой войны
Слайд 6Образование сложного вещества
Na0 +11 2е,8е,1е
Cl0 +17 2e,8e,7e
Какой вид связи
может образоваться между этими атомами?
Na0 + Cl0 → Na+ + Cl- → Na+Cl-
Na0 + Cl0 → Na+ + Cl- → Na+Cl-
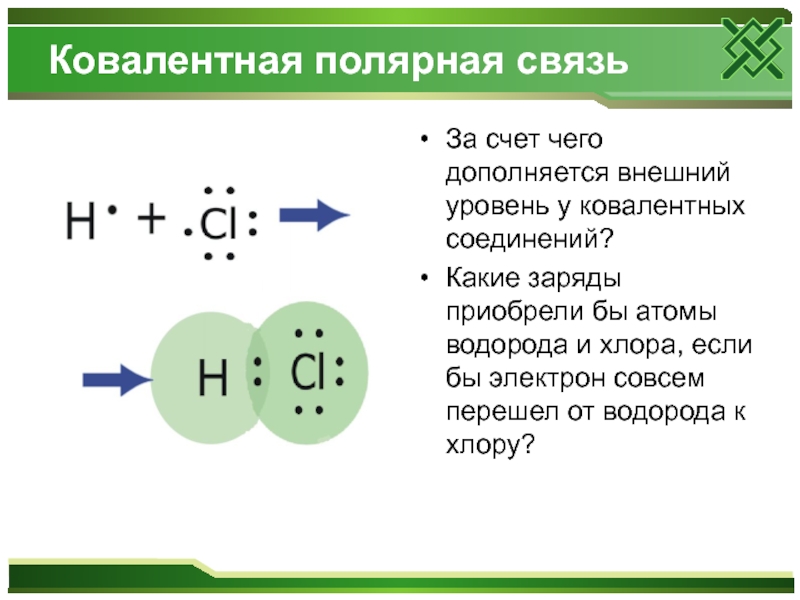
Слайд 7Ковалентная полярная связь
За счет чего дополняется внешний уровень у ковалентных соединений?
Какие заряды приобрели бы атомы водорода и хлора, если бы электрон совсем перешел от водорода к хлору?
Слайд 8Ковалентная неполярная связь
Можно ли в простых веществах отнести общие пары к
какому-то атому?
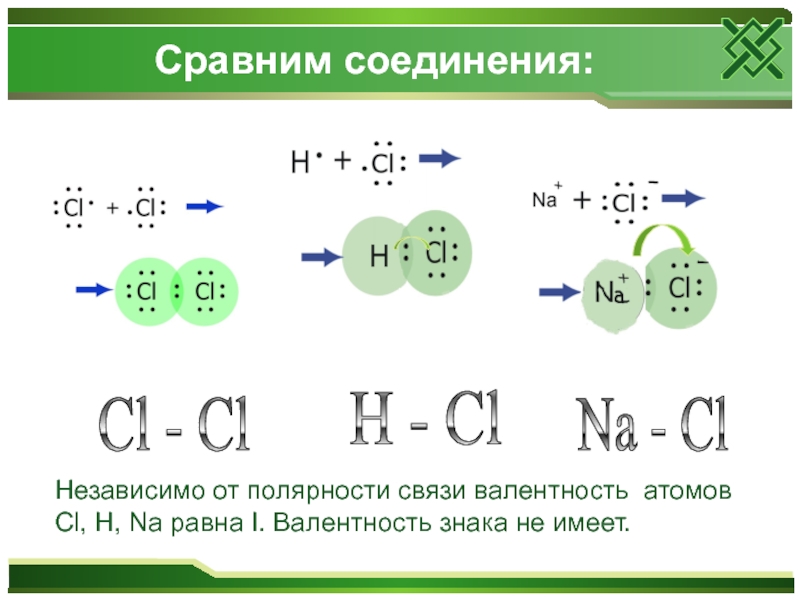
Слайд 9Сравним соединения:
H - Cl
Cl - Cl
Na - Cl
Независимо
от полярности связи валентность атомов Cl, H, Na равна I. Валентность знака не имеет.
Слайд 10Степень окисления –
это условный заряд атомов химических элементов в соединении,
вычисленный на основе предположения, что все соединения состоят из ионов.
Слайд 11Правила определения с.о.
С.о. атомов в простых веществах = 0
С.о. фтора =
-1
С.о. кислорода = -2 (кроме Н2О2-1, O+2F2)
С.о. водорода = +1 (кроме МеН-1)
С.о.Ме I, II, III групп = номеру группы
С.о неМе «+» = номеру группы
С.о. неМе «-» = 8 – номер группы
С.о. кислорода = -2 (кроме Н2О2-1, O+2F2)
С.о. водорода = +1 (кроме МеН-1)
С.о.Ме I, II, III групп = номеру группы
С.о неМе «+» = номеру группы
С.о. неМе «-» = 8 – номер группы
Слайд 12Возможные с.о.
Положительная «+» равна числу отданных электронов. Максимальная с.о. равна номеру
группы
Отрицательная «-» равна числу принятых электронов. Минимальная с.о. равна 8 – номер группы
Нулевое значение с.о. имеют атомы в молекулах с неполярной связью
Отрицательная «-» равна числу принятых электронов. Минимальная с.о. равна 8 – номер группы
Нулевое значение с.о. имеют атомы в молекулах с неполярной связью
Слайд 13Промежуточные с.о.
Рассмотрим возможные с.о. серы – S
Максимальная +6 SO3
Минимальная -2
H2S
Сера может проявлять с.о. 0,+2,+4 – это промежуточные с.о.
Сера может проявлять с.о. 0,+2,+4 – это промежуточные с.о.
Слайд 14Определение с.о.
N2O3
На первом месте стоит элемент с «+» с.о., на втором
с «-»
У кислорода постоянная с.о.=-2
У азота переменная с.о.
x -2
N2O3
Стр.67 прочитайте как найти x
У кислорода постоянная с.о.=-2
У азота переменная с.о.
x -2
N2O3
Стр.67 прочитайте как найти x
Слайд 16Домашнее задание:
Стандартный минимум:
Прочитать §20, выполнить упр. 2,4 стр.68.
Творческое задание:
Составить кроссворд с
ключевым словом ОКСИДЫ.