- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Амины и аминокислоты. Материалы для небольшого класса
Содержание
- 1. Амины и аминокислоты. Материалы для небольшого класса
- 2. Амины.Амины- производные аммиака ( NH3), в молекуле
- 3. Амины. Классификация.CH3 –NH2
- 4. Амины. Номенклатура первичных аминов.
- 5. Амины. Изомерия. Рассмотрим все виды изомерии на примере аминов с эмпирической формулой C4 H11N
- 6. Амины. Физические свойства.Низшие предельные первичные амины –
- 7. Амины. Химические свойства.1. Амины – органические основания.
- 8. Амины. Химические свойства.Амины образуют соли с органическими
- 9. Слайд 9
- 10. Слайд 10
- 11. Амины. Получение.1. взаимодействие спиртов с аммиаком при
- 12. Амины. Анилин.Анилин простейший представитель первичных ароматических аминов.
- 13. Анилин. Химические свойства.Основные свойства у анилина выражены
- 14. Анилин. Химические свойства.1. реакции с участием аминогруппы.Б)
- 15. Анилин. Химические свойства.2. Реакции с участием бензольного
- 16. Анилин. Получение. Анилин и другие первичные ароматические
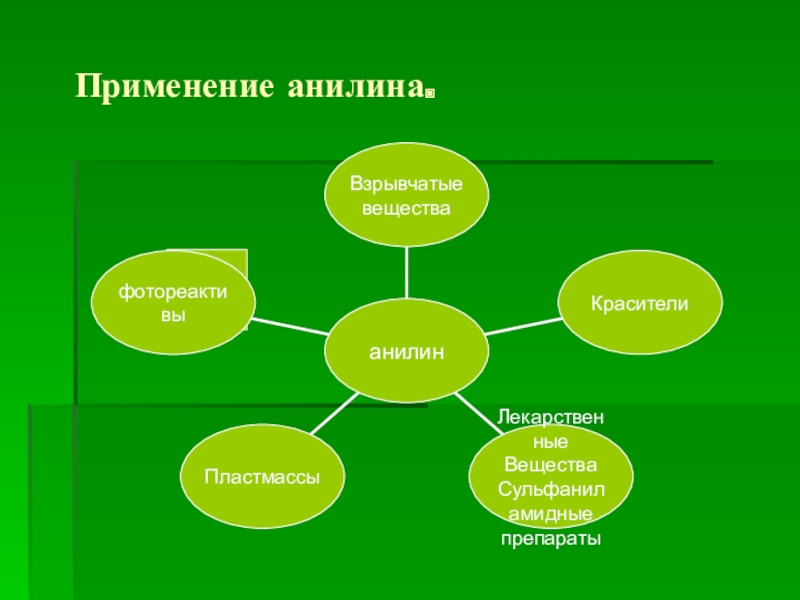
- 17. Применение анилина.
- 18. Литература.1. Учебное издание Габриэлян О.С. Химия 10
Амины.Амины- производные аммиака ( NH3), в молекуле которого один, два или три атома водорода заменены углеводородными радикалами. По числу углеводородных радикалов, замещающих атомы водорода в молекуле NH3, все амины можно разделить на три типа.
Слайд 2Амины.
Амины- производные аммиака ( NH3), в молекуле которого один, два или
три атома водорода заменены углеводородными радикалами.
По числу углеводородных радикалов, замещающих атомы водорода в молекуле NH3, все амины можно разделить на три типа.
По числу углеводородных радикалов, замещающих атомы водорода в молекуле NH3, все амины можно разделить на три типа.
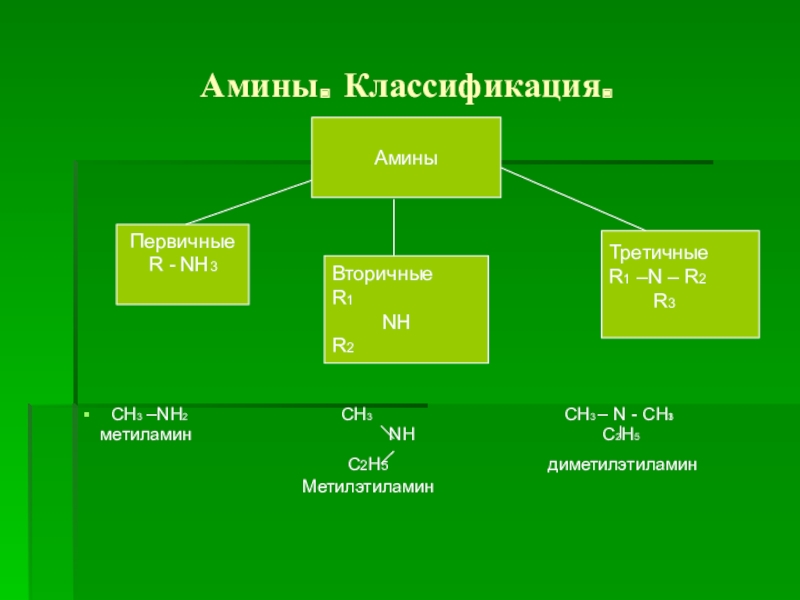
Слайд 3Амины. Классификация.
CH3 –NH2
CH3 CH3 – N - CH3
метиламин NH C2H5
C2H5 диметилэтиламин
Метилэтиламин
метиламин NH C2H5
C2H5 диметилэтиламин
Метилэтиламин
Амины
Первичные
R - NH3
Вторичные
R1
NH
R2
Третичные
R1 –N – R2
R3
Слайд 5Амины. Изомерия. Рассмотрим все виды изомерии на примере аминов с эмпирической формулой
C4 H11N
Слайд 6Амины. Физические свойства.
Низшие предельные первичные амины – газообразные вещества, имеют запах
аммиака, хорошо растворяются в воде.
Метиламин CH3 –NH2 - бесцветный газ с резким аммиачным запахом, хорошо растворим в воде.
Анилин C6H5NH2 - бесцветная жидкость, быстро темнеющая на воздухе вследствие окисления, в воде малорастворим, имеет неприятный запах и очень ядовит.
Амины с большей относительной молекулярной массой – жидкости или твердые вещества, растворимость их в воде с увеличением молекулярной массы уменьшается.
Метиламин CH3 –NH2 - бесцветный газ с резким аммиачным запахом, хорошо растворим в воде.
Анилин C6H5NH2 - бесцветная жидкость, быстро темнеющая на воздухе вследствие окисления, в воде малорастворим, имеет неприятный запах и очень ядовит.
Амины с большей относительной молекулярной массой – жидкости или твердые вещества, растворимость их в воде с увеличением молекулярной массы уменьшается.
Слайд 7Амины. Химические свойства.
1. Амины – органические основания. Благодаря наличию неподеленной электронной
пары у атома азота амины проявляют основные свойства.
При растворении в воде они, подобно аммиаку, частично с ней взаимодействуют с образованием оснований – гидратов:
CH3 NH2 + H2O CH3 NH2 H2O
гидрат метиламина
Гидраты аминов частично диссоциируют, их водные растворы имеют слабо щелочную реакцию и изменяют окраску индикаторов:
CH3 NH2 H2O CH3 NH3 + ОН
При растворении в воде они, подобно аммиаку, частично с ней взаимодействуют с образованием оснований – гидратов:
CH3 NH2 + H2O CH3 NH2 H2O
гидрат метиламина
Гидраты аминов частично диссоциируют, их водные растворы имеют слабо щелочную реакцию и изменяют окраску индикаторов:
CH3 NH2 H2O CH3 NH3 + ОН
Слайд 8Амины. Химические свойства.
Амины образуют соли с органическими и неорганическими кислотами:
(
CH3 )2 NH + HCL ( CH3 )2 NH 2 CL
хлорид диметиламония
Основность аминов определяется главным образом числом и природой заместителей при атоме азота. Поскольку алкильные радикалы обладают положительным индуктивным эффектом , они увеличивают электронную плотность на атоме азота, основные свойства аминов возрастают. Метиламин более сильное основание, чем аммиак, а диметиламин еще более сильное, чем метиламин. В анилине неподеленная электронная пара азота вовлечена в ароматическое сопряжение бензольного кольца, поэтому основность анилина значительно ниже, чем у аммиака:
C6H5NH2 < NH3 < CH3NH2 < (CH3) 2 NH
хлорид диметиламония
Основность аминов определяется главным образом числом и природой заместителей при атоме азота. Поскольку алкильные радикалы обладают положительным индуктивным эффектом , они увеличивают электронную плотность на атоме азота, основные свойства аминов возрастают. Метиламин более сильное основание, чем аммиак, а диметиламин еще более сильное, чем метиламин. В анилине неподеленная электронная пара азота вовлечена в ароматическое сопряжение бензольного кольца, поэтому основность анилина значительно ниже, чем у аммиака:
C6H5NH2 < NH3 < CH3NH2 < (CH3) 2 NH
Слайд 9 Амины. Химические свойства.
Щелочи, как
более сильные основания, вытесняют амины и аммиак из их солей:
NH4CL + NaOH = NH3 + NaCL + H2O
[CH4NH3] CL+ NaOH = CH3NH2 + NaCL +H2O
2. Алкилирование.
Взаимодействие аминов с галогеналканами позволяет получить вторичные и третичные амины из первичных. Выделяющийся галагеноводород связывают избытком амина или другими основаниями.
+ C2H2CL + C2H2CL
С6Н5NH2 C6H5NHC2H5 C6H5N(C2H5) 2
- HCL - HCL
Анилин N -этиланилин N,N - диэтиланилин
NH4CL + NaOH = NH3 + NaCL + H2O
[CH4NH3] CL+ NaOH = CH3NH2 + NaCL +H2O
2. Алкилирование.
Взаимодействие аминов с галогеналканами позволяет получить вторичные и третичные амины из первичных. Выделяющийся галагеноводород связывают избытком амина или другими основаниями.
+ C2H2CL + C2H2CL
С6Н5NH2 C6H5NHC2H5 C6H5N(C2H5) 2
- HCL - HCL
Анилин N -этиланилин N,N - диэтиланилин
Слайд 10 Амины. Химические свойства.
3.Горение.
Газообразные алифатические амины горят, прочие окисляются кислородом при нагревании. В качестве продуктов горения образуются углекислый газ, азот и водяной пар:
4CH3NH2 + 9 O2 4CO2 + 2N2 + 10H2O
4CH3NH2 + 9 O2 4CO2 + 2N2 + 10H2O
Слайд 11Амины. Получение.
1. взаимодействие спиртов с аммиаком при нагревании в присутствии AL2O3
в качестве катализатора. Реакции идут при пропускании смеси паров спирта с аммиаком при температуре 300 градусов Цельсия над оксидом алюминия.
AL2O3, t
C2H5[OH+H]NH2 C2H5NH2 + H2O
2. Взаимодействие алкилгалогенидов (галогеналканов) с аммиаком.
CH3Br +2 NH3 CH3NH2 + NH4Br
Бромметан Метилбромид
Образовавшийся первичный амин может вступать в реакцию с избытком алкилгалогенида и аммиака, в результате образуется вторичный амин. Аналогично могут быть получены третичные амины.
AL2O3, t
C2H5[OH+H]NH2 C2H5NH2 + H2O
2. Взаимодействие алкилгалогенидов (галогеналканов) с аммиаком.
CH3Br +2 NH3 CH3NH2 + NH4Br
Бромметан Метилбромид
Образовавшийся первичный амин может вступать в реакцию с избытком алкилгалогенида и аммиака, в результате образуется вторичный амин. Аналогично могут быть получены третичные амины.
Слайд 12Амины. Анилин.
Анилин простейший представитель первичных ароматических аминов. NH2
Аминобензол(
по заместительной
номенклатуре)
Фениламин ( по радикально-функциональной)
Физические свойства.
Анилин – бесцветная маслянистая жидкость с характерным запахом, малорастворим в воде, ядовит.
номенклатуре)
Фениламин ( по радикально-функциональной)
Физические свойства.
Анилин – бесцветная маслянистая жидкость с характерным запахом, малорастворим в воде, ядовит.
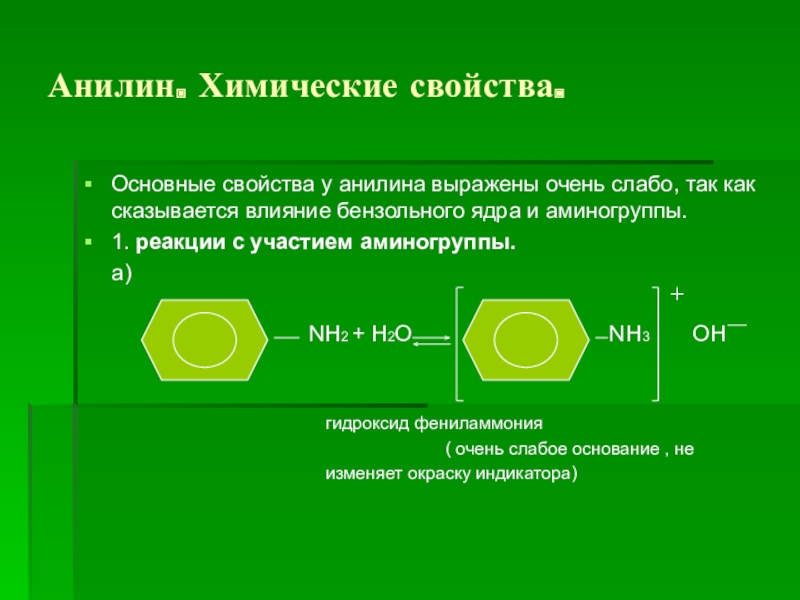
Слайд 13Анилин. Химические свойства.
Основные свойства у анилина выражены очень слабо, так как
сказывается влияние бензольного ядра и аминогруппы.
1. реакции с участием аминогруппы.
а)
NH2 + H2O NH3 OH
гидроксид фениламмония
( очень слабое основание , не
изменяет окраску индикатора)
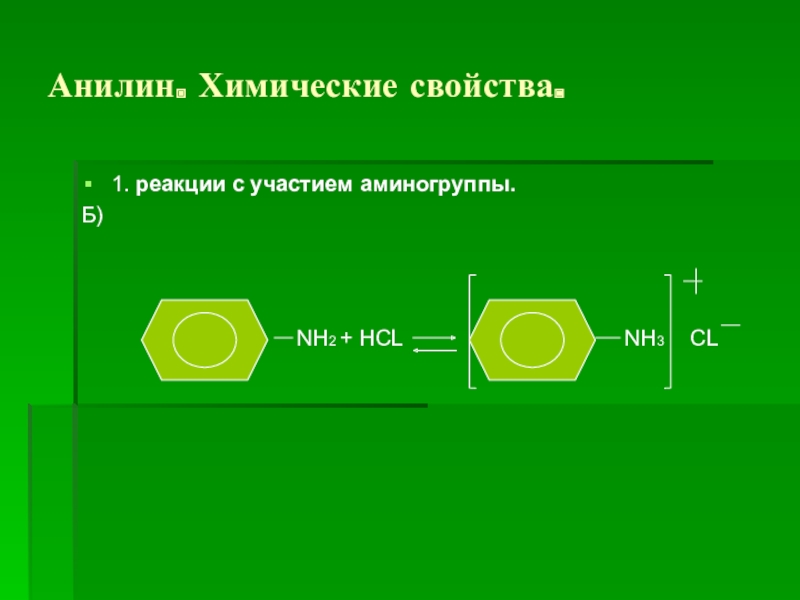
1. реакции с участием аминогруппы.
а)
NH2 + H2O NH3 OH
гидроксид фениламмония
( очень слабое основание , не
изменяет окраску индикатора)
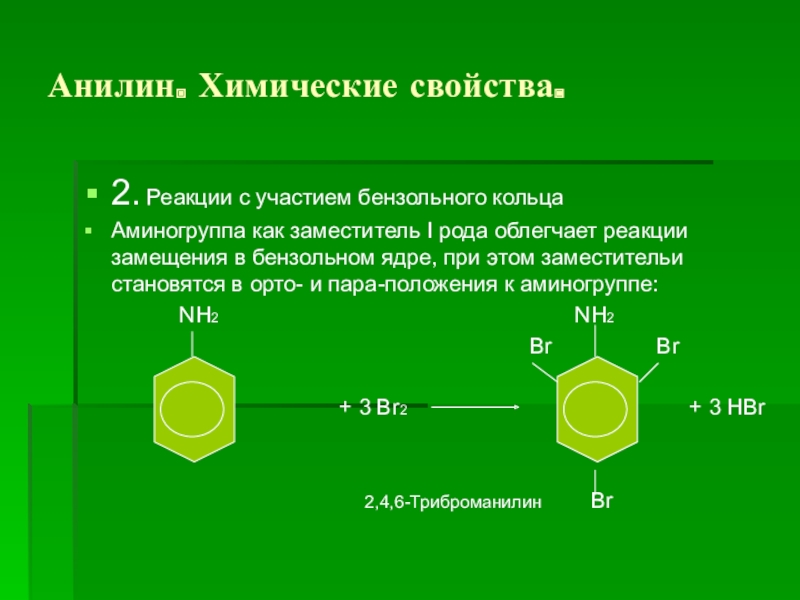
Слайд 15Анилин. Химические свойства.
2. Реакции с участием бензольного кольца
Аминогруппа как заместитель I
рода облегчает реакции замещения в бензольном ядре, при этом заместительи становятся в орто- и пара-положения к аминогруппе:
NH2 NH2
Br Br
+ 3 Br2 + 3 HBr
2,4,6-Триброманилин Br
NH2 NH2
Br Br
+ 3 Br2 + 3 HBr
2,4,6-Триброманилин Br
Слайд 16 Анилин. Получение.
Анилин и другие первичные ароматические амины получают с помощью
реакции, открытой в 1824 году русским химиком Н.Н. Зининым.
Реакция Зинина – это метод получения ароматических аминов, в том числе анилина, восстановлением нитросоединений:
NO2 +6 H NH2 + 2 H2O
Нитробензол Анилин
Реакция Зинина – это метод получения ароматических аминов, в том числе анилина, восстановлением нитросоединений:
NO2 +6 H NH2 + 2 H2O
Нитробензол Анилин
Слайд 18Литература.
1. Учебное издание Габриэлян О.С. Химия 10 класс Базовый уровень ,
Дрофа 2007 год;
2. Габриэлян О.С. Химия . Материалы для подготовки к единому госэкзамену и вступительным экзаменам в ВУЗы, Дрофа 2008 год,
3. Репетитор по химии под редакцией А.С. Егорова Феникс , 2009 год
2. Габриэлян О.С. Химия . Материалы для подготовки к единому госэкзамену и вступительным экзаменам в ВУЗы, Дрофа 2008 год,
3. Репетитор по химии под редакцией А.С. Егорова Феникс , 2009 год