- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему 39 Урок по химии по теме: Соли
Содержание
- 1. 39 Урок по химии по теме: Соли
- 2. ПовторимСоли – это сложные вещества, состоящие из
- 3. Повторим С точки зрения теории электролитической
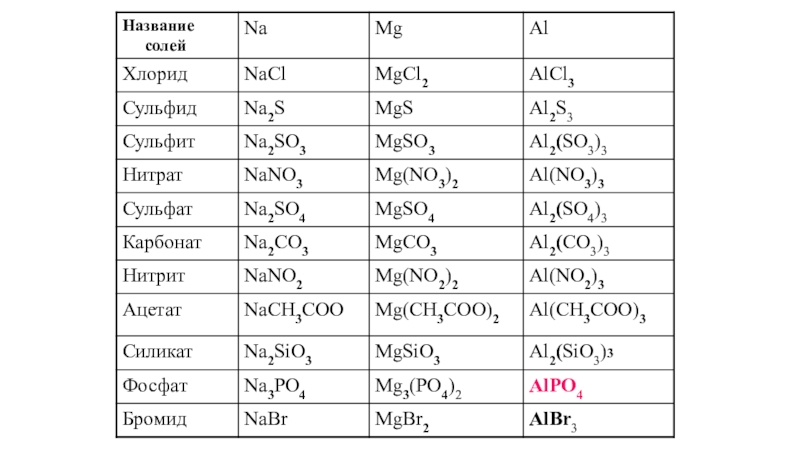
- 4. Названия солейNa2S – сульфид натрия Na2SO3 –
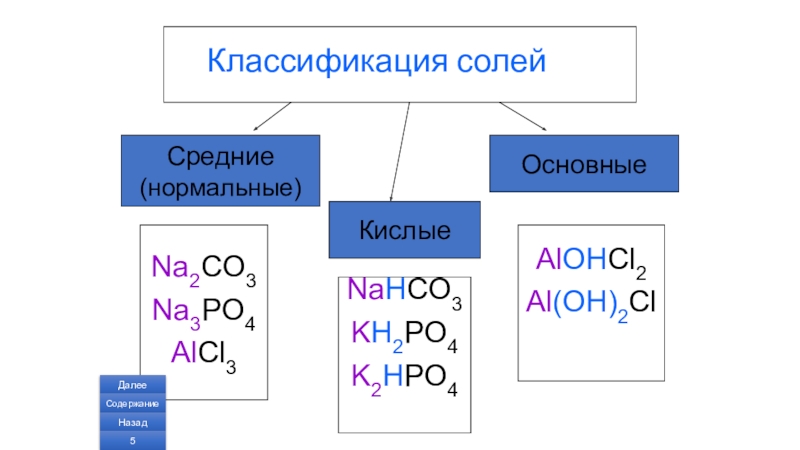
- 5. Классификация солей Средние (нормальные)ОсновныеNa2CO3Na3PO4AlCl3КислыеNaHCO3KH2PO4K2HPO4AlOHCl2Al(OH)2ClДалееСодержаниеНазад
- 6. Составление формул кислых солейН2СО3
- 7. Составление формул
- 8. Составление формул
- 9. Слайд 9
- 10. Слайд 10
- 11. Химические свойства солейa) H2SO4 + BaCl2 →
- 12. Химические свойства солейa) H2SO4 + BaCl2 →
- 13. Классификация солей Средние (нормальные)ОсновныеNa2CO3Na3PO4AlCl3КислыеNaHCO3KH2PO4K2HPO4AlOHCl2Al(OH)2ClДалееСодержаниеНазад
- 14. Химические свойства солей
- 15. Химические свойства солейa) H2SO4 + BaCl2 →
- 16. Химические свойства солей
- 17. Взаимодействие металлов с солями Сu
- 18. Химические свойства солей +
Слайд 2Повторим
Соли – это сложные вещества, состоящие из атомов металла и кислотных
Примеры солей: NaCl, AlCl3, Na2SO4, CaCO3, Ca3(PO4)2
Далее
Содержание
Назад
Слайд 3Повторим
С точки зрения
теории электролитической диссоциации…
Соли – это электролиты, диссоциирующие на
Уравнения диссоциации солей:
NaCl Na+ + Cl-
AlCl3 Al3+ + 3Cl-
Na2SO4 2Na+ + SO42-
Далее
Содержание
Назад
Слайд 4Названия солей
Na2S – сульфид натрия
Na2SO3 – сульфит натрия
Na2SО4 – сульфат
Fe(NO3)2 – нитрат железа (II)
Fe(NO3)3 – нитрат железа (III)
Далее
Содержание
Назад
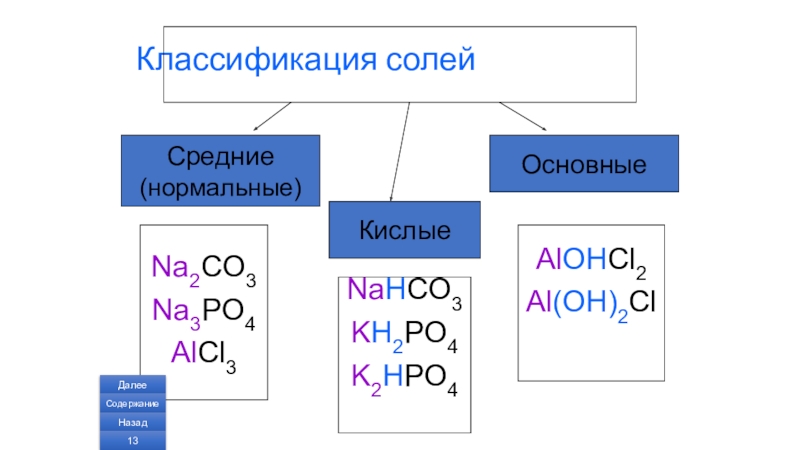
Слайд 5Классификация солей
Средние
(нормальные)
Основные
Na2CO3
Na3PO4
AlCl3
Кислые
NaHCO3
KH2PO4
K2HPO4
AlOHCl2
Al(OH)2Cl
Далее
Содержание
Назад
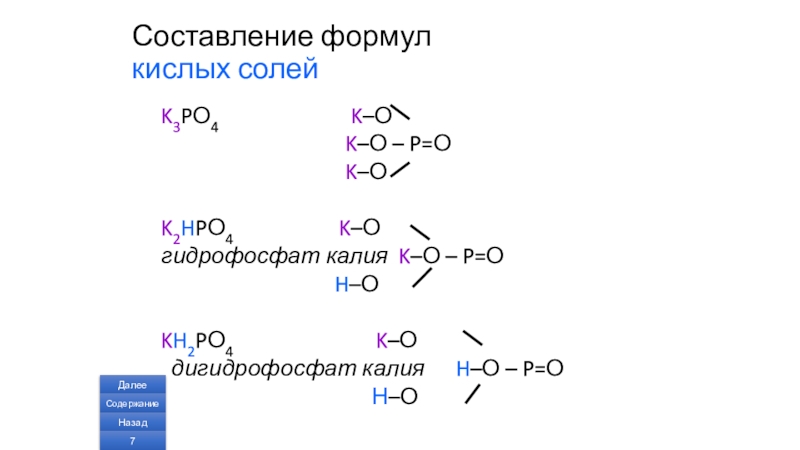
Слайд 6Составление формул кислых солей
Н2СО3
С=О
Н–О
Na2СО3 Na–О
С=О
Na–О
NaHСО3 Na–О
гидрокарбонат натрия С=О
Н–О
Далее
Содержание
Назад
Слайд 7Составление формул
K3PО4 K–О
K–О – P=О
K–О
K2HPО4 K–О
гидрофосфат калия K–О – P=О
H–О
KH2PО4 K–О
дигидрофосфат калия H–О – P=О
Н–О
Далее
Содержание
Назад
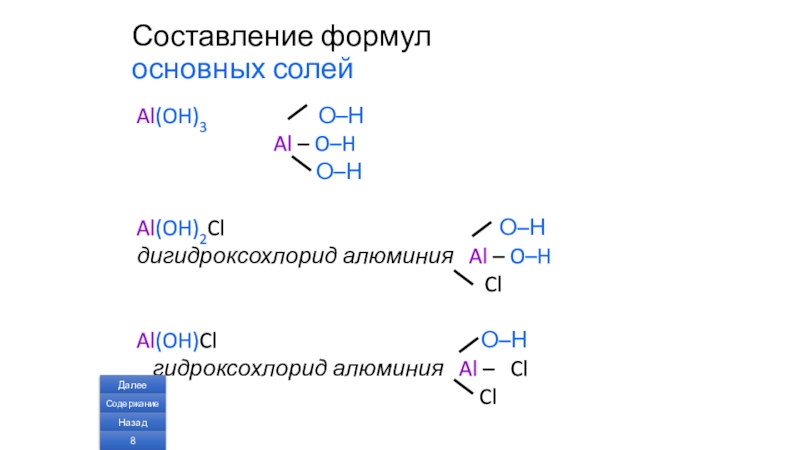
Слайд 8Составление формул
Al(OH)3 О–Н
Al – O–H
О–Н
Al(OH)2Cl О–Н
дигидроксохлорид алюминия Al – O–H
Cl
Al(OH)Cl О–Н
гидроксохлорид алюминия Al – Cl
Cl
Далее
Содержание
Назад
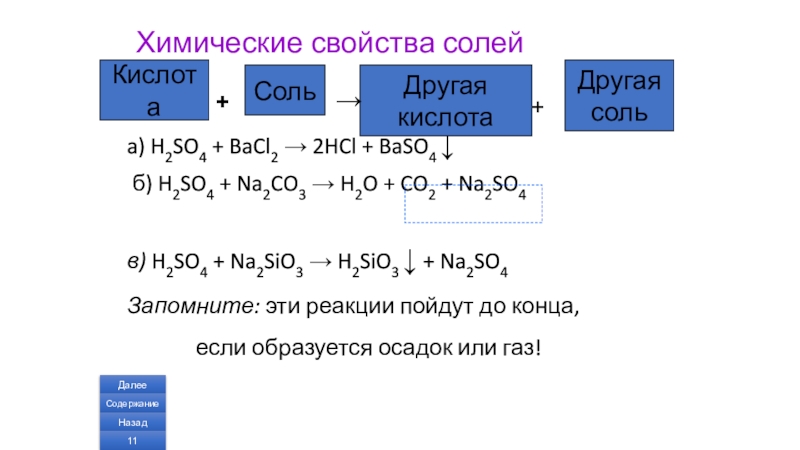
Слайд 11Химические свойства солей
a) H2SO4 + BaCl2 → 2HCl + BaSO4 ↓
в) H2SO4 + Na2SiO3 → H2SiO3 ↓ + Na2SO4
Запомните: эти реакции пойдут до конца,
если образуется осадок или газ!
Кислота
Соль
Другая
кислота
Другая
соль
Далее
Содержание
Назад
+
+
→
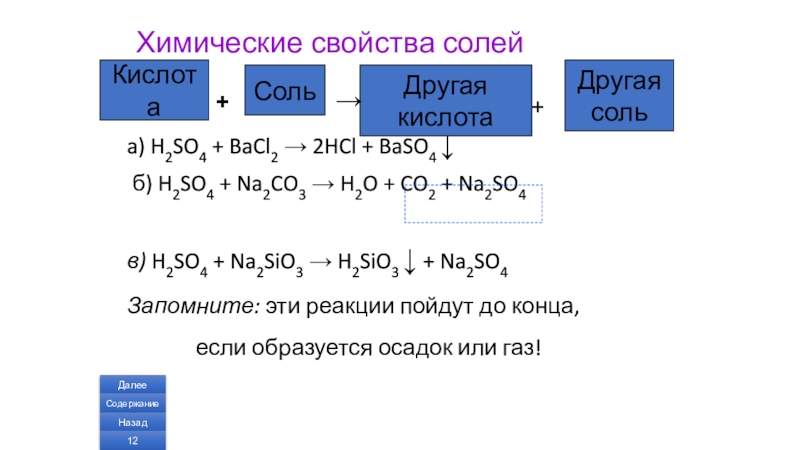
Слайд 12Химические свойства солей
a) H2SO4 + BaCl2 → 2HCl + BaSO4 ↓
в) H2SO4 + Na2SiO3 → H2SiO3 ↓ + Na2SO4
Запомните: эти реакции пойдут до конца,
если образуется осадок или газ!
Кислота
Соль
Другая
кислота
Другая
соль
Далее
Содержание
Назад
+
+
→
Слайд 13Классификация солей
Средние
(нормальные)
Основные
Na2CO3
Na3PO4
AlCl3
Кислые
NaHCO3
KH2PO4
K2HPO4
AlOHCl2
Al(OH)2Cl
Далее
Содержание
Назад
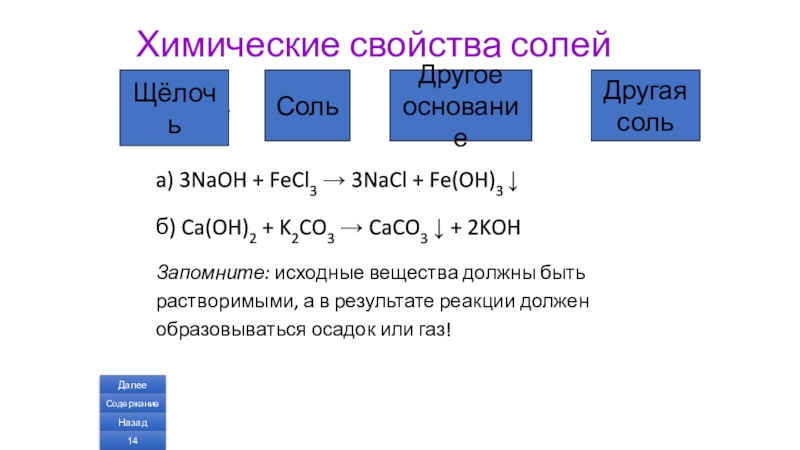
Слайд 14Химические свойства солей
+
a) 3NaOH + FeCl3 → 3NaCl + Fe(OH)3 ↓
б) Ca(OH)2 + K2CO3 → CaCO3 ↓ + 2KOH
Запомните: исходные вещества должны быть растворимыми, а в результате реакции должен образовываться осадок или газ!
Щёлочь
Соль
Другое
основание
Другая
соль
Далее
Содержание
Назад
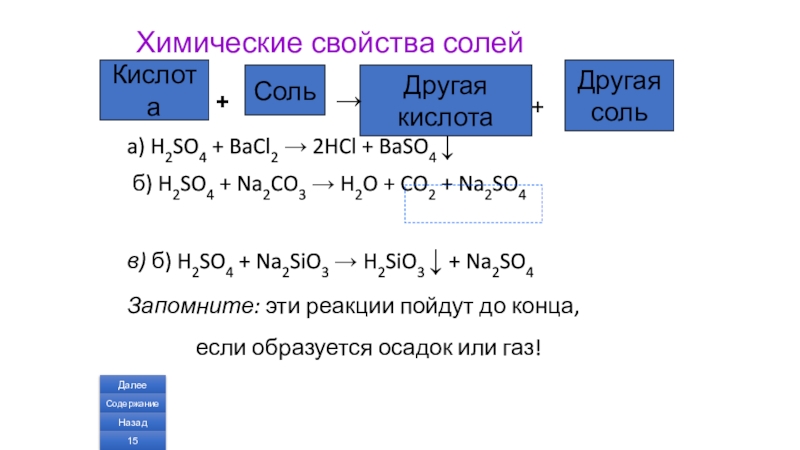
Слайд 15Химические свойства солей
a) H2SO4 + BaCl2 → 2HCl + BaSO4 ↓
в) б) H2SO4 + Na2SiO3 → H2SiO3 ↓ + Na2SO4
Запомните: эти реакции пойдут до конца,
если образуется осадок или газ!
Кислота
Соль
Другая
кислота
Другая
соль
Далее
Содержание
Назад
+
+
→
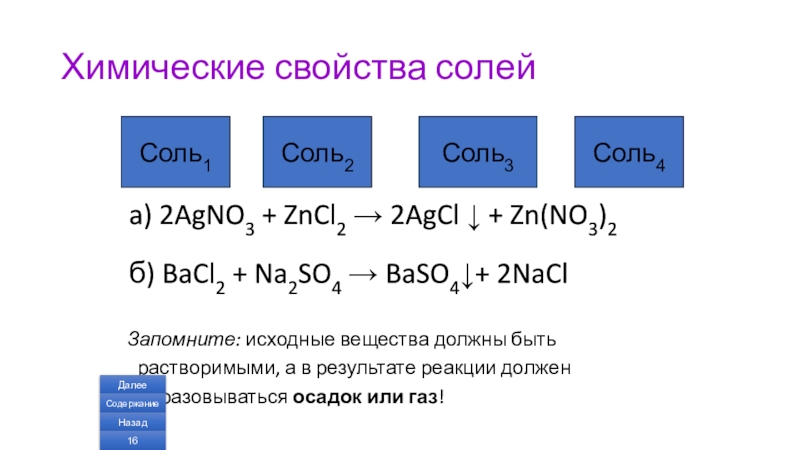
Слайд 16Химические свойства солей
+
a) 2AgNO3 + ZnCl2 → 2AgCl ↓ + Zn(NO3)2
б) BaCl2 + Na2SO4 → BaSO4↓+ 2NaCl
Запомните: исходные вещества должны быть растворимыми, а в результате реакции должен образовываться осадок или газ!
Соль1
Соль2
Соль3
Соль4
Далее
Содержание
Назад
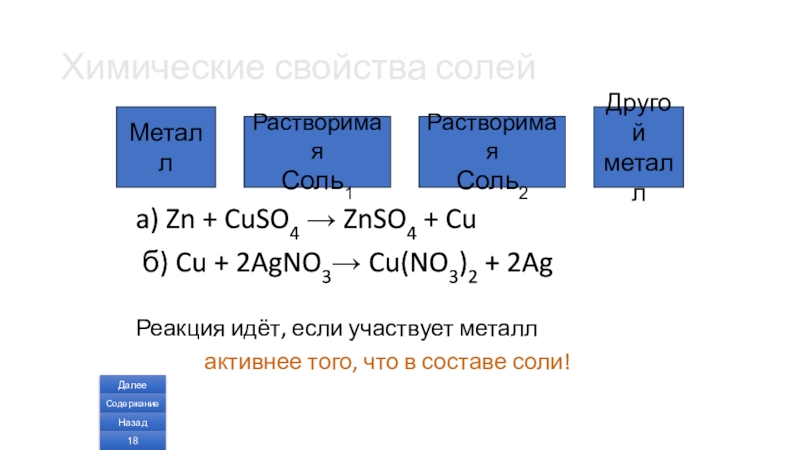
Слайд 18Химические свойства солей
+
a) Zn + CuSO4 → ZnSO4 + Cu
б) Cu + 2AgNO3→ Cu(NO3)2 + 2Ag
Реакция идёт, если участвует металл
активнее того, что в составе соли!
Металл
Растворимая
Соль1
Растворимая
Соль2
Другой
металл
Далее
Содержание
Назад