- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему 38 Урок по химии основания
Содержание
- 1. 38 Урок по химии основания
- 2. Понятие об основаниях.Основания с точки зрения ТЭД
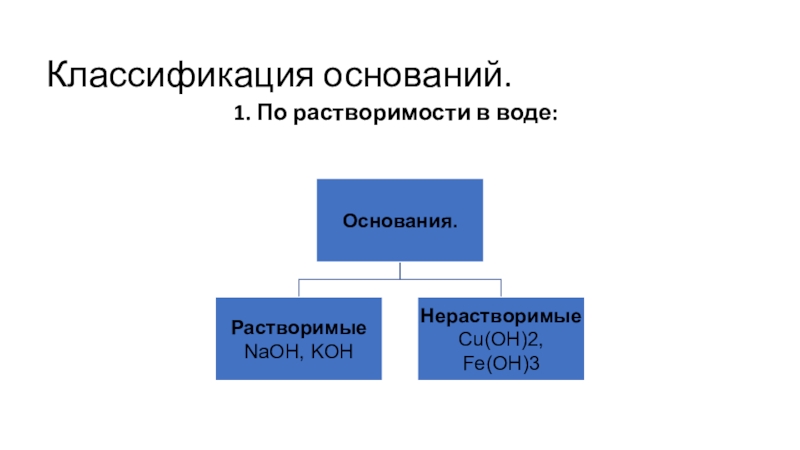
- 3. Классификация оснований.1. По растворимости в воде:
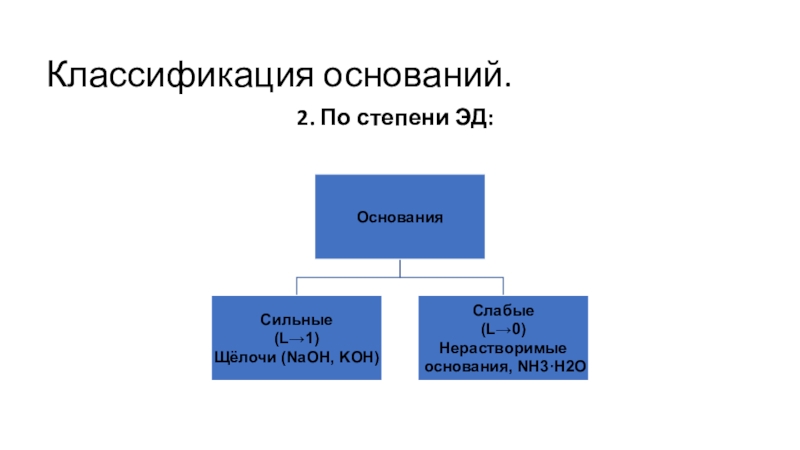
- 4. Классификация оснований.2. По степени ЭД:
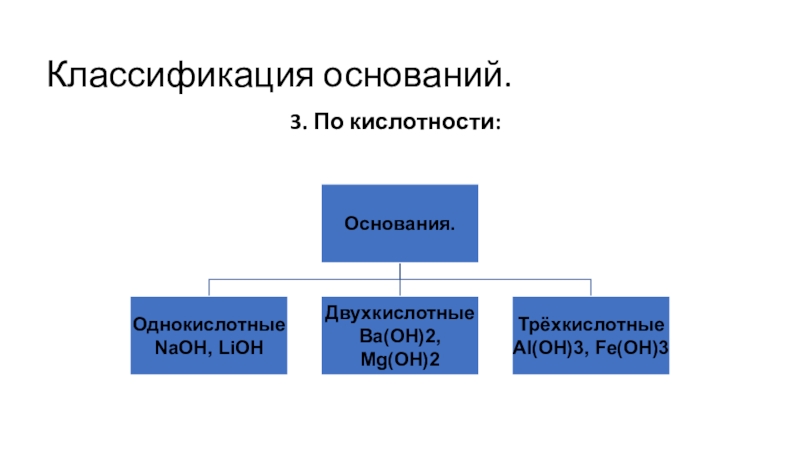
- 5. Классификация оснований.3. По кислотности:
- 6. Физические свойства.Все основания, кроме NH3·H2O – твёрдые
- 7. Химические свойства.1. Основание + кислота → соль
- 8. Химические свойства.2. Основание + кислотный оксид →
- 9. Химические свойства.3. Щёлочь + соль → новое
- 10. Химические свойства.4. Нерастворимое основание →
- 11. Особые свойства оснований.1. Качественная реакция на Са(ОН)2
- 12. Выполните задания.Дайте характеристику кремниевой кислоты по всем
- 13. Закрепление.1. Составьте молекулярные уравнения реакций:
- 14. Домашнее задание.§ 39, упр. 3, 5
Понятие об основаниях.Основания с точки зрения ТЭД – это электролиты, которые в водных растворах диссоциируют на катионы металла и гидроксид - анионы.NaOH ↔ Na+ + OH-Ba(OH)2 ↔ Ba+2 + 2OH-
Слайд 2Понятие об основаниях.
Основания с точки зрения ТЭД – это электролиты, которые
в водных растворах диссоциируют на катионы металла и гидроксид - анионы.
NaOH ↔ Na+ + OH-
Ba(OH)2 ↔ Ba+2 + 2OH-
NaOH ↔ Na+ + OH-
Ba(OH)2 ↔ Ba+2 + 2OH-
Слайд 6Физические свойства.
Все основания, кроме NH3·H2O – твёрдые вещества, имеющие различную окраску.
Мягкие на ощупь, изменяют окраску индикаторов.
Фенолфталеин (бесцв.) + щёлочь →
→ малиновая окраска
Лакмус (фиолет.) + щёлочь → синяя окраска
Метиловый оранжевый + щелочь→ желтый
Фенолфталеин (бесцв.) + щёлочь →
→ малиновая окраска
Лакмус (фиолет.) + щёлочь → синяя окраска
Метиловый оранжевый + щелочь→ желтый
Слайд 7Химические свойства.
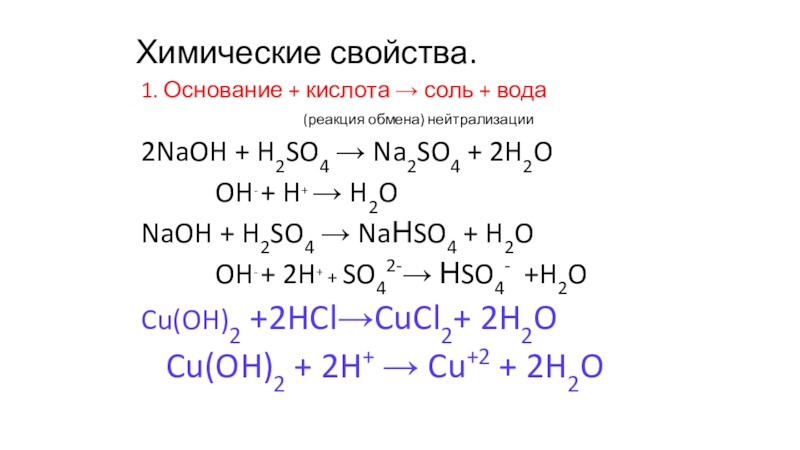
1. Основание + кислота → соль + вода
(реакция обмена) нейтрализации
2NaOH + H2SO4 → Na2SO4 + 2H2O
OH- + H+ → H2O
NaOH + H2SO4 → NaНSO4 + H2O
OH- + 2H+ + SO42-→ НSO4- +H2O
Cu(OH)2 +2HCl→CuCl2+ 2H2O
Cu(OH)2 + 2H+ → Cu+2 + 2H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
OH- + H+ → H2O
NaOH + H2SO4 → NaНSO4 + H2O
OH- + 2H+ + SO42-→ НSO4- +H2O
Cu(OH)2 +2HCl→CuCl2+ 2H2O
Cu(OH)2 + 2H+ → Cu+2 + 2H2O
Слайд 8Химические свойства.
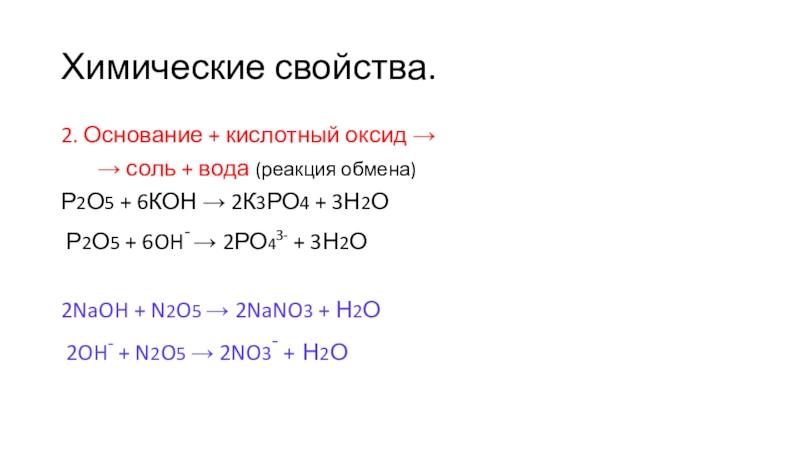
2. Основание + кислотный оксид →
→ соль + вода (реакция обмена)
Р2О5 + 6КОН → 2К3РО4 + 3Н2О
Р2О5 + 6OH- → 2РО43- + 3Н2О
2NaOH + N2O5 → 2NaNO3 + Н2О
2OH- + N2O5 → 2NO3- + Н2О
Р2О5 + 6КОН → 2К3РО4 + 3Н2О
Р2О5 + 6OH- → 2РО43- + 3Н2О
2NaOH + N2O5 → 2NaNO3 + Н2О
2OH- + N2O5 → 2NO3- + Н2О
Слайд 9Химические свойства.
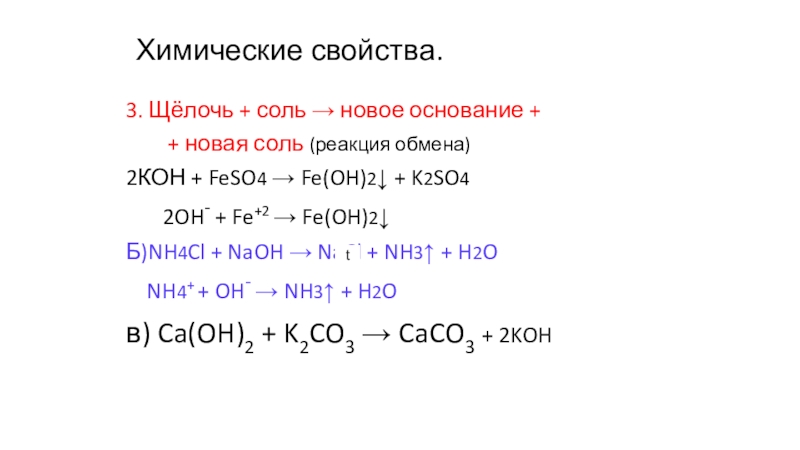
3. Щёлочь + соль → новое основание +
+ новая соль (реакция обмена)
2КОН + FeSO4 → Fe(OH)2↓ + K2SO4
2OH- + Fe+2 → Fe(OH)2↓
Б)NH4Cl + NaOH → NaCl + NH3↑ + H2O
NH4+ + OH- → NH3↑ + H2O
в) Ca(OH)2 + K2CO3 → CaCO3 + 2KOH
2КОН + FeSO4 → Fe(OH)2↓ + K2SO4
2OH- + Fe+2 → Fe(OH)2↓
Б)NH4Cl + NaOH → NaCl + NH3↑ + H2O
NH4+ + OH- → NH3↑ + H2O
в) Ca(OH)2 + K2CO3 → CaCO3 + 2KOH
t
Слайд 10Химические свойства.
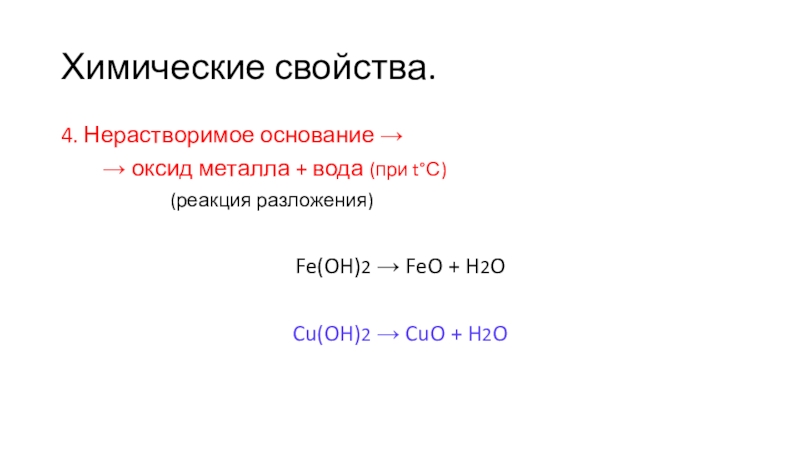
4. Нерастворимое основание →
→ оксид
металла + вода (при t°С)
(реакция разложения)
Fe(OH)2 → FeO + H2O
Cu(OH)2 → CuO + H2O
(реакция разложения)
Fe(OH)2 → FeO + H2O
Cu(OH)2 → CuO + H2O
Слайд 11Особые свойства оснований.
1. Качественная реакция на Са(ОН)2 – помутнение известковой воды:
Са(ОН)2 + СО2 → СаСО3↓ + Н2О
2. Качественные реакции на ион Ва+2:
SO42- + Ва+2 → BaSO4↓
2F- + Ва+2 → BaF2 ↓
2. Качественные реакции на ион Ва+2:
SO42- + Ва+2 → BaSO4↓
2F- + Ва+2 → BaF2 ↓
Слайд 12Выполните задания.
Дайте характеристику кремниевой кислоты по всем изученным признакам.
Напишите уравнения реакций:
Азотная
кислота + оксид кальция;
Соляная кислота + силикат натрия;
Фосфорная кислота + гидроксид калия;
Бромоводородная кислота + нитрат серебра;
Железо + соляная кислота.
Почему следующие реакции не идут?
Сульфат меди + соляная кислота;
Хлорид цинка + азотная кислота.
Соляная кислота + силикат натрия;
Фосфорная кислота + гидроксид калия;
Бромоводородная кислота + нитрат серебра;
Железо + соляная кислота.
Почему следующие реакции не идут?
Сульфат меди + соляная кислота;
Хлорид цинка + азотная кислота.
Слайд 13Закрепление.
1. Составьте молекулярные уравнения реакций:
Аl+3 + 3OH- →
Al(OH)3↓
2. Напишите уравнения реакций, характеризующие химические свойства гидроксида калия.
2. Напишите уравнения реакций, характеризующие химические свойства гидроксида калия.