- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему 17. Урок по теме Железо
Содержание
- 1. 17. Урок по теме Железо
- 2. Железо-никелевые метеориты
- 3. Железо составляет большую часть земного ядра.
- 4. Слайд 4
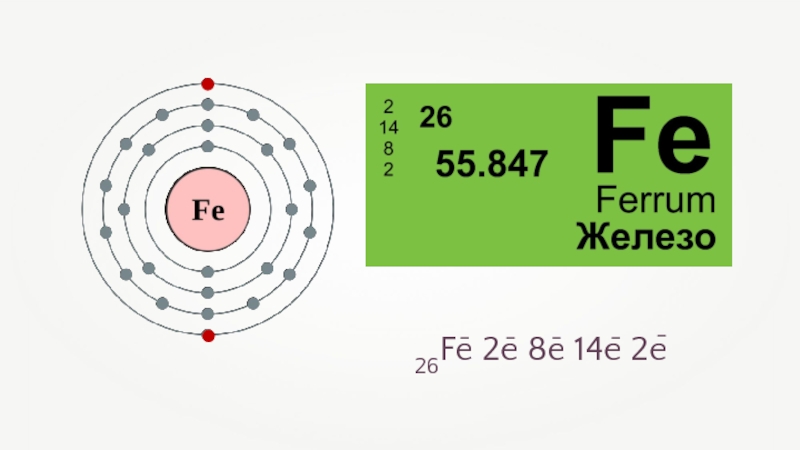
- 5. Fe
- 6. Слайд 6
- 7. Железо — это простое вещество, металл, серебристо-белого
- 8. Слайд 8
- 9. 26Fe 2e 8e 14e 2e–––––
- 10. Опты №13Fe + 2O2 = Fe3O4 + Q
- 11. При взаимодействии железа с галогенами (кроме йода) оно образует галогениды. 2Fe + 3Cl2 = 2FeCl3
- 12. При нагревании смеси железных опилок и порошка серы образуется сульфид железа (II).Fe + S = FeS
- 13. Li, K, Ba, Ca, Na, Mg, Al,
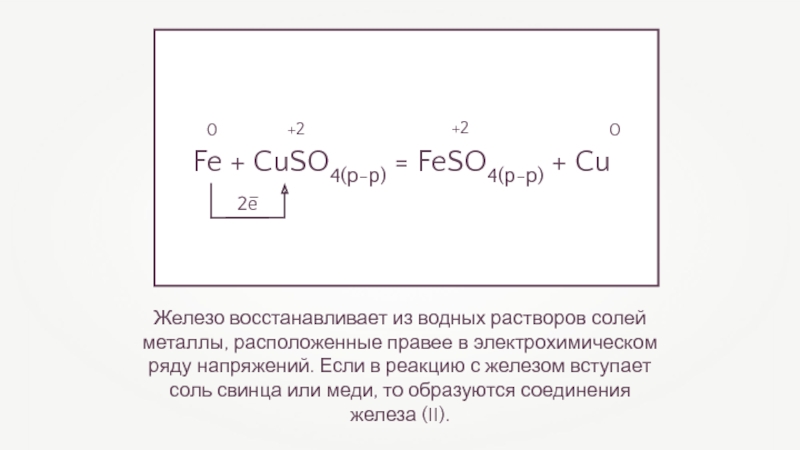
- 14. Железо восстанавливает из водных растворов солей металлы,
- 15. При восстановлении железом еще менее активных металлов,
- 16. Свойства оксидовОксид железа(II) FeO обладает основными свойствами,
- 17. Свойства оксидовГидроксид железа(III) Fe(OH)3 проявляет слабо амфотерные
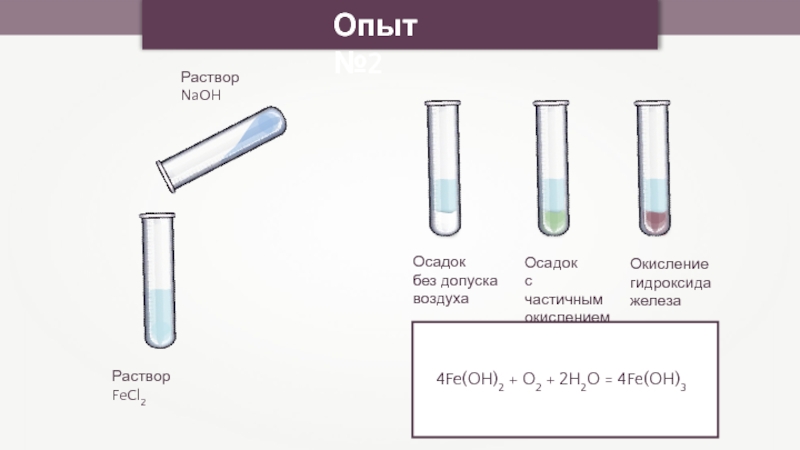
- 18. Раствор FeCl2Раствор NaOHОсадок без допуска воздухаОпыт №2Осадок с частичнымокислениемОкисление гидроксида железа4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
- 19. ЖелезоAlchemist-hp
- 20. Железо в промышленности Красный железнякКрасный железнякNorbert Kaiser
- 21. По запасу железных руд Россиязанимает первое место
- 22. Слайд 22
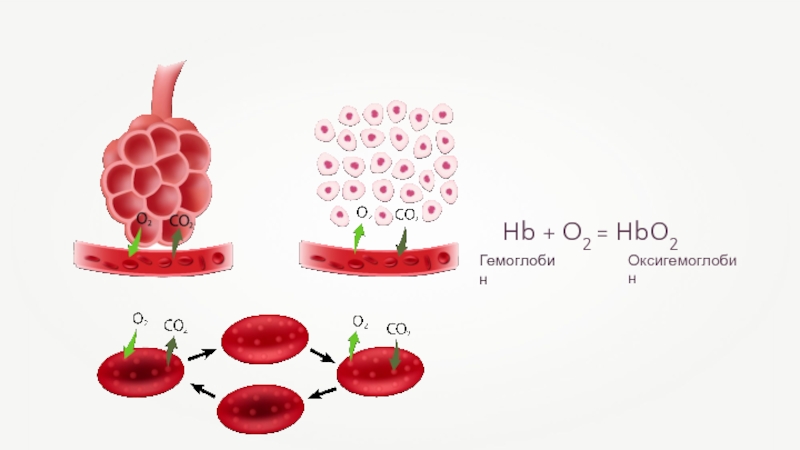
- 23. Hb + O2 = HbO2ОксигемоглобинГемоглобин
- 24. Слайд 24
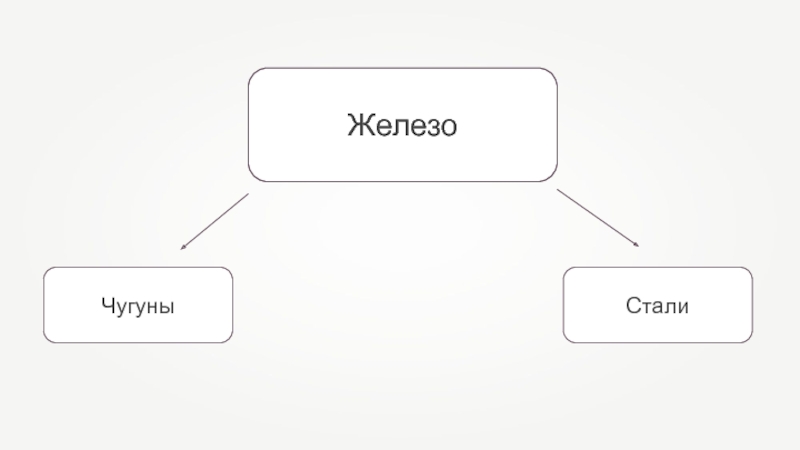
- 25. Железо
- 26. Железные сплавыЧугунСталь
- 27. В чугуне содержится углерода больше, чем железо
- 28. Особенность чугуна: при затвердевании он не сжимается,
- 29. Решётка Летнего Сада
- 30. Сталь
- 31. Свойства стали в закаленном состоянии зависят от
- 32. Слайд 32
- 33. Легированная сталь
- 34. Слайд 34
- 35. Быстрорежущая сталь
- 36. Нержавеющая сталь
- 37. Нержавеющие стали широко применяют в химической, машиностроительной,
- 38. Арки станции метро «Маяковская» московского метрополитенаEugeny1988
- 39. Содержание железа у взрослого человека: 2–5 г. Содержание железа у взрослого человека: 300–400 мг.
- 40. Слайд 40
- 41. Hb + O2 = HbO2ОксигемоглобинГемоглобин
- 42. Железо выполняет множество важнейших функций, основная из которых — поддержание постоянного уровня гемоглобина в крови.
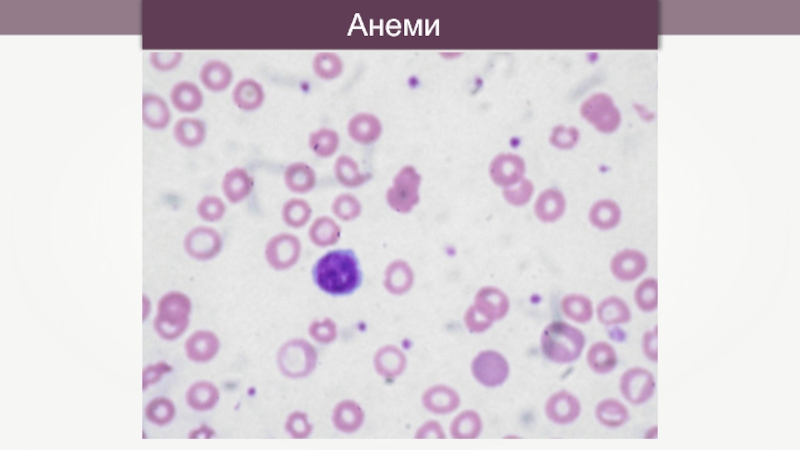
- 43. Анемия
- 44. Слайд 44
- 45. Слайд 45
- 46. Слайд 46
Слайд 7
Железо — это простое вещество, металл, серебристо-белого цвета; его плотность
7,87
Обладает хорошей пластичностью, легко куётся и прокатывается в тонкие листы или проволоку.
Alchemist-hp
Слайд 11
При взаимодействии железа с галогенами (кроме йода) оно образует галогениды.
2Fe
Слайд 12
При нагревании смеси железных опилок и порошка серы образуется сульфид железа
Fe + S = FeS
Слайд 13
Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe,
Железо растворяется в разбавленной серной и соляной кислотах, вытесняя из них водород и образуя соответствующую соль.
Fe + 2HCl = FeCl2 + H2↑
Слайд 14
Железо восстанавливает из водных растворов солей металлы, расположенные правее в электрохимическом
Fe + CuSO4(р-р) = FeSO4(р-р) + Cu
0
+2
+2
0
2e
–
Слайд 15
При восстановлении железом еще менее активных металлов, например, серебра из соли
3AgNO3 + Fe = Fe(NO3)3 + 3Ag
+1
0
+1
0
Слайд 16
Свойства оксидов
Оксид железа(II) FeO обладает основными свойствами, ему отвечает основание Fe(OH)2.
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
Слайд 17
Свойства оксидов
Гидроксид железа(III) Fe(OH)3 проявляет слабо амфотерные свойства, он способен реагировать
Fe(OH)3 + 3КОН → K3[Fe(OH)6]
Слайд 18
Раствор FeCl2
Раствор NaOH
Осадок
без допуска
воздуха
Опыт №2
Осадок
с частичным
окислением
Окисление
гидроксида
железа
4Fe(OH)2 +
Слайд 21
По запасу железных руд Россия
занимает первое место в мире.
Они залегают
в Курской области.
Слайд 27
В чугуне содержится углерода больше, чем железо может удержать его при
в виде пластинчатых кристаллов графита.
Слайд 28
Особенность чугуна: при затвердевании он не сжимается, как большинство металлов, а
Поэтому чугун можно использовать для изготовления деталей сложной конфигурации литьем.
Слайд 31
Свойства стали в закаленном состоянии зависят от массовой доли в ней
Слайд 37
Нержавеющие стали широко применяют в химической, машиностроительной, пищевой отраслях промышленности.
В
Слайд 39
Содержание железа
у взрослого человека: 2–5 г.
Содержание железа
у взрослого
Слайд 42
Железо выполняет множество важнейших функций, основная
из которых — поддержание постоянного
в крови.