свойствами.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему 11. Химические свойства металлов
Содержание
- 1. 11. Химические свойства металлов
- 2. Слайд 2
- 3. Металлический блеск
- 4. Высокие теплопроводность и электропроводность
- 5. Плотность и ковкость
- 6. Температура плавленияРтуть (Hg)Wilco Oelen
- 7. Температура плавленияЦезий (Cs)Галлий (Ga)29°C29,8°CAiyizoDnn87
- 8. Температура плавленияВольфрам (W)
- 9. ТвёрдостьAlchemist-hpХром (Cr)
- 10. ТвёрдостьКалий (K)Рубидий (Rb)Цезий (Cs)Dnn87Dnn87Dnn87
- 11. Физические свойства металлов заключаются в том, что
- 12. Химические свойства металлов обусловлены способностью их атомов
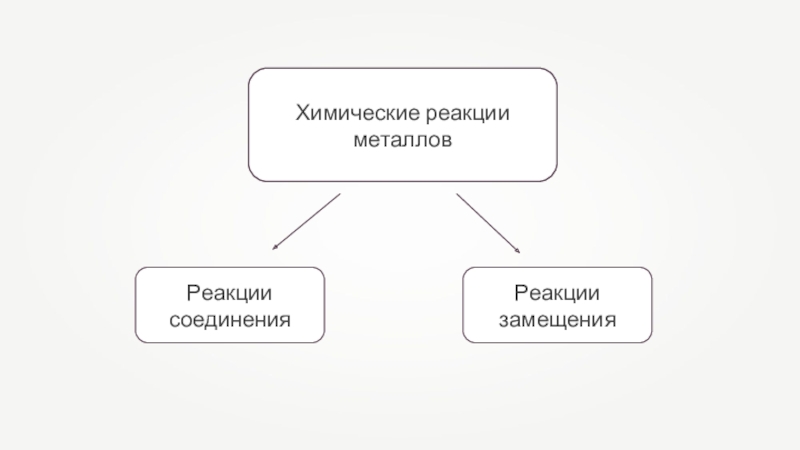
- 13. Химические реакции металлов
- 14. Реакции замещения — это такие реакции, в
- 15. Реакции соединения — это такие реакции, в
- 16. Me - ne → MeВ химических реакциях
- 17. Взаимодействие металлов с неметаллами2Mg + О2 = 2MgОt00+2-2
- 18. Слайд 18
- 19. Слайд 19
- 20. Взаимодействие металлов с неметаллами с образованием солей2Al + 3Br2 = 2AlBr300+3-1
- 21. Опыт взаимодействия алюминия с серой
- 22. Опыт взаимодействия алюминия с серой
- 23. Взаимодействие алюминия с серой2Al + 3S = Al2S300+3-2Окислитель
- 24. Взаимодействие металлов с разбавленными кислотамиЭлектрохимический ряд активности
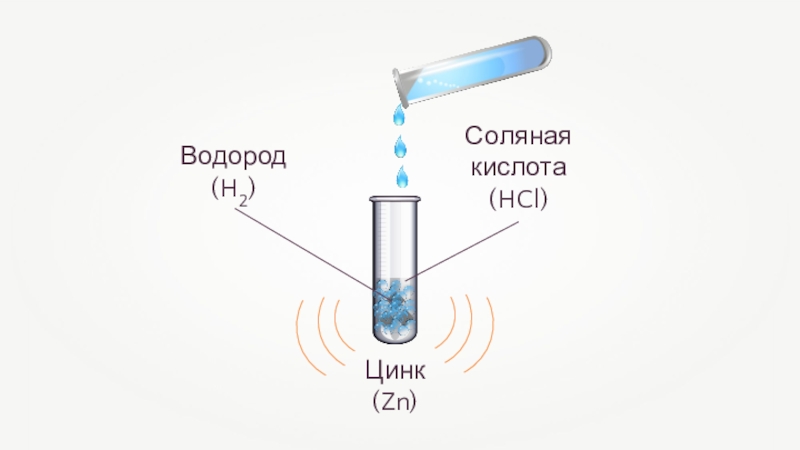
- 25. Взаимодействие цинка с соляной кислотойZn + 2HCl = ZnCl2 + H2↑+10+20Соляная кислота
- 26. Цинк(Zn)
- 27. Взаимодействие металлов с кислотамиЭлектрохимический ряд активности металловвзаимодействуют
- 28. Взаимодействие металла с водойЭлектрохимический ряд активности металловактивные металлы2Na + 2H2O → 2NaOH + H2↑+10+10ОкислительВосстановительне вытесняют водород
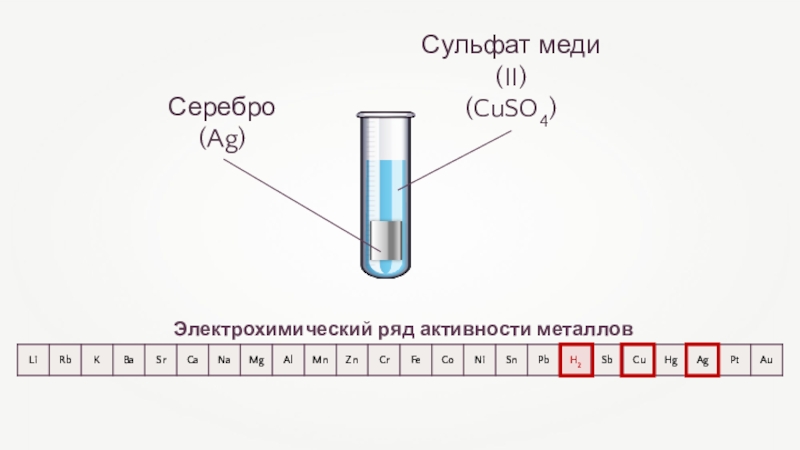
- 29. Взаимодействие металлов с растворами солейЭлектрохимический ряд активности металловвзаимодействуютс растворами солейCu + 2AgNO3 = Cu(NO3)2 + 2Ag+10+20
- 30. Медь(Cu)Взаимодействие меди с нитратом серебра
- 31. Взаимодействие меди с нитратом серебраCu + 2AgNO3 = Cu(NO3)2 + 2AgОкислительВосстановитель
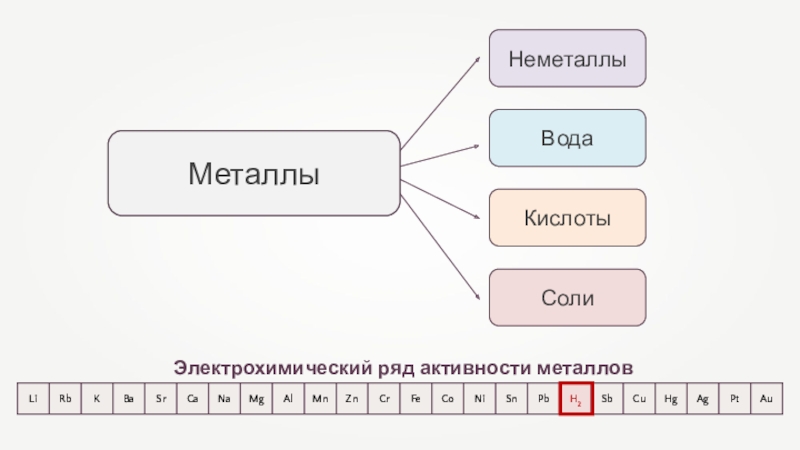
- 32. Электрохимический ряд активности металлов
- 33. НеметаллыКислотыВодаСолиМеталлыЭлектрохимический ряд активности металлов
Металлический блеск
Слайд 11Физические свойства металлов заключаются
в том, что они ковкие, пластичные, тягучие
вещества, которые способны проводить
тепло и электрический ток.
тепло и электрический ток.
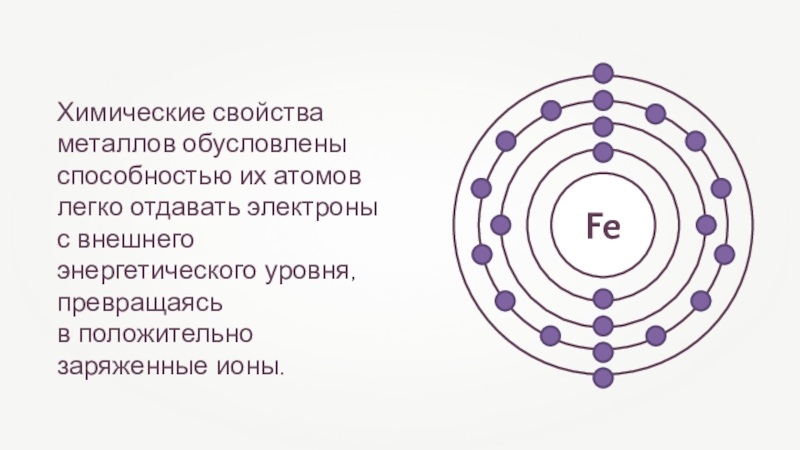
Слайд 12Химические свойства металлов обусловлены способностью их атомов легко отдавать электроны
с
внешнего энергетического уровня, превращаясь
в положительно заряженные ионы.
в положительно заряженные ионы.
Слайд 14
Реакции замещения — это такие реакции,
в результате которых атомы простого
вещества замещают атомы одного из химических элементов в сложном веществе.
А
В
С
A+BC=AC+B
Слайд 15
Реакции соединения — это такие реакции,
в результате которых из одного
или нескольких веществ образуется одно сложное вещество.
А
В
A+B=AB
Слайд 16
Me - ne → Me
В химических реакциях металлы способны отдавать электроны,
т.е. быть восстановителями, проявлять в образовавшихся соединениях только положительную степень окисления.
0
—
n+
Слайд 24
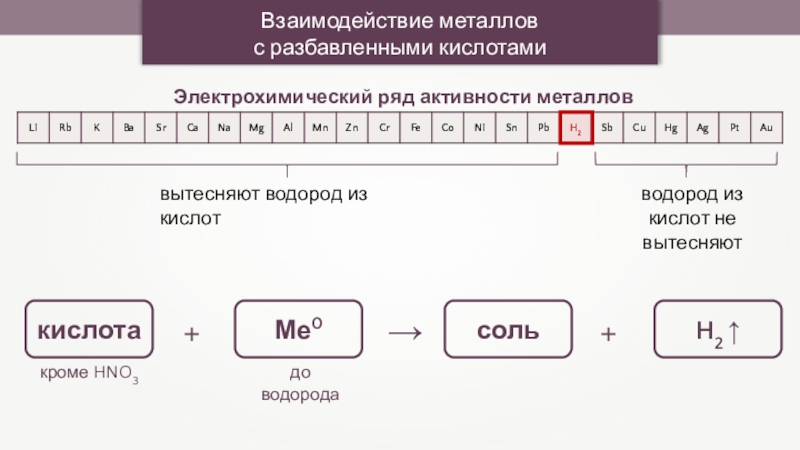
Взаимодействие металлов
с разбавленными кислотами
Электрохимический ряд активности металлов
вытесняют водород из кислот
водород
из кислот не вытесняют
кислота
Ме0
соль
H2 ↑
+
→
+
кроме HNO3
до водорода
Слайд 27
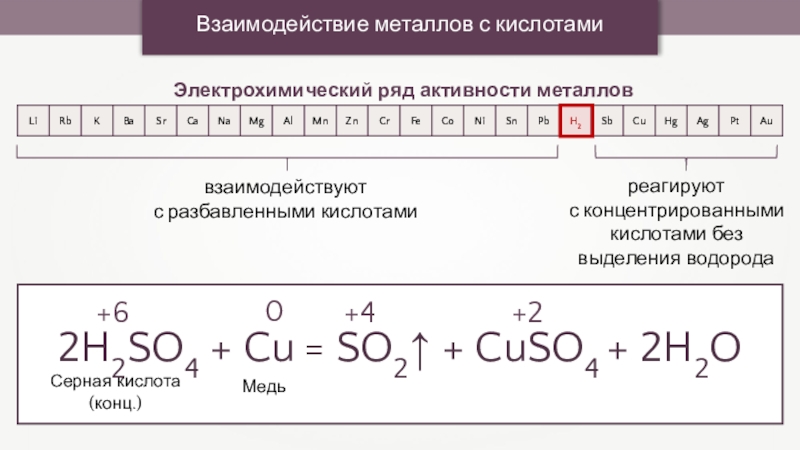
Взаимодействие металлов с кислотами
Электрохимический ряд активности металлов
взаимодействуют
с разбавленными кислотами
реагируют
с
концентрированными кислотами без выделения водорода
2H2SO4 + Cu = SO2↑ + CuSO4 + 2H2O
0
+6
+4
+2
Медь
Серная кислота (конц.)
Слайд 28
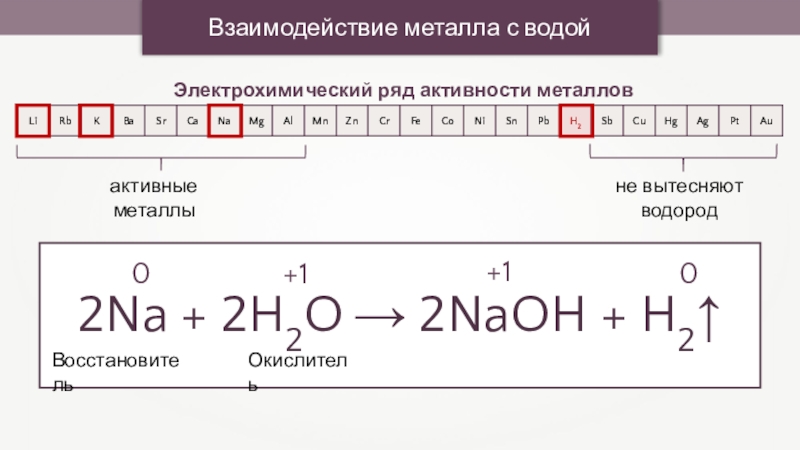
Взаимодействие металла с водой
Электрохимический ряд активности металлов
активные металлы
2Na + 2H2O →
2NaOH + H2↑
+1
0
+1
0
Окислитель
Восстановитель
не вытесняют водород
Слайд 29
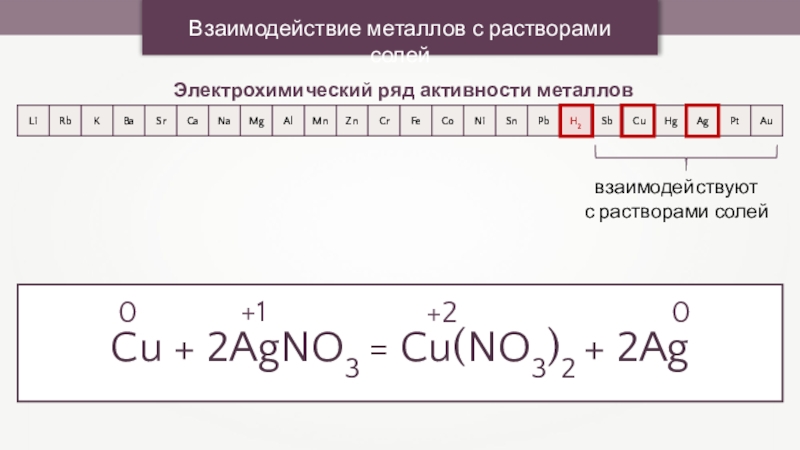
Взаимодействие металлов с растворами солей
Электрохимический ряд активности металлов
взаимодействуют
с растворами солей
Cu +
2AgNO3 = Cu(NO3)2 + 2Ag
+1
0
+2
0