- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад урока Электрический ток в жидкостях. Закон электролиза
Содержание
- 1. Презентация урока Электрический ток в жидкостях. Закон электролиза
- 2. Электрический ток в жидкостях. Электролиз.
- 3. Повторение: - Что называют электрическим током?
- 4. Цели: -выяснить физическую сущность электропроводимости жидких проводников
- 5. Слайд 5
- 6. Проводят электрический ток растворы солей, щелочей, кислот.Вещества,
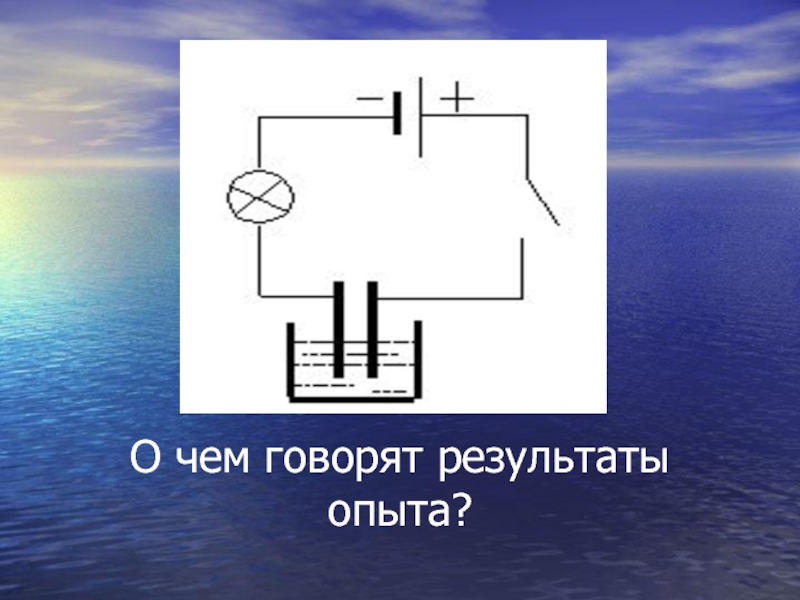
- 7. О чем говорят результаты опыта?
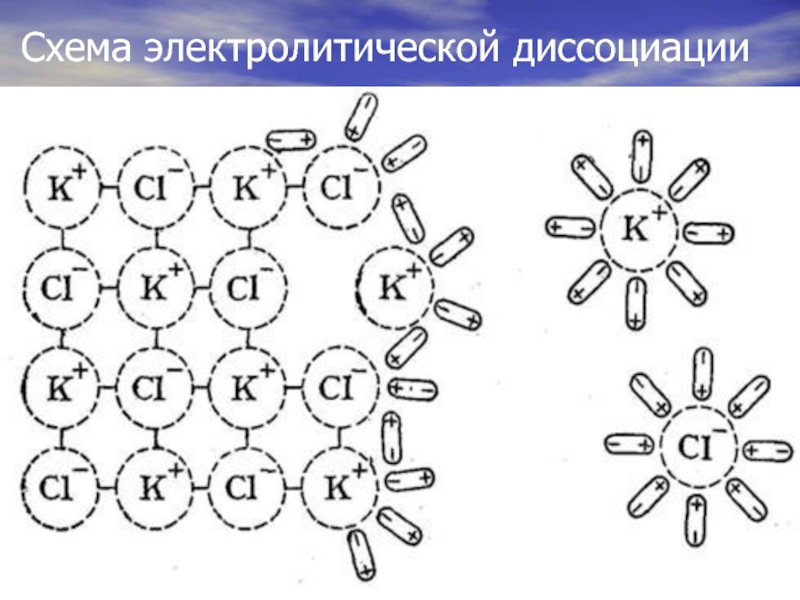
- 8. Схема электролитической диссоциации
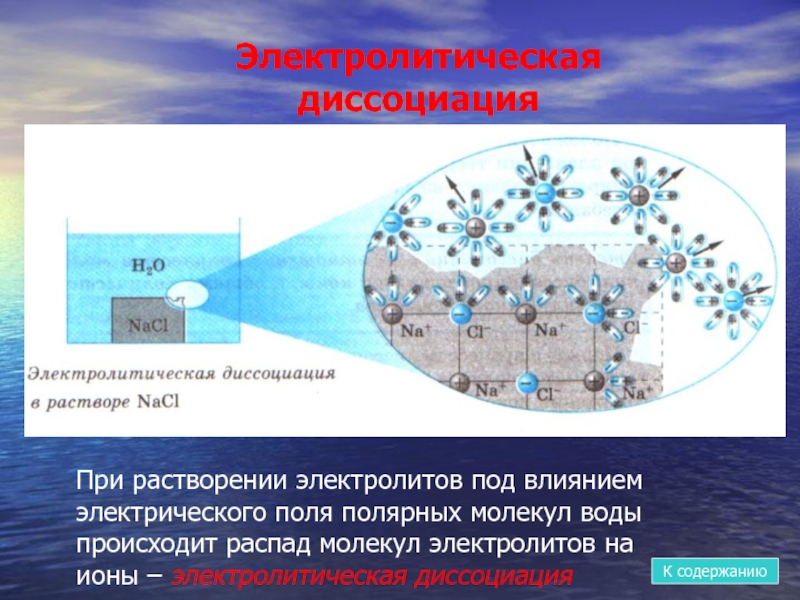
- 9. При растворении электролитов под влиянием электрического поля
- 10. Какова проводимость электролитов?
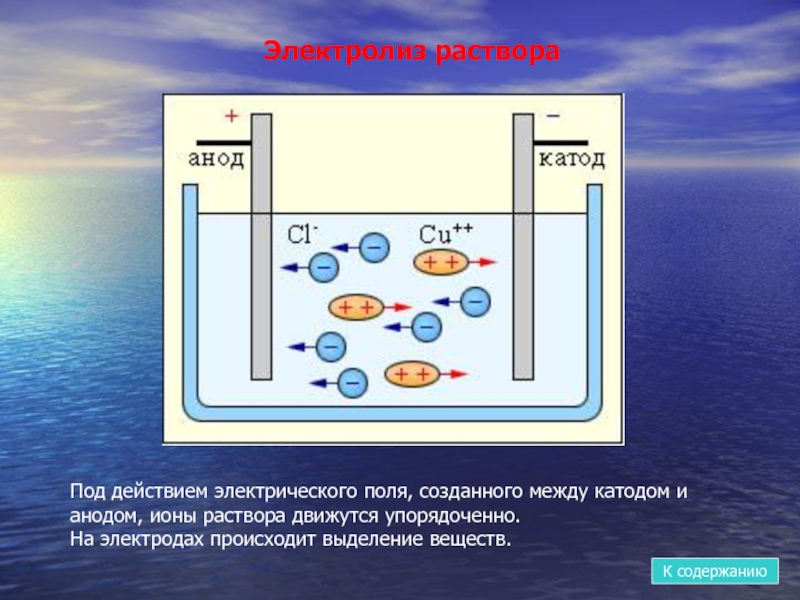
- 11. Электролиз раствораПод действием электрического поля, созданного между
- 12. Слайд 12
- 13. Применение электролиза: Электролитический метод используется для
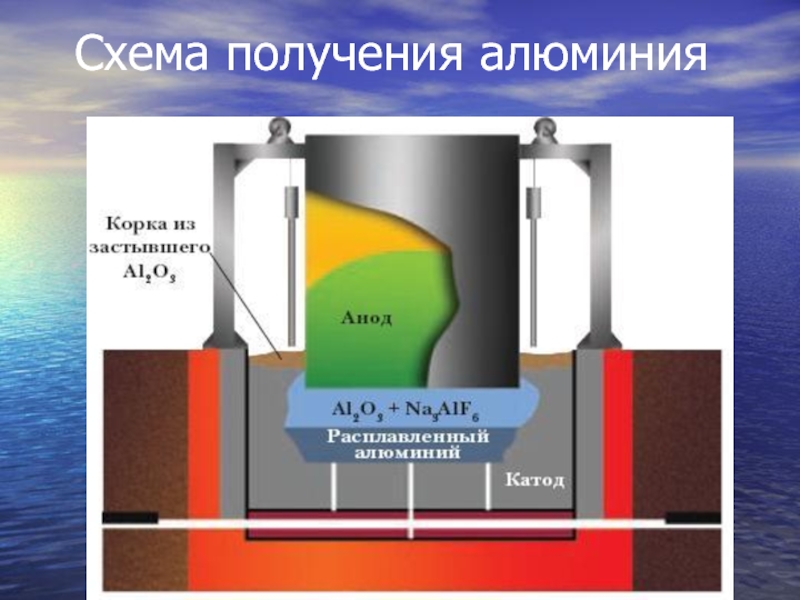
- 14. Схема получения алюминия
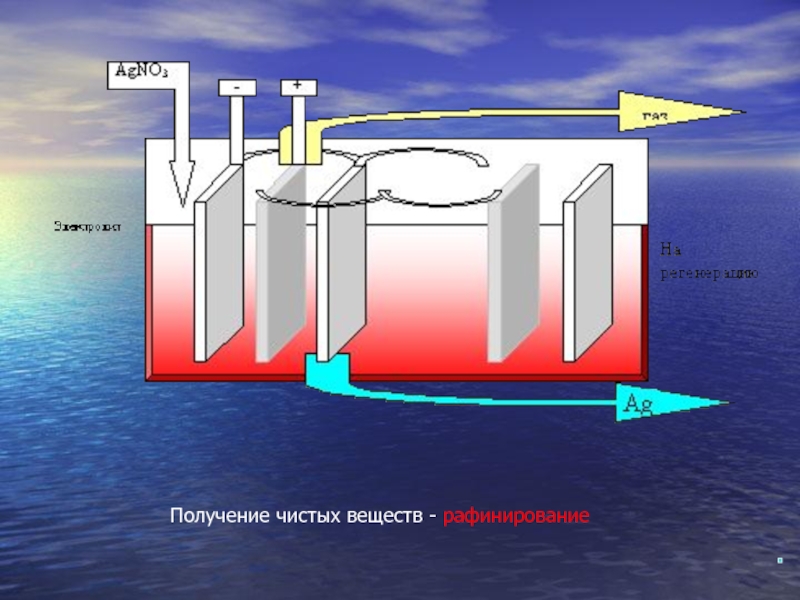
- 15. Получение чистых веществ - рафинирование
- 16. Изделие, которое хотят покрыть слоем металла,опускают в
- 17. Гальваностегия используется для защиты металлическихИзделий от коррозии.
- 18. Гальваностегия (никелирование, хромирование, золочение) применяют с эстетической целью и для защиты от коррозии.
- 19. Применения электролизаПолучение рельефных, отслаиваемых покрытий называется гальванопластикой.
- 20. ГальванопластикаТакже с помощью
- 21. На схеме №1 – слепокизделия(катод), №2 –
- 22. Фигуры, украшающие Исаакиевский собор Санкт-Петербурга, получены методом гальванопластики
- 23. Кроме указанных выше , электролиз нашел применениеи
- 24. От чего зависит масса выделившегося вещества на электроде?
- 25. Закон
- 26. Закон Электролиза
- 27. 1. Какова физическая природа электропроводности в электролитах?
- 28. 4. Согласно закону Фарадея масса вещества, выделившегося
- 29. Задача: При электролитическом способе
- 30. Д\задание: прочитать §122,123; выучить основные определения и
Слайд 1 ОБЛАСТНОЕ ГОСУДАРСТВЕННОЕ АВТОНОМНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ СРЕДНЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «БЕЛГОРОДСКИЙ СТРОИТЕЛЬНЫЙ КОЛЛЕДЖ» Отделение ПКР
Слайд 3 Повторение: - Что называют электрическим током? - Какое направление тока принимают за положительное? -
Слайд 4Цели: -выяснить физическую сущность электропроводимости жидких проводников (электролитов) - изучить процессы электролитической
Слайд 5 Значение
Многое вокруг сталкивается с раствором или расплавом солей, а следовательно и с электротоком в жидкостях. Эти явления изучает целая наука – электрохимия.
Слайд 6Проводят электрический ток растворы солей, щелочей, кислот.
Вещества, растворы которых проводят электрический
Растворы сахара, спирта, глюкозы и некоторых других веществ не проводят электрический ток -диэлектрики.
Жидкие полупроводниками являются расплавленный селен, расплавы сульфитов и др.
.
Слайд 9При растворении электролитов под влиянием электрического поля полярных молекул воды происходит
Электролитическая диссоциация
К содержанию
Слайд 11Электролиз раствора
Под действием электрического поля, созданного между катодом и анодом, ионы
На электродах происходит выделение веществ.
К содержанию
Слайд 12
Электролиз — процесс выделения на
окислительно-восстановительными реакциями.
Слайд 13Применение электролиза:
Электролитический метод используется для получения чистых металлов. Так,
Аналогично очищают и драгоценные металлы (золото Au, серебро Ag).
Слайд 16Изделие, которое хотят покрыть слоем металла,
опускают в ванну в качестве катода.
раствор электролита, который содержит
нужный металл. Пластина из этого же
металла – анод. В процессе пропускания тока
через раствор нужный металл выделяется на
катоде (изделии), а пластинка (анод)
постепенно растворяется.
Гальваностегия
Слайд 17
Гальваностегия используется для защиты металлических
Изделий от коррозии. Гальваностегию активно используют в
ювелирном
наводят позолоту на изделия.
На схеме раствор
AgNO3,
катод – изделие, анод –
серебренная пластина.
Под действием
электролиза серебро
оседает на поверхности
изделия.
Слайд 18Гальваностегия (никелирование, хромирование, золочение) применяют с эстетической целью и для защиты
Слайд 19Применения электролиза
Получение рельефных, отслаиваемых покрытий называется гальванопластикой.
Слайд 20 Гальванопластика
Также с помощью электролиза можно изготовить
рельефные металлические
монет, медалей). Этот процесс был изобретен
русским физиком и электротехником Борисом
Семеновичем Якоби в сороковых годах XIX века и называется гальванопластикой. Для изготовления рельефной копии предмета сначала делают слепок из какого-либо пластичного материала, например из воска. Эту слепок натирают графитом и погружают в электролитическую ванну в качестве катода, где на нём и осаждается слой металла . Это применяется в полиграфии при изготовлении печатных форм.
Слайд 21На схеме №1 – слепок
изделия(катод), №2 – пластина металла
(анод). Растворенный
электролит содержит
нужный
данном случае –
серебро
Если нужно получить точную копию изделия, то сначала надо
из пластичного материала (воска) сделать слепок изделия, а
потом покрыть его поверхность графитом. После слепок
помещают в ванну с электролитом в качестве катода.
Пластина нужного металла – анод. Во время прохождения
тока толстый слой металла покрывает слепок. После его
отделяют от металла и получают точную копию изделия.
Слайд 23Кроме указанных выше , электролиз нашел применение
и в других областях:
получение
электрохимическая обработка поверхности металлического изделия (полировка);
электрохимическое окрашивание металлов (например, меди, латуни, цинка, хрома и др.);
очистка воды – удаление из нее растворимых примесей. В результате получается так называемая мягкая вода (по своим свойствам приближающаяся к дистиллированной);
электрохимическая заточка режущих инструментов (например, хирургических ножей, бритв и т.д.).
Слайд 25 Закон Фарадея
Физик Майкл Фарадей
подробно
электролиза и пришел к выводу,
что масса выделяющегося на
электроде вещества прямо
пропорциональна силе тока (I)
и времени (t).
Этот закон был назван законом
электролиза Фарадея.
Слайд 26 Закон Электролиза Фарадея
Формула этого закона –
Где k – электрохимический эквивалент
вещества. k равно массе вещества, которая
выделяется на электроде за 1с при силе тока
1А. Это постоянное табличное значение
отличное для каждого вещества (табл. №10, стр. 167)
т.к. q = I t , то
m=k q