- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад тест по физике на тему Идеальный газ
Содержание
- 1. Презентация-тест по физике на тему Идеальный газ
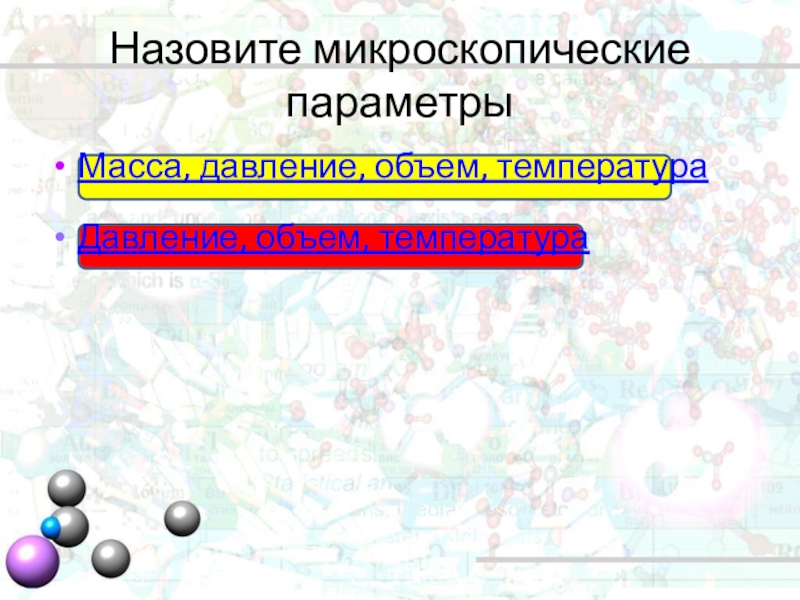
- 2. Назовите микроскопические параметрыМасса, давление, объем, температураДавление, объем, температура
- 3. К макроскопическим параметрам относятся: давление, объем и температура!Вернуться к вопросу
- 4. Молодец!Переходи к следующему вопросу
- 5. Неправильно!Вспомни теориюВспомни теорию.
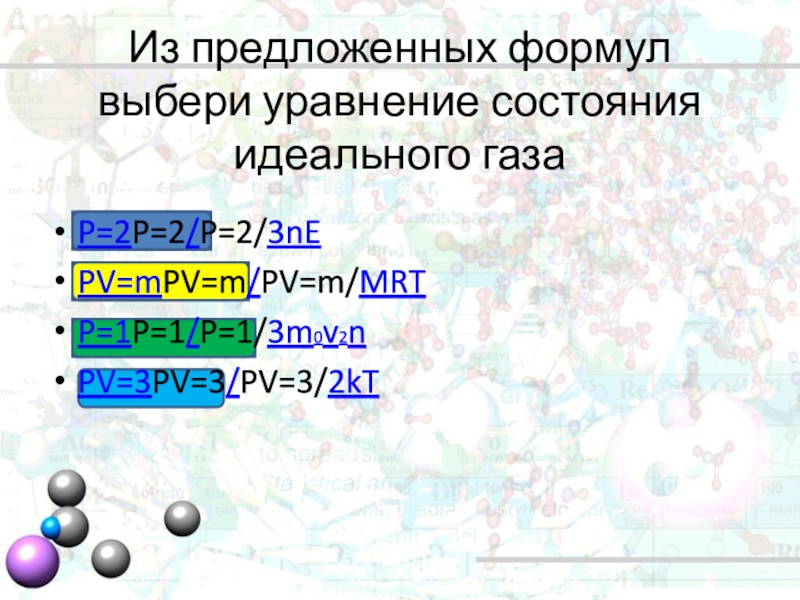
- 6. Из предложенных формул выбери уравнение состояния идеального газаP=2P=2/P=2/3nEPV=mPV=m/PV=m/MRTP=1P=1/P=1/3m0v2nPV=3PV=3/PV=3/2kT
- 7. Уравнением состояния идеального газа называется зависимость между
- 8. Молодец!Переходи к следующему вопросу
- 9. Неправильно!Вспомни теорию.
- 10. Из предложенных формул выбери уравнение массы газаm=RTm=RT/m=RT/pvMm=vMm=vM/m=vM/pRTm=pRTm=pRT/m=pRT/vMm=pvMm=pvM/m=pvM/RT
- 11. Чтобы выразить неизвестную величину из уравнения Менделеева-Клайперона,
- 12. Молодец!Переходи к следующему вопросу
- 13. Неправильно!Вспомни теорию.
- 14. Процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре называетсяизотермическийизобарныйизохорный
- 15. Согласно уравнению состояния газа в любом состоянии
- 16. Молодец!Переходи к следующему вопросу
- 17. Неправильно!Вспомни теорию.
- 18. Универсальная газовая постоянная равна1,38*10-23Дж/К8,31Дж/(моль*К)6,022*1023моль-1
- 19. Универсальной газовой постоянной называется произведение числа Авогадро и постоянной Больцмана: 6,02*1023*1,38*10-23Вернуться к вопросу
- 20. Молодец!Переходи к следующему вопросу
- 21. Неправильно!Вспомни теорию.
- 22. Газовый закон Шарля устанавливает зависимость между:Давлением и объемомОбъемом и температуройМежду давлением и температурой
- 23. Процесс изменения термодинамической системы при постоянном объеме
- 24. Молодец!Переходи к следующему вопросу
- 25. Неправильно!Вспомни теорию.
- 26. Задача: Найди давление газа бутана (C4H8)в
- 27. Решение: Переведи единицы измерения объема, массы, температуры
- 28. Молодец!Переходи к следующему вопросу
- 29. Неправильно!Вспомни теориюВспомни теорию.
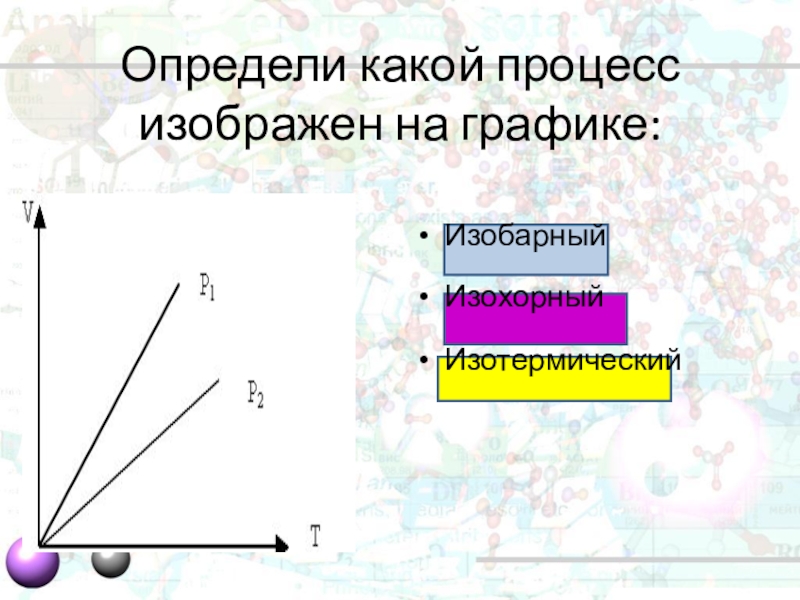
- 30. Определи какой процесс изображен на графике:ИзобарныйИзохорный Изотермический
- 31. Изотермический процесс – это процесс перехода идеального
- 32. Молодец!Переходи к следующему вопросу
- 33. Неправильно!Вспомни теориюВспомни теорию.
- 34. КОНЕЦ ТЕСТА
Назовите микроскопические параметрыМасса, давление, объем, температураДавление, объем, температура
Слайд 2
Назовите микроскопические параметры
Масса, давление, объем, температура
Давление, объем, температура
Слайд 6
Из предложенных формул выбери уравнение состояния идеального газа
P=2P=2/P=2/3nE
PV=mPV=m/PV=m/MRT
P=1P=1/P=1/3m0v2n
PV=3PV=3/PV=3/2kT
Слайд 7
Уравнением состояния идеального газа называется зависимость между макроскопическими параметрами: давлением, объемом
и температурой PV=m/MRT
Вернуться к вопросу
Слайд 10
Из предложенных формул выбери уравнение массы газа
m=RTm=RT/m=RT/pvM
m=vMm=vM/m=vM/pRT
m=pRTm=pRT/m=pRT/vM
m=pvMm=pvM/m=pvM/RT
Слайд 11
Чтобы выразить неизвестную величину из уравнения Менделеева-Клайперона, умножь левую и правую
часть уравнения на знаменатель M, получишь pvM=mRT, найди неизвестный множитель, разделив произведение на известные множители.
Вернуться к вопросу
Слайд 14
Процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре называется
изотермический
изобарный
изохорный
Слайд 15
Согласно уравнению состояния газа в любом состоянии с неизменной температурой произведение
давления газа на его объём остается постоянным. Процесс изотермический. T=const
Закон Бойля-Мариотта
вернуться к вопросу
Слайд 19
Универсальной газовой постоянной называется произведение числа Авогадро и постоянной Больцмана: 6,02*1023*1,38*10-23
Вернуться
к вопросу
Слайд 22
Газовый закон Шарля устанавливает зависимость между:
Давлением и объемом
Объемом и температурой
Между давлением
и температурой
Слайд 23
Процесс изменения термодинамической системы при постоянном объеме называют изохорным.
Газовый закон
Шарля.
V=const
Вернуться к вопросу
Слайд 26
Задача:
Найди давление газа бутана (C4H8)в баллоне для портативных газовых плит
объемом 0,5л и массой 250г при температуре 200С
12кПа
21,7Мпа
Слайд 27
Решение:
Переведи единицы измерения объема, массы, температуры в СИ. Найди молярную массу
бутана: M=(4*12+1*8)*10-3=56 10*-3кг/моль
Вернуться к вопросу
Слайд 31Изотермический процесс – это процесс перехода идеального газа из одного состояния
в другое без изменения температуры.
Изобарный процесс – процесс перехода идеального газа из одного состояния в другое при постоянном значении давления.
Изохорный процесс – это процесс перехода идеального газа из одного состояния в другое при постоянном значении объема.