- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по физики на тему Строение атома. Опыты Резерфорда. Постулаты Бора. (11 класс)
Содержание
- 1. Презентация по физики на тему Строение атома. Опыты Резерфорда. Постулаты Бора. (11 класс)
- 2. Модель ТомсонаПоложительный заряд атома занимает весь объем
- 3. Опыты РезерфордаИзучая рассеяние альфа-частиц при прохождении через
- 4. Альфа-частицаАльфа-частица (или α-частица) – ядро атома гелия,
- 5. Выводы РезерфордаD – 10-12 – 10-13 смЕсли
- 6. Планетарная модель атомаНедостатком планетарной модели была невозможность
- 7. Постулаты БораПервый постулат: Атом и атомные системы
- 8. Серия Бальмера Красная, зеленая и две
- 9. Трудности теории Бора. Движение электронов в
- 10. Задачи! На рисунке представлен фрагмент Периодической
- 11. Установите соответствие между названиями постулатов и их
- 12. На рисунке изображена упрощённая диаграмма
- 13. Самостоятельная работаНа рисунке изображена упрощённая диаграмма энергетических
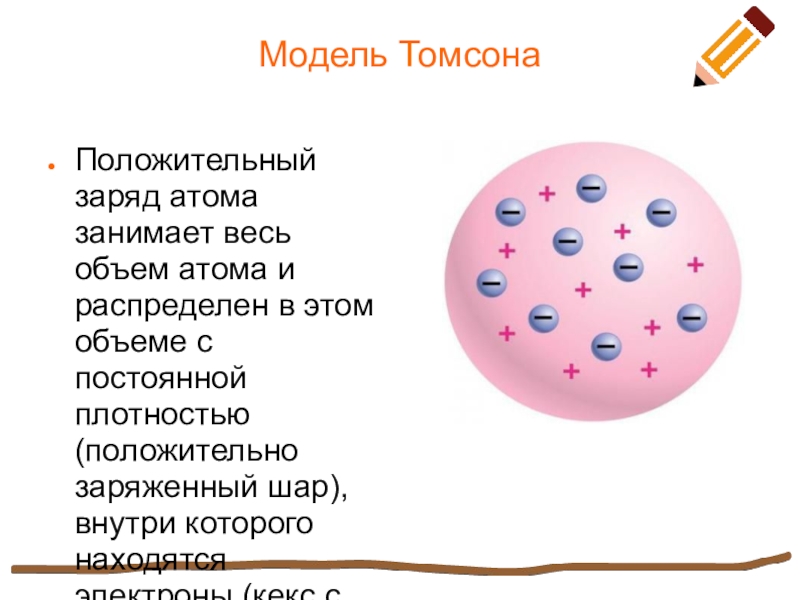
Модель ТомсонаПоложительный заряд атома занимает весь объем атома и распределен в этом объеме с постоянной плотностью (положительно заряженный шар), внутри которого находятся электроны (кекс с изюмом).
Слайд 2Модель Томсона
Положительный заряд атома занимает весь объем атома и распределен в
этом объеме с постоянной плотностью (положительно заряженный шар), внутри которого находятся электроны (кекс с изюмом).
Слайд 3Опыты Резерфорда
Изучая рассеяние альфа-частиц при прохождении через золотую фольгу, Резерфорд пришел
к выводу, что весь положительный заряд атомов сосредоточен в их центре в очень массивном и компактном ядре.
А отрицательно заряженные частицы (электроны) обращаются вокруг этого ядра.
Слайд 4Альфа-частица
Альфа-частица (или α-частица) – ядро атома гелия, состоящее из связанных вместе
двух протонов и двух нейтронов.
m – около 6,644656⋅10-27 кг
q - 3,218·10-19 Кл.
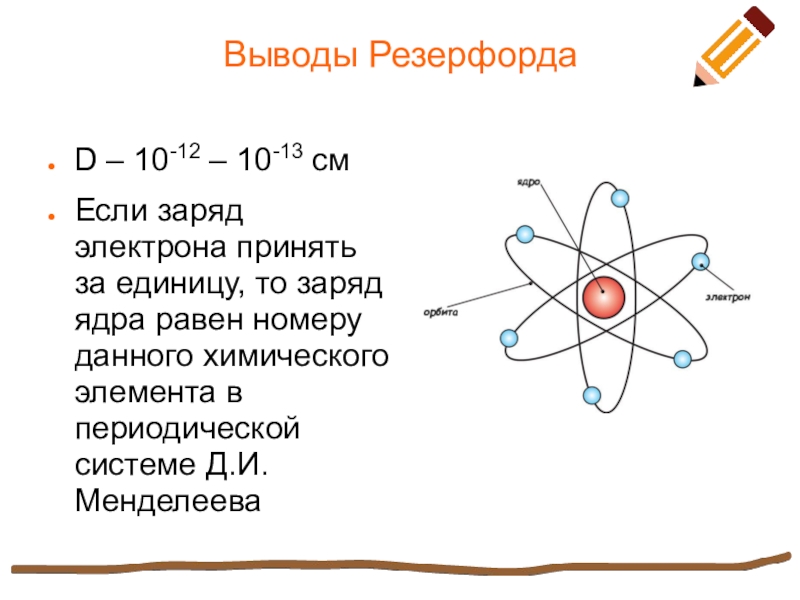
Слайд 5Выводы Резерфорда
D – 10-12 – 10-13 см
Если заряд электрона принять за
единицу, то заряд ядра равен номеру данного химического элемента в периодической системе Д.И. Менделеева
Слайд 6Планетарная модель атома
Недостатком планетарной модели была невозможность объяснения ею устойчивости атомов.
Из классической электродинамики следует, что так как электроны движутся вокруг ядра, испытывая при этом центростремительное ускорение как планеты вокруг Солнца, то они по законам классической электродинамики должны излучать электромагнитные волны, теряя при этом на излучение кинетическую энергию орбитального движения и в результате «упасть» на ядро. Расчёты, выполненные с помощью методов классической электродинамики показывают, что электроны должны «упасть» на ядро за время порядка 10-11 с.
Это противоречие было снято последующим развитием планетарной модели в модели атома Бора.
Это противоречие было снято последующим развитием планетарной модели в модели атома Бора.
Слайд 7Постулаты Бора
Первый постулат: Атом и атомные системы могут длительно пребывать только
в особенных стационарных или квантовых состояниях, каждому из которых соответствует определённая энергия. В стационарном состоянии атом не излучает электромагнитных волн.
Второй постулат: Излучение света происходит при переходе электрона из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией. Энергия излучённого фотона равна разности энергий стационарных состояний.
hvkn = Еk - Еn
Второй постулат: Излучение света происходит при переходе электрона из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией. Энергия излучённого фотона равна разности энергий стационарных состояний.
hvkn = Еk - Еn
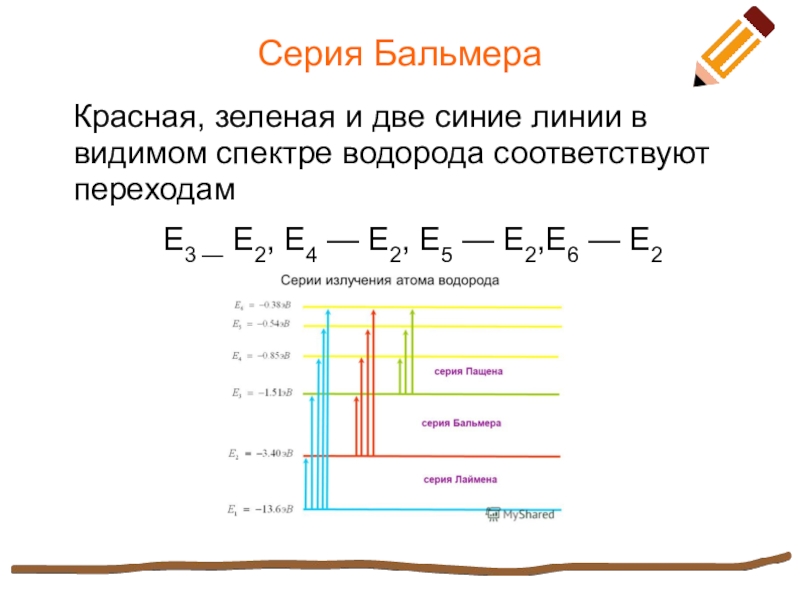
Слайд 8Серия Бальмера
Красная, зеленая и две синие линии в видимом
спектре водорода соответствуют переходам
Е3 — Е2, Е4 — Е2, Е5 — Е2,Е6 — Е2
Е3 — Е2, Е4 — Е2, Е5 — Е2,Е6 — Е2
Слайд 9Трудности теории Бора.
Движение электронов в атоме очень мало напоминает
движение планет по орбитам. Большую часть времени электрон находится на определенном расстоянии от ядра, подчиняясь законам квантовой механики и электродинамики, а не законам классической механики.
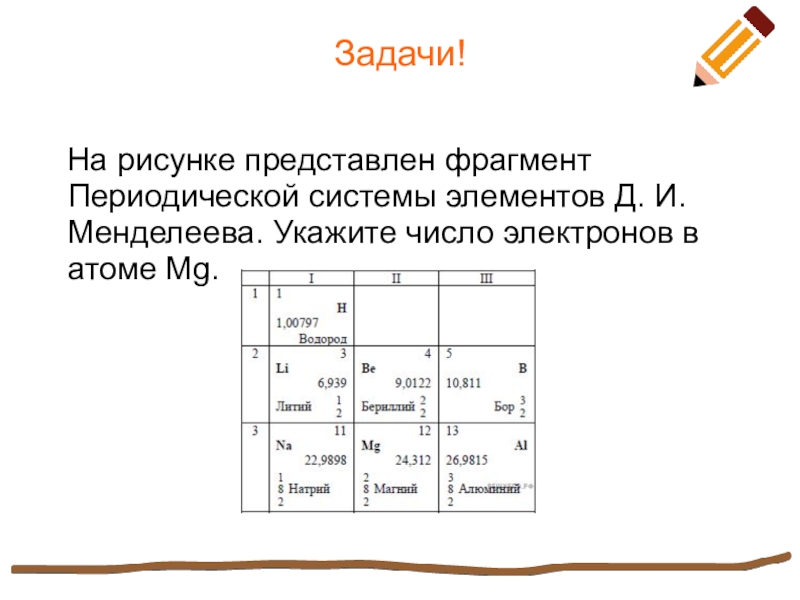
Слайд 10Задачи!
На рисунке представлен фрагмент Периодической системы элементов Д. И.
Менделеева. Укажите число электронов в атоме Mg.
Слайд 11
Установите соответствие между названиями постулатов и их формулировками.
ПОСТУЛАТЫ БОРА
А)
первый
Б) второй
ИХ ФОРМУЛИРОВКИ
1) переходя из одного состояния в другое, атом излучает (поглощает) половину разности энергий в начальном и конечном состояниях
2) переходя из одного состояния в другое, атом излучает (поглощает) квант энергии, равный разности энергий в начальном и конечном состояниях
3) атом может находиться только в одном из двух возможных состояний
4) атом может находиться только в одном из состояний с определенным значением энергии
Б) второй
ИХ ФОРМУЛИРОВКИ
1) переходя из одного состояния в другое, атом излучает (поглощает) половину разности энергий в начальном и конечном состояниях
2) переходя из одного состояния в другое, атом излучает (поглощает) квант энергии, равный разности энергий в начальном и конечном состояниях
3) атом может находиться только в одном из двух возможных состояний
4) атом может находиться только в одном из состояний с определенным значением энергии
Слайд 12
На рисунке изображена упрощённая диаграмма энергетических уровней атома. Нумерованными
стрелками отмечены некоторые возможные переходы атома между этими уровнями. Установите соответствие между процессами поглощения света наибольшей длины волны и испускания света наибольшей длины волны и стрелками, указывающими энергетические переходы атома.
ПРОЦЕСС
А) поглощение света наибольшей длины волны
Б) излучение света наибольшей длины волны
ЭНЕРГЕТИЧЕСКИЙ ПЕРЕХОД
1) 1
2) 2
3) 3
4) 4
ПРОЦЕСС
А) поглощение света наибольшей длины волны
Б) излучение света наибольшей длины волны
ЭНЕРГЕТИЧЕСКИЙ ПЕРЕХОД
1) 1
2) 2
3) 3
4) 4
Слайд 13Самостоятельная работа
На рисунке изображена упрощённая диаграмма энергетических уровней атома. Нумерованными стрелками
отмечены некоторые возможные переходы атома между этими уровнями. Установите соответствие между процессами поглощения света наибольшей длины волны и испускания света наибольшей длины волны и стрелками, указывающими энергетические переходы атома.
ПРОЦЕСС
А) поглощение света наименьшей длины волны
Б) излучение света с наибольшей энергией
ЭНЕРГЕТИЧЕСКИЙ ПЕРЕХОД
1) 1
2) 2
3) 3
4) 4
ПРОЦЕСС
А) поглощение света наименьшей длины волны
Б) излучение света с наибольшей энергией
ЭНЕРГЕТИЧЕСКИЙ ПЕРЕХОД
1) 1
2) 2
3) 3
4) 4