- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по физике подготовка к ЕГЭ: МКТ и термодинамика
Содержание
- 1. Презентация по физике подготовка к ЕГЭ: МКТ и термодинамика
- 2. Связь между давлением и средней кинетической энергией. Связь температуры и средней кинетической энергией.
- 3. АБСОЛЮТНАЯ ТЕМПЕРАТУРАТемпература – термодинамический параметр, одинаковый во
- 4. Слайд 4
- 5. Слайд 5
- 6. Первый закон термодинамикиПервое начало (первый закон) термодинамики
- 7. Применение первого закона термодинамики к различным процессамИзохорный
- 8. Изотермический процесс.Поскольку при изотермическом процессе внутренняя энергия
- 9. Изобарный процесс.Изобарный (изобарический) процесс — термодинамический процесс,
- 10. Адиабатический процессАдиабатический процесс (адиабатный процесс) — это
- 11. Слайд 11
- 12. Насыщенный пар и его свойства1. При неизменной
- 13. Слайд 13
- 14. Слайд 14
- 15. газ получает теплоту, если:Увеличиваются и его
- 16. Слайд 16
- 17. Слайд 17
- 18. Слайд 18
- 19. Слайд 19
- 20. Слайд 20
- 21. Слайд 21
- 22. Слайд 22
- 23. Слайд 23
- 24. Слайд 24
- 25. Задание 11. При одинаковой температуре 100 °С
- 26. Слайд 26
- 27. Слайд 27
- 28. Слайд 28
- 29. Слайд 29
- 30. Слайд 30
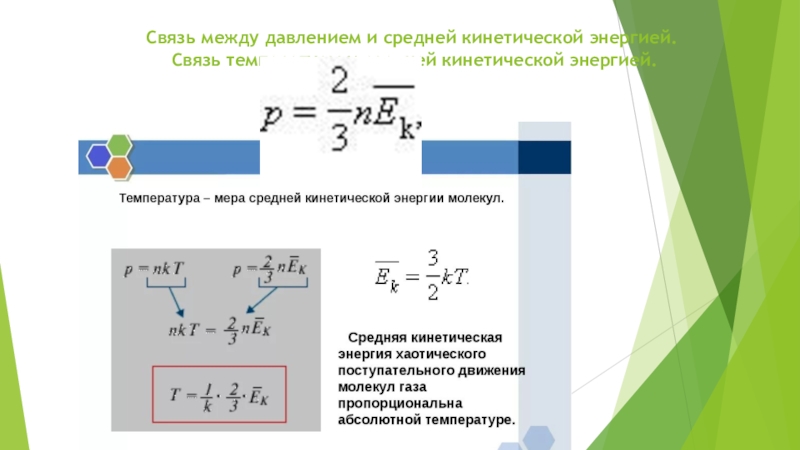
Слайд 2Связь между давлением и средней кинетической энергией. Связь температуры и средней
Слайд 3АБСОЛЮТНАЯ ТЕМПЕРАТУРА
Температура – термодинамический параметр, одинаковый во всех точках системы, находящейся
В Европе для практического применения используется температурная шкала Цельсия. В СИ принята абсолютная термодинамическая шкала температуры, в которой температуру измеряют в градусах Кельвина и называют абсолютной или термодинамической температурой. Связь между абсолютной температурой T и температурой Цельсия t:
T ≈ 273 + t; [T] = K; [t] = °С.
Абсолютная шкала температуры называется так, потому что мера основного состояния нижнего предела температуры: абсолютный ноль — наиболее низкая возможная температура, при которой ничего не может быть холоднее и теоретически невозможно извлечь из вещества тепловую энергию. Средняя кинетическая энергия частицы связана с термодинамической температурой постоянной Больцмана:
Eср = 3/2kT где:
k = 1.380 6505 × 10−23 Дж/K — постоянная Больцмана
T — термодинамическая температура, К
Слайд 6Первый закон термодинамики
Первое начало (первый закон) термодинамики — это закон сохранения
Согласно первому началу термодинамики, работа может совершаться только за счет теплоты или какой-либо другой формы энергии Первый закон термодинамики формулируется так:
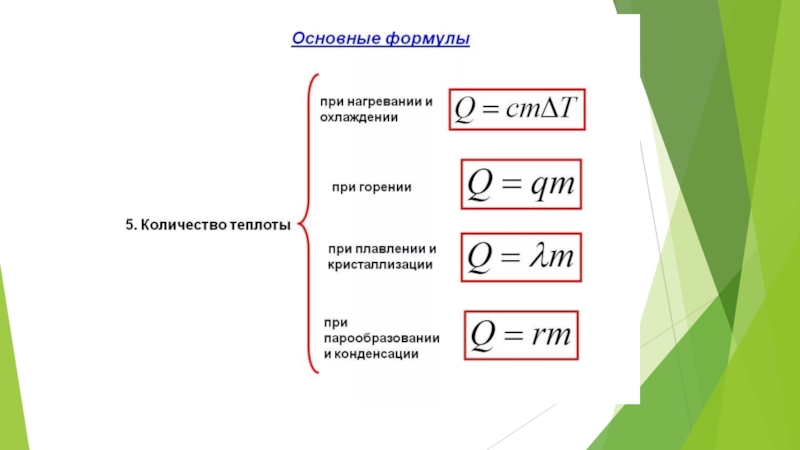
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
ΔU = A + Q,
где ΔU — изменение внутренней энергии, A — работа внешних сил, Q — количество теплоты, переданной системе.
Из (ΔU = A + Q) следует закон сохранения внутренней энергии. Если систему изолировать от внешних воздействий, то A = 0 и Q = 0, а следовательно, и ΔU = 0.
При любых процессах, происходящих в изолированной системе, ее внутренняя энергия остается постоянной.
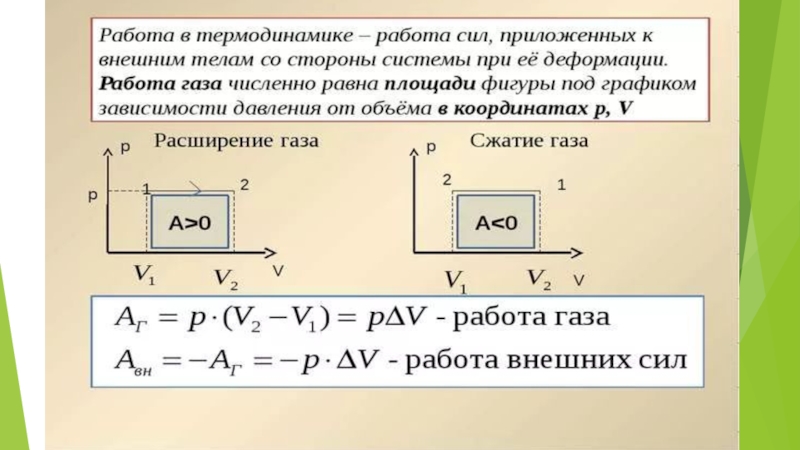
Если работу совершает система, а не внешние силы, то уравнение (ΔU = A + Q) записывается в виде:
где A' — работа, совершаемая системой (A' = -A).
Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
Слайд 7Применение первого закона термодинамики к различным процессам
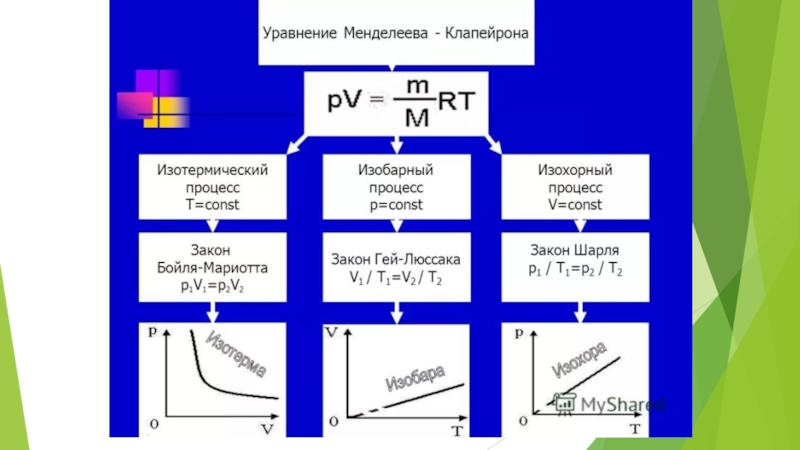
Изохорный процесс.
Зависимость р(Т) на термодинамической
Изохорный (изохорический) процесс — термодинамический процесс, происходящий в системе при постоянном объеме.
Изохорный процесс можно осуществить в газах и жидкостях, заключенных в сосуд с постоянным объемом.
При изохорном процессе объем газа не меняется (ΔV= 0), и, согласно первому началу термодинамики Первый закон термодинамики,
ΔU = Q,
т. е. изменение внутренней энергии равно количеству переданного тепла, т. к. работа (А = рΔV=0) газом не совершается.
Если газ нагревается, то Q > 0 и ΔU > 0, его внутренняя энергия увеличивается. При охлаждении газа Q < 0 и ΔU < 0, внутренняя энергия уменьшается.
Слайд 8Изотермический процесс.
Поскольку при изотермическом процессе внутренняя энергия газа не меняется (Т
Q = A',
При получении газом теплоты (Q > 0) он совершает положительную работу (A' > 0). Если газ отдает тепло окружающей среде Q < 0 и A' < 0. В этом случае над газом совершается работа внешними силами. Для внешних сил работа положительна. Геометрически работа при изотермическом процессе определяется площадью под кривой p(V).
Слайд 9Изобарный процесс.
Изобарный (изобарический) процесс — термодинамический процесс, происходящий в системе с
Примером изобарного процесса является расширение газа в цилиндре со свободно ходящим нагруженным поршнем.
При изобарном процессе, согласно формуле Первый закон термодинамики, передаваемое газу количество теплоты идет на изменение его внутренней энергии ΔU и на совершение им работы A' при постоянном давлении:
Q = ΔU + A'.
Работа идеального газа определяется по графику зависимости p(V) для изобарного процесса
(A' = pΔV).
Слайд 10Адиабатический процесс
Адиабатический процесс (адиабатный процесс) — это термодинамический процесс, происходящий в
На адиабатически изолированную систему не оказывает влияния изменение температуры окружающих тел. Ее внутренняя энергия U может меняться только за счет работы, совершаемой внешними телами над системой, или самой системой.
Согласно первому началу термодинамики (ΔU = А + Q), в адиабатной системе ΔU = A,
где A — работа внешних сил.
При адиабатном расширении газа А < 0.
Это означает уменьшение температуры при адиабатном расширении. Оно приводит к тому, что давление газа уменьшается более резко, чем при изотермическом процессе. Площадь под адиабатой численно равна работе, совершаемой газом при его адиабатическом расширении от объема V1, до V2.
Адиабатное сжатие приводит к повышению температуры газа, т. к. в результате упругих соударений молекул газа с поршнем их средняя кинетическая энергия возрастает, в отличие от расширения, когда она уменьшается (в первом случае скорости молекул газа увеличиваются, во втором — уменьшаются).
Резкое нагревание воздуха при адиабатическом сжатии используется в двигателях Дизеля.
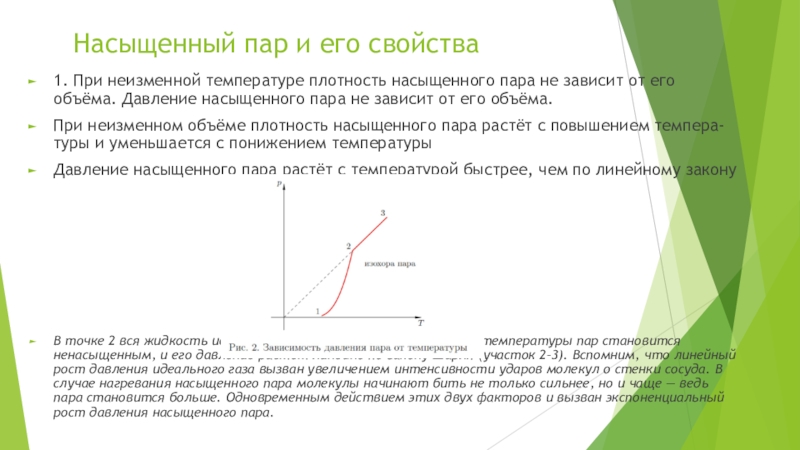
Слайд 12Насыщенный пар и его свойства
1. При неизменной температуре плотность насыщенного пара
При неизменном объёме плотность насыщенного пара растёт с повышением темпера- туры и уменьшается с понижением температуры
Давление насыщенного пара растёт с температурой быстрее, чем по линейному закону
В точке 2 вся жидкость испаряется; при дальнейшем повышении температуры пар становится ненасыщенным, и его давление растёт линейно по закону Шарля (участок 2–3). Вспомним, что линейный рост давления идеального газа вызван увеличением интенсивности ударов молекул о стенки сосуда. В случае нагревания насыщенного пара молекулы начинают бить не только сильнее, но и чаще — ведь пара становится больше. Одновременным действием этих двух факторов и вызван экспоненциальный рост давления насыщенного пара.
Слайд 15 газ получает теплоту, если:
Увеличиваются и его температура, и объем;
Увеличивается объем,
Увеличивается температура, а объем постоянен.
Газ отдает теплоту, если:
Уменьшаются и его температура, и объем;
Уменьшается объем, а температура постоянна;
Уменьшается температура, а объем постоянен.
Слайд 25Задание 11. При одинаковой температуре 100 °С давление насыщенных паров воды
1) Ртуть кипит при более высокой температуре, чем аммиак.
2) Температура кипения воды ниже, чем у аммиака.
3) Для нагревания 1 кг ртути до температуры кипения необходимо количество теплоты, равное 37 кДж.
4) При кипении в открытом сосуде давление насыщенных паров аммиака равно нормальному атмосферному давлению.
5) Аммиак закипит, когда давление его насыщенных паров превысит Па.