- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по физике Планетарная модель атома. Опыт Резерфорда (11 класс)
Содержание
- 1. Презентация по физике Планетарная модель атома. Опыт Резерфорда (11 класс)
- 2. Модели атомов, созданные до 1910 года были
- 3. 1911Эрнест Резерфорд Г. Гейгер
- 4. Экспериментальная установкасвинцовый контейнер, содержащий крупицу радия. радиоактивное
- 5. Опыт РезерфордаРазбомбить!Мишень: золотая фольгаСнаряды: α частицы:
- 6. Ход опыта1) В отсутствии препятствия на пути
- 7. Результаты опыта1) Золотая фольга имела толщину
- 8. Результаты опыта
- 9. Предполагал Увидел1) Альфа частицы пролетят насквозь2) Рассеяние
- 10. Как объяснить?1. В центре находится маленькое положительно
- 11. Количественные характеристики1) заряд ядра приблизительно равен
- 12. Планетарная модель атома РезерфордаПротиворечие! движется по окружности,
- 13. Недостатки модели1.Согласно законам классической механики и электродинамики
- 14. Квантовые постулаты Бора :1913
- 15. Спасибо за внимание!
Слайд 2Модели атомов, созданные до 1910 года были умозрительными, их справедливость нужно
Решающий вклад в создание современной теории строения атома внес английский физик Эрнест Резерфорд
Эрнест
Резерфорд
Слайд 31911
Эрнест
Резерфорд
Г. Гейгер
Э. Марсден
В 1911 г. Резерфорд
Цель опыта: выяснить внутреннюю структуру атома:
1)Распределение массы
2)Распределение положительного и отрицательного заряда
3)Размеры атома
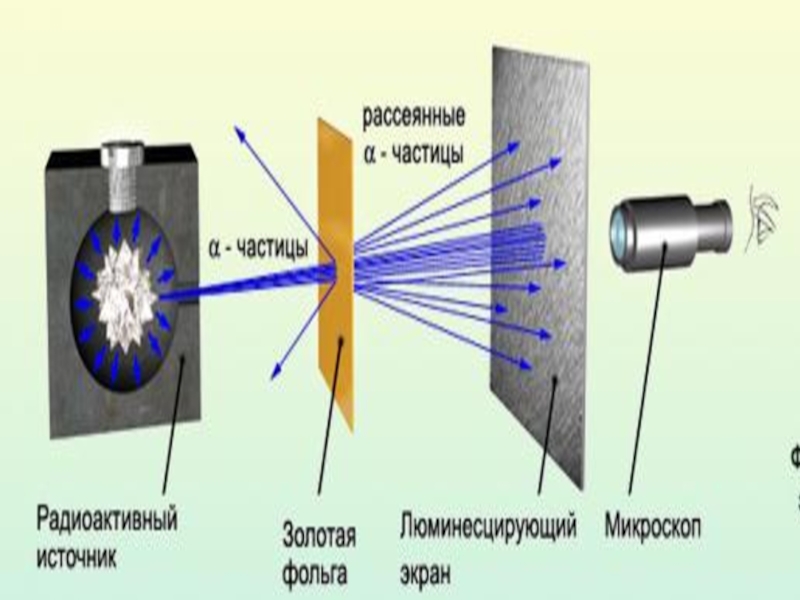
Слайд 4Экспериментальная установка
свинцовый контейнер, содержащий крупицу радия.
радиоактивное вещество (источник α-частиц)
-
- тонкая металлическая фольга
- экран, покрытый сульфидом цинка;
каждая альфа-частица, попавшая на экран, вызывает вспышку. Эти вспышки наблюдались глазом с помощью микроскопа и подсчитывались. Экран вместе с микроскопом мог поворачиваться, что позволяло изменять угол, под которым частицы попадали на экран.
Установка помещалась в сосуд из которого выкачен воздух, чтобы движению α -частиц ничто не мешало.
Слайд 6Ход опыта
1) В отсутствии препятствия на пути α-частицы, на экране образовывалось
2) Если на пути α -частиц установить препятствие, в виде тонкой металлической фольги, то картина на экране изменялась.
Слайд 7Результаты опыта
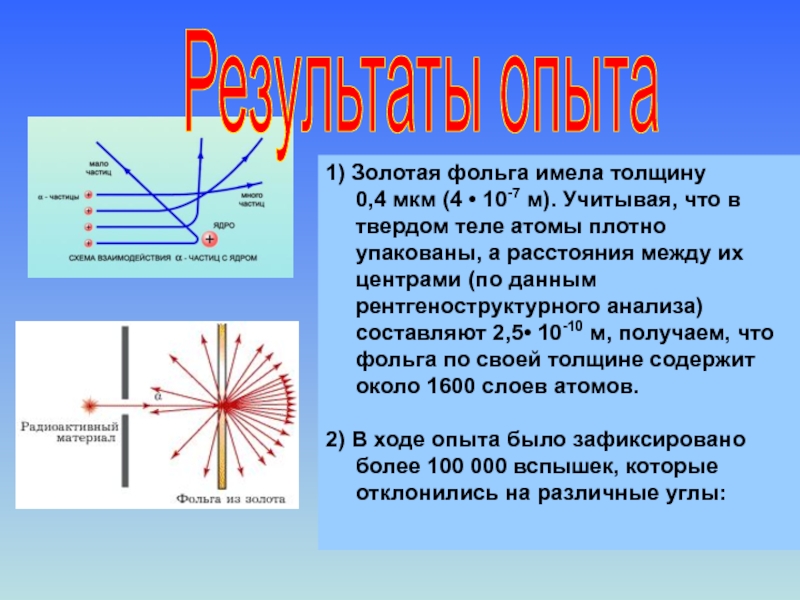
1) Золотая фольга имела толщину 0,4
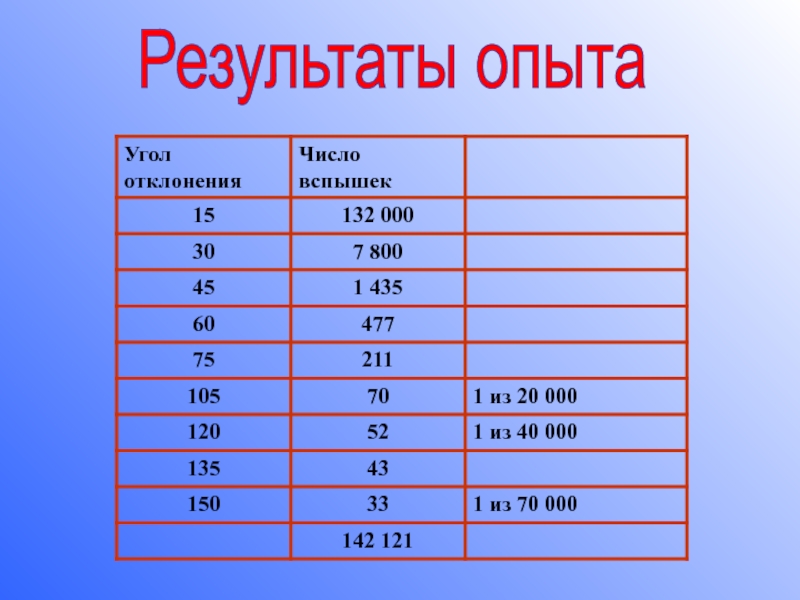
2) В ходе опыта было зафиксировано более 100 000 вспышек, которые отклонились на различные углы:
Слайд 9Предполагал
Увидел
1) Альфа частицы пролетят насквозь
2) Рассеяние будет примерно 20
2) Примерно
1) Угол рассеивания >>20
Модель Томсона
не состоятельна!!!
Слайд 10Как объяснить?
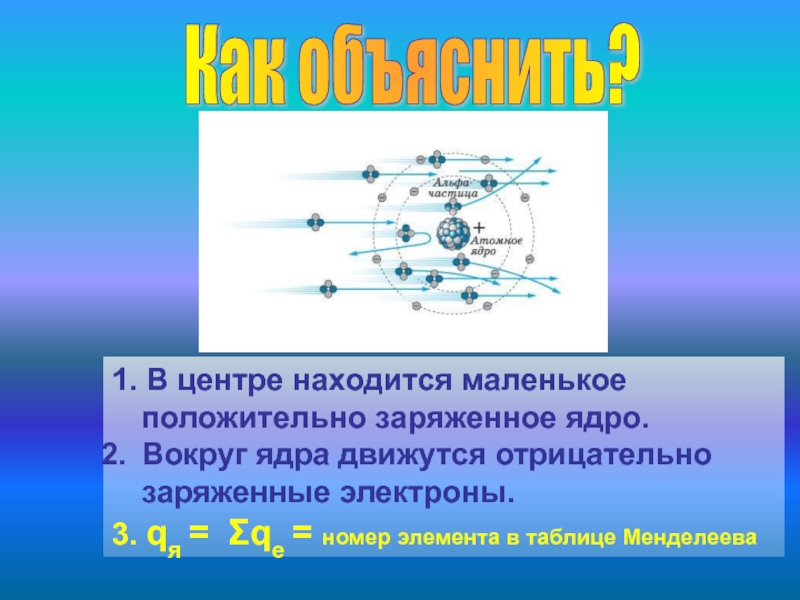
1. В центре находится маленькое положительно заряженное ядро.
Вокруг ядра движутся
3. qя = Σqe = номер элемента в таблице Менделеева
Слайд 11Количественные
характеристики
1) заряд ядра приблизительно равен половине массового числа атома (при
Qядра=Ze, где е — модуль заряда электрона.
2) Зная энергию альфа-частиц (5МэВ) и заряд ядра атома золота (79), можно рассчитать, на какое минимальное расстояние должны они сблизиться, чтобы альфа-частица отклонилась на определенный угол. Это дало возможность оценить размеры ядер атомов, оказавшиеся порядка 10-14 м. Напоминаем, что размеры самих атомов порядка 10-10 м, т.е. в 10 000 раз больше.
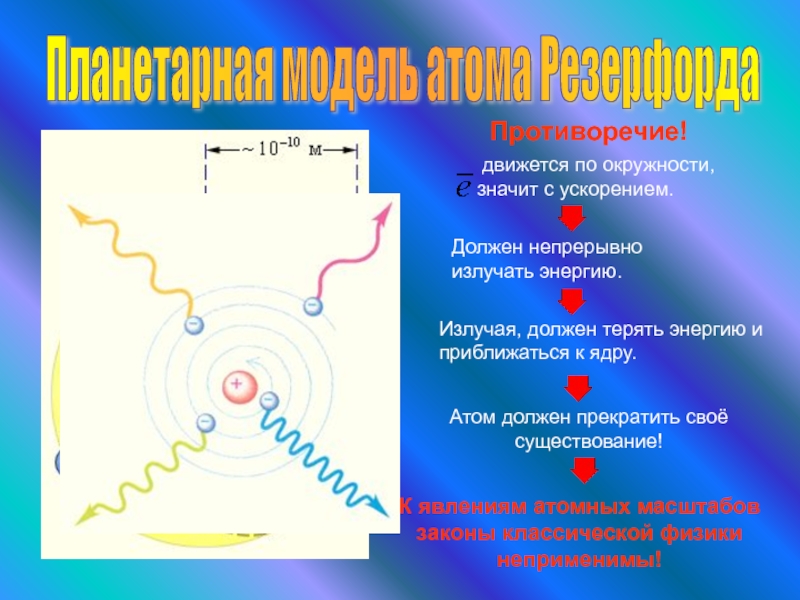
Слайд 12Планетарная модель атома Резерфорда
Противоречие!
движется по окружности, значит с ускорением.
Должен непрерывно
Излучая, должен терять энергию и приближаться к ядру.
Атом должен прекратить своё существование!
К явлениям атомных масштабов законы классической физики неприменимы!
Слайд 13Недостатки модели
1.Согласно законам классической механики и электродинамики ядерная модель атома Резерфорда
2. В любом объеме нагретого атомарного газа должны быть атомы как в «начале», так и в «конце» своего существования. Следовательно, излучаемый таким газом свет должен содержать электромагнитные волны всевозможных частот, т.е. атомарный газ должен излучать свет со сплошным спектром.
3. Ядерная модель атома с точки зрения классической механики и электродинамики несовместима и с гипотезой Планка: ускоренно движущийся вокруг ядра электрон должен испускать электромагнитную волну непрерывно, а не порциями, как утверждается в гипотезе Планка.
Слайд 14Квантовые
постулаты
Бора :
1913 г
1. Атом может находиться только в
2. При переходе из одного состояния в другое атом излучает (поглощает) фотон.