- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по физике на тему Решение задач по МКТ
Содержание
- 1. Презентация по физике на тему Решение задач по МКТ
- 2. Слайд 2
- 3. Задача .Плотность газа через концентрацию молекул n,
- 4. Задача .Молекулы гелия при некоторой температуре имеют
- 5. Задача.Баллон вместимостью V1= 0,02 м3, содержащий воздух
- 6. Задача.Число атомов водорода, содержащегося в соляной кислоте
- 7. Задача.Если заряд электрона -1,6·10-19Кл, порядковый номер золота
- 8. Задача.Идеальный газ сначала нагревался при постоянном объеме,
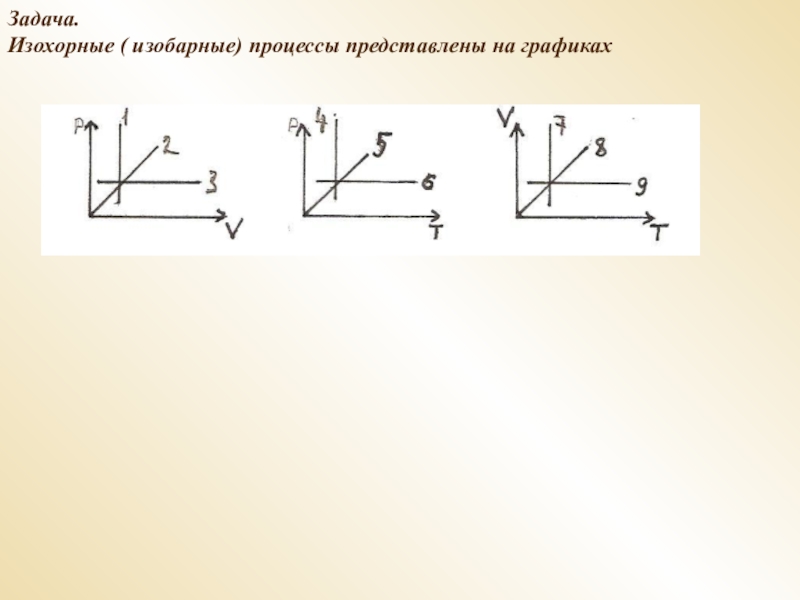
- 9. Задача.Изохорные ( изобарные) процессы представлены на графиках
- 10. Задача.Давление данной массы идеального газа при переходе
- 11. Задача.Состояние идеального газа изменилось в соответствии с
- 12. Задача.На рисунке приведена зависимость давления газа от
- 13. Задача.Отношение количеств вещества, содержащихся в одинаковых объёмах
- 14. Задача.Баллон вместимостью V1= 0,02 м3, содержащий воздух
- 15. Задача Из сосуда, содержащего 4 г водорода,
- 16. Задача.В баллоне находится газ m=12кг под давлением
- 17. ЗадачаВ баллоне объёмом V находится газ массой
- 18. Задача ( в.4105, з.24)Абсолютная влажность воздуха в
- 19. Задача.В сосуде объемом V при температуре Т
- 20. Задача.В закрытом сосуде находится воздух при температуре
Слайд 3Задача .
Плотность газа через концентрацию молекул n, молярную массу М и
известные константы выражается…
Задача .
Если концентрация молекул первого газа вдвое больше концентрации
молекул второго газа, а плотности газов при этом равны, то молярная масса
первого тела М1 и молярная масса второго М2 газов связаны соотношением…
Решение:
Обе задачи решаются из формулы взаимосвязи плотности и концентрации.
Т.к.плотность- это масса в единице объема, а концентрация- число частиц в
единице объема, то
По определению молярной массы
, значит
т.е.
( для второй задачи) ;
или
значит
(для первой задачи)
Слайд 4Задача .
Молекулы гелия при некоторой температуре имеют такую же среднюю
квадратичную
молекулы гелия в 2 раза больше массы молекулы водорода, то температура
гелия равна…
Решение:
Для решения используем соотношение для определения средней квадратичной скорости
или
скорости равны, значит
приходим к уравнению
или
;
или
Слайд 5Задача.
Баллон вместимостью V1= 0,02 м3, содержащий воздух под давлением
р1= 4.105
воздух выкачан. Если температура газа постоянна, то давление Р2,
установившееся в сосудах…
Решение:
Так как процесс происходит при постоянной температуре, то процесс изотермический и выполняется закон Бойля- Мариотта
где
Слайд 6Задача.
Число атомов водорода, содержащегося в соляной кислоте HCl, взятой в
количестве
Задача.
Число атомов водорода, содержащегося в аммиаке NH3, взятого в количестве
5 моль, равно…
Решение:
При решении задач такого характера необходимо внимательно рассмотреть химическую формулу- сколько атомов в каждой молекуле. Число атомов в данном количестве вещества равно число молекул умноженное на число атомов в 1- ой молекуле.
В соляной кислоте
В аммиаке
Слайд 7Задача.
Если заряд электрона -1,6·10-19Кл, порядковый номер золота в таблице
Менделеева 79,
Авогадро 6,02·1023моль-1. то электрический заряд всех электронов,
содержащихся в слитке золота массой 100г, равен…
Решение:
Чтобы найти общий заряд всех электронов, нужно знать количество всех электронов в данной массе вещества. Порядковый номер Z в таблице Менделеева определяет число электронов в одном атоме, значит всего электронов в данной массе
, где
;
общий заряд
Ответ задан по модулю: 38,6·105Кл.
Слайд 8Задача.
Идеальный газ сначала нагревался при постоянном объеме, потом его объем
увеличивался
давление газа уменьшилось до первоначального. Этим изменениям
соответствует график…
Решение:
Происходят процессы: 1) изохорное нагревание; 2) изобарное расширение (или нагревание); 3) изотермическое расширение
Слайд 10Задача.
Давление данной массы идеального газа при переходе из состояния
1 в
Решение:
Для решения задач такого характера удобно провести линии через крайние точки и начало координат, затем линию постоянной температуры (изотерму) и вспомнить закономерности изотермического процесса: при увеличении давления- объем уменьшается. И наоборот. Если линия идет через начало координат, то это изопроцесс.
1-ый рисунок: изобарный процесс.
2-ой рисунок: давление уменьшается.
3-ий рисунок: давление увеличивается.
4-ый рисунок: давление сначала увеличивается, затем уменьшается, затем снова увеличивается.
Слайд 11Задача.
Состояние идеального газа изменилось в соответствии с графиком,
изображенным на рисунке.
Температура газа в состоянии 3 равна…
Решение:
Для решения этой задачи выделим участки изопроцессов и выразим
закономерности этих процессов.
Участок 1-2: изобарный процесс ( P = const); при этом
или
значит
Участок 2-3: изохорный процесс (V = const); при этом
или
значит
Слайд 12Задача.
На рисунке приведена зависимость давления газа от температуры.
Об изменении объема
Решение:
График не проходит через начало координат, значит это не изопроцесс.
По уравнению Менделеева- Клапейрона
тогда
или
значит
,т.е. объем увеличился в 2 раза
Слайд 13Задача.
Отношение количеств вещества, содержащихся в одинаковых объёмах ртути
и алюминия равно
201·10-3кг/моль, плотность алюминия 2700кг/м3, плотность ртути 13600кг/м3)
Решение:
По условию задачи объемы одинаковы V1= V2
Количество вещества
Тогда,
Слайд 14Задача.
Баллон вместимостью V1= 0,02 м3, содержащий воздух под давлением
р1= 4.105
воздух выкачан. Если температура газа постоянна, то давление Р2,
установившееся в сосудах…
Решение:
Так как процесс происходит при постоянной температуре, то процесс изотермический и выполняется закон Бойля- Мариотта
где
Слайд 15Задача
Из сосуда, содержащего 4 г водорода, через трещину ежесекундно
выходит
опустеет, равен ( )
Решение:
Для решения задачи необходимо найти число молекул в 4 г водорода (Н2)
Тогда,
Слайд 16Задача.
В баллоне находится газ m=12кг под давлением p=10 МПа при неизменной
температуре. Если давление стало равно 2,5 МПа, то масса газа
уменьшилась на
Решение:
m1=12кг; Р1=10 МПа; Р2=2,5 МПа; найти необходимо разность m1- m2
По уравнению состояния
Объем и температура не изменяются.
Давление изменяется за счет изменения массы.
По условию задачи давление уменьшается в 10 МПа/2,5 МПа= 4 раза.
Значит, масса тоже уменьшается в 4 раза.
m2 = m1/4=12кг/4=3кг
значит масса уменьшилась на 12-3= 9(кг)
Слайд 17Задача
В баллоне объёмом V находится газ массой m1 при температуре Т1
давлении р1. Некоторое количество газа выпустили из баллона, после чего
оставшаяся масса оказалась равной m2, температура Т2, давление р2.
Число вылетевших молекул ΔN=N1-N2 оказалось равным …
Решение:
Для решения задачи дважды используем уравнение состояния идеального газа
Разделим второе выражение на первое, сократим ряд величин и получим
или
(*)
Выразим массы через количество частиц
Подставим эти выражения в (*)
Отсюда
Тогда
Или
Слайд 18Задача ( в.4105, з.24)
Абсолютная влажность воздуха в закрытом сосуде при температуре
30С 0,9 г/м3. Если давление насыщенного пара при этой температуре
831 Па, то относительная влажность воздуха в сосуде
( )
Решение:
Относительная влажность воздуха
Абсолютная влажность по условию задачи ρ = 0,9г/м3=9.10-4кг/м3
По уравнению Менделеева- Клапейрона
Подставим последнее выражение в формулу относительной влажности
Слайд 19Задача.
В сосуде объемом V при температуре Т находится ν молей водяного
Решение:
Относительная влажность
Или выражение через десятичные величины
Из уравнения Менделеева- Клапейрона
( по условию задачи)
Тогда,
Значит,
Слайд 20Задача.
В закрытом сосуде находится воздух при температуре 87°С. Парциальное
давление водяного
воздуха 40%, то абсолютная влажность насыщенного водяного пара при
данной температуре
Решение:
Уравнение состояния идеального газа
Абсолютная влажность
По формуле относительной влажности определяем давление насыщенного пара