- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по физике на тему: Постулаты Бора (2 курс)
Содержание
- 1. Презентация по физике на тему: Постулаты Бора (2 курс)
- 2. ЦЕЛИ УРОКА Обучаящая: Повторить, углубить, и
- 3. ПЛАН УРОКА Повторение изученного материала;Квантовые постулаты Бора;Решение задач; тесты;Самостоятельная работа;Домашняя работа.
- 4. Ученые древности о строении веществаДревнегреческий ученый Демокрит
- 5. Повторение пройденного материалаПервая модель атома была предложена…
- 6. Модель Томсона «Пудинговая модель» Дж. Томсон
- 7. Повторение пройденного материалаОднако модель атома Томсона оказалась
- 8. Повторение пройденного материалаКто на основе своих опытов создал планетарную модель атома?
- 9. Опыт РезерфордаВ 1911 г. Эрнест Резерфорд провёл
- 10. Причины рассеивания α-частиц Электрон,
- 11. Модель РезерфордаОпираясь на классические представления о движении
- 12. Выводы РезерфордаАтом имеет ядро, размеры которого малы
- 13. АтомУстойчиваямикросистемаэлементарных частиц, состоящая из положительно заряженного ядра и электронов, движущихся в околоядерном пространстве.
- 14. Ядро атома состоит из протонов и нейтроновЧисло
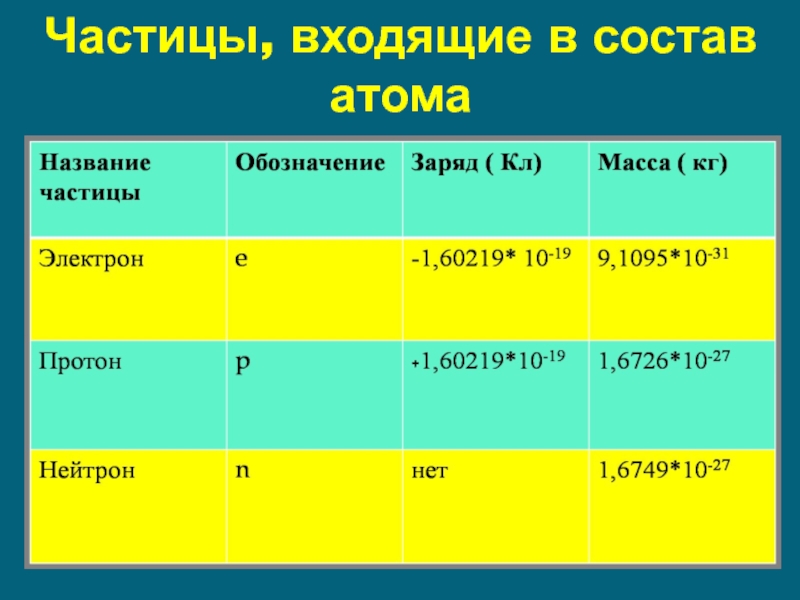
- 15. Частицы, входящие в состав атома
- 16. Слайд 16
- 17. Сколько протонов и нейтронов содержат следующие ядра изотопов :
- 18. Принцип квантования (М. Планк, 1900) Атомы
- 19. Слайд 19
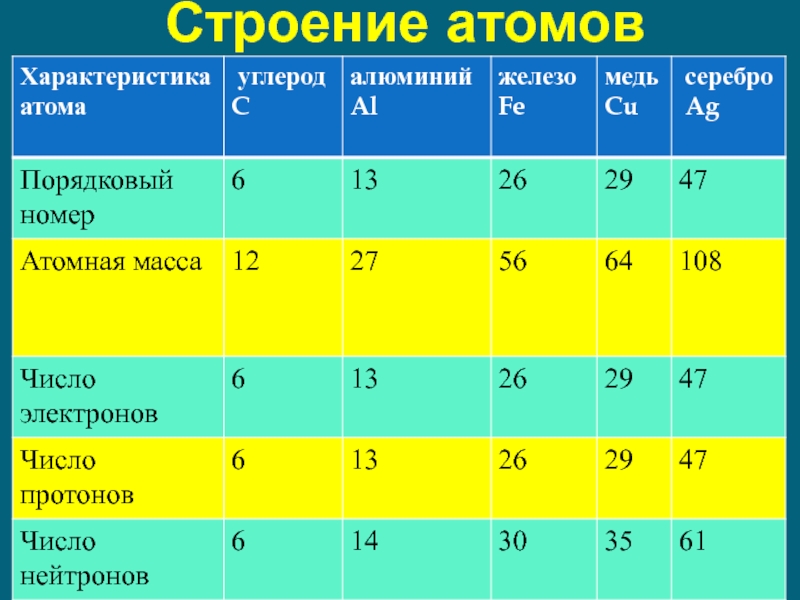
- 20. Строение атомов
- 21. Противоречия Планетарная модель строения атома по Резерфорду
- 22. Нильс Бор - (1885-1962)
- 23. I ПОСТУЛАТ БОРААтомная система может находиться только
- 24. II ПОСТУЛАТ БОРА Излучение
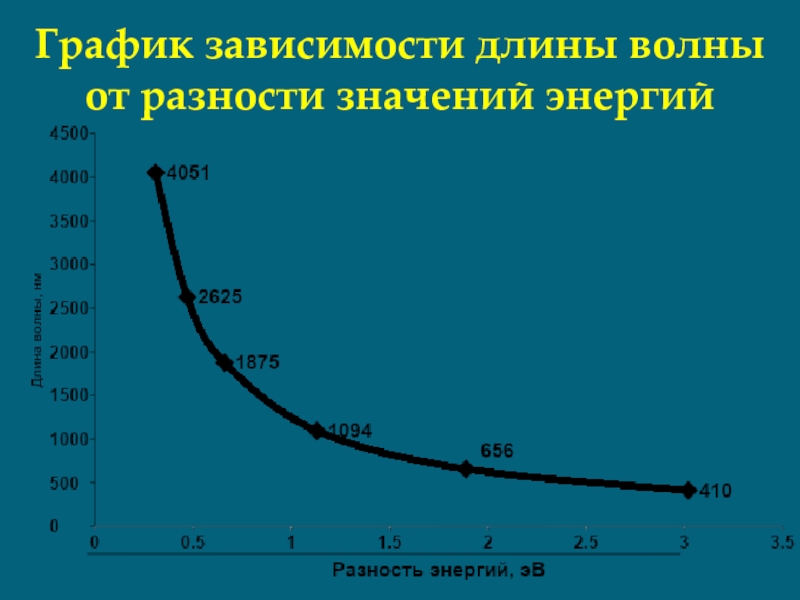
- 25. График зависимости длины волны от разности значений энергий
- 26. Слайд 26
- 27. Спектральные серии водородаСерия Лаймана – открыл в
- 28. СПЕКТРАЛЬНЫЕ СЕРИИ АТОМА ВОДОРОДА
- 29. Частоты каждой серии спектра можно подсчитать по формуле Бальмера-Ритберга:
- 30. Серия Лаймана-ультрафиалетовое излучениеСерия Бальмера-видимое излучениеСерия Пашена- инфракрасное излучение
- 31. Радиусы орбитРадиусы боровских орбит меняются дискретно с
- 32. Упражнение №13Задача №2Определите длину волны света, испускаемого
- 33. Упражнение №13(2)Решение
- 34. Вопрос №1Электрон, связанный с атомом, при переходе
- 35. Вопрос №22. С ростом главного квантового числа
- 36. Вопрос №33. Электрон в атоме водорода перешел
- 37. Вопрос №45. Что с точки зрения планетарной
- 38. Вопрос №5Какие утверждения, приведенные ниже, были бы
- 39. Правильные ответы 1 - А2 - Б3 - В4 - Б5 - В
- 40. Самостоятельная работа1. Какой знак имеет заряд ядра
- 41. Самостоятельная работа 9. Каков заряд фотона?10. Можно
- 42. Домашняя работаПовторить §93; Выучить ; §94, §95;
- 43. Спасибо за урок!!!Не существует ничего, кроме атомов
Слайд 1Квантовые постулаты Бора
ПРЕДМЕТ «ФИЗИКА»
ПРЕЗЕНТАЦИЯ ОТКРЫТОГО УРОКА
Преподаватель:
Косян Анаит Георгиевна
ГБПОУ ВО
Слайд 2
ЦЕЛИ УРОКА
Обучаящая:
Повторить, углубить, и обобщить материал по теме: «Ядерная модель
изучить постулаты Бора, раскрывающие основные свойства атома, их значимость в развитии физической науки. Применять полученные знания при решении задач.
Развивающая:
Развивать логическое мышление, правильную речь, естественнонаучное миропонимание о строении вещества.
Воспитательная:
Воспитывать самостоятельность, ответственность, любознательность, эстетический вкус.
Слайд 3
ПЛАН УРОКА
Повторение изученного материала;
Квантовые постулаты Бора;
Решение задач; тесты;
Самостоятельная работа;
Домашняя работа.
Слайд 4Ученые древности о строении вещества
Древнегреческий ученый Демокрит 2500 лет назад считал,
Долгое время считалось, что атом является неделимой частицей.
Слайд 6
Модель Томсона
«Пудинговая модель»
Дж. Томсон в 1898году предложил модель атома в виде
Слайд 7Повторение пройденного материала
Однако модель атома Томсона оказалась в полном противоречии с
Слайд 9Опыт Резерфорда
В 1911 г. Эрнест Резерфорд провёл следующий опыт.
Пучок α-частиц (полностью
α-частиц отклонялось на углы, большие 900.
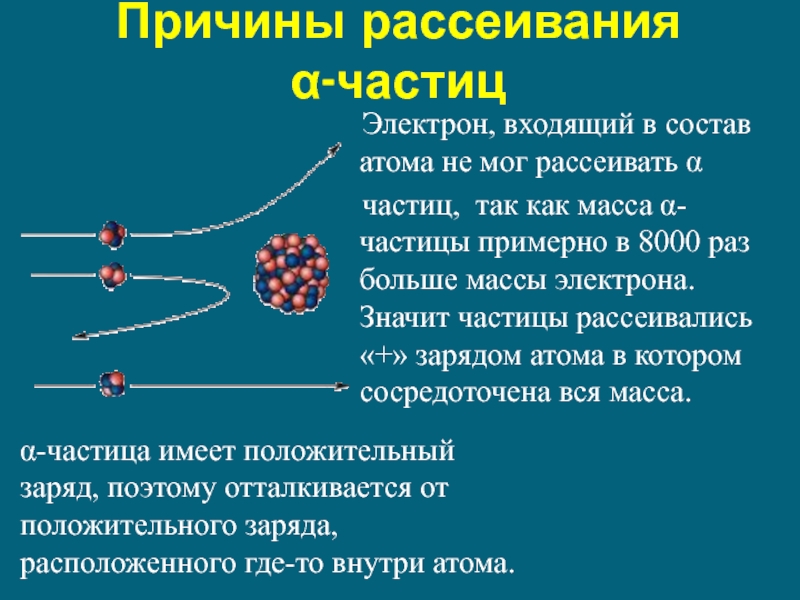
Слайд 10Причины рассеивания
α-частиц
Электрон, входящий в состав атома не
частиц, так как масса α-частицы примерно в 8000 раз больше массы электрона. Значит частицы рассеивались «+» зарядом атома в котором сосредоточена вся масса.
α-частица имеет положительный заряд, поэтому отталкивается от положительного заряда, расположенного где-то внутри атома.
Слайд 11Модель Резерфорда
Опираясь на классические представления о движении микрочастиц, Резерфорд предложил планетарную
Слайд 12Выводы Резерфорда
Атом имеет ядро, размеры которого малы по сравнению с размерами
В ядре сконцентрирована почти вся масса атома.
Отрицательный заряд всех электронов распределен по всему объему атома.
Слайд 13Атом
Устойчивая
микросистема
элементарных частиц, состоящая из положительно заряженного ядра и электронов, движущихся в
Слайд 14
Ядро атома состоит из протонов и нейтронов
Число протонов в ядре равно
Атом в целом нейтрален.
Слайд 18Принцип квантования
(М. Планк, 1900)
Атомы излучают энергию порциями, кратными некоторой
νλ=c
h = 6,626•10-34(Дж•c)
Е = hν
Слайд 21Противоречия
Планетарная модель строения атома по Резерфорду не смогла объяснить ряд
Слайд 22 Нильс Бор - (1885-1962) датский физик, один из
Создал теорию атома, в основу которой легли планетарная модель атома, квантовые представления и предложенные им Бора постулаты. Важные работы по теории металлов, теории атомного ядра и ядерных реакций. Труды по философии, естествознания. Активный участник борьбы против атомной угрозы.
Нобелевская премия (1922).
Слайд 23
I ПОСТУЛАТ БОРА
Атомная система может находиться только в особых стационарных квантовых
В стационарном состоянии атом не излучает.
+
е
Слайд 24
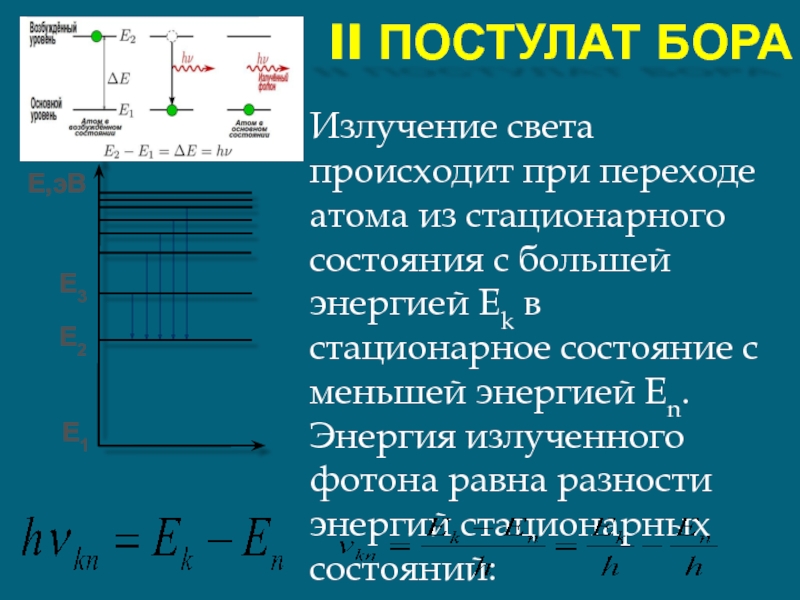
II ПОСТУЛАТ БОРА
Излучение света происходит при переходе атома из
Е1
Е2
Е3
Е,эВ
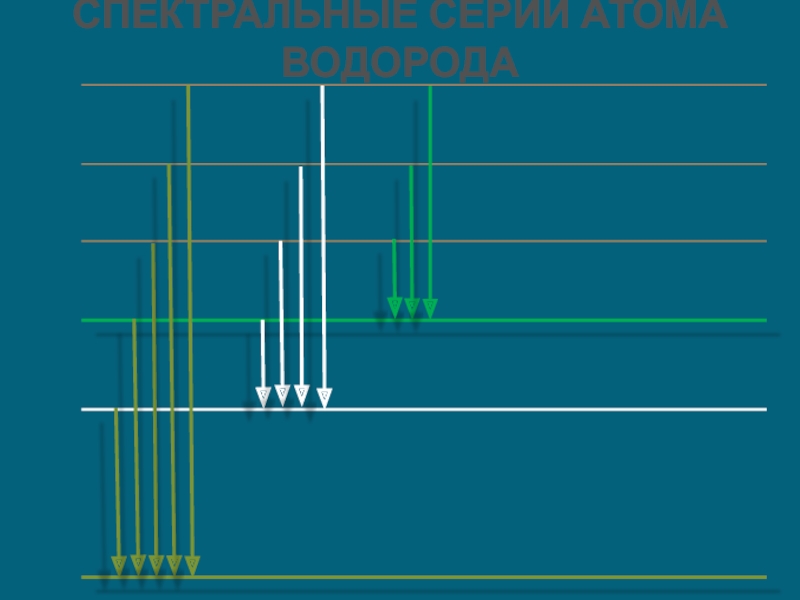
Слайд 27Спектральные серии водорода
Серия Лаймана – открыл в 1906 г. Теодор Лайман.
Данная
первый в спектре излучения и с первого
Уровня на все остальные при поглощении.
Серия Бальмера – открыл в 1885 г. Иоганн Бальмер. Данная серия образуется при
переходах электронов с возбужденных энергетических уровней на второй в спектре излучения и со второго уровня на все вышележащие уровни при поглощении.
Серия Пашена – открыл в 1908 г. Фридрих Пашен.
Данная серия образуется при переходах электронов с возбужденных энергетических уровней на третий в спектре излучения и с третьего уровня на все вышележащие уровни при поглощении.
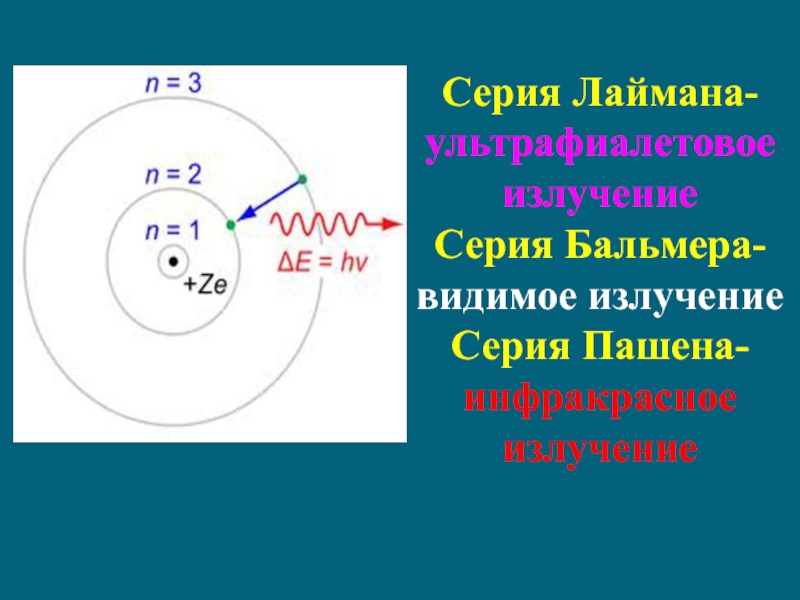
Слайд 30Серия Лаймана-ультрафиалетовое излучение
Серия Бальмера-видимое излучение
Серия Пашена- инфракрасное излучение
Слайд 31Радиусы орбит
Радиусы боровских орбит меняются дискретно с изменением числа n.
Значения электронных
Наименьший радиус орбиты:
Размеры атома определяются квантовыми законами (радиус пропорционален квадрату постоянной Планка). Классическая теория не может объяснить, почему атом имеет размеры порядка 10-8см.
Слайд 32Упражнение №13
Задача №2
Определите длину волны света, испускаемого атомом водорода при его
Е2=-3,4эВ (n=2).
Слайд 34Вопрос №1
Электрон, связанный с атомом, при переходе с более удаленной на
А. Излучает энергию.
Б. Поглощает энергию.
В. Излучает и поглощает энергию.
Проверочный тест
Слайд 35Вопрос №2
2. С ростом главного квантового числа n (энергетического уровня атома)
А. Уменьшается.
Б. Увеличивается.
В. Не изменяется.
Слайд 36Вопрос №3
3. Электрон в атоме водорода перешел с пятого энергетического уровня
А. Увеличилась.
Б. Не изменилась.
В. Уменьшилась.
Слайд 37Вопрос №4
5. Что с точки зрения планетарной модели атома Резерфорда удерживает
А. Ядерные силы.
Б. Кулоновские силы.
В. Центростремительное ускорение.
Слайд 38Вопрос №5
Какие утверждения, приведенные ниже, были бы справедливы, если бы движение
При движении вокруг ядра электрон должен непрерывно излучать электромагнитные волны.
Через короткое время электрон должен упасть на ядро.
Частота электромагнитных волн, испускаемых атомом, должна быть равна частоте обращения электрона вокруг ядра.
А. 1; 2; 3
Б. Только 1
В. Только 1 и 2
Слайд 40Самостоятельная работа
1. Какой знак имеет заряд ядра атома?
2. Во сколько раз
3. Недостатки планетарной модели атома
4. Почему электроны не могут изменить
траекторию частиц в опыте Резерфорда?
5. Дайте определение фотоэффекта.
6. Формула Эйнштейна для фотоэффекта.
7. Энергия фотона равна…
8. Импульс фотона равен…
Слайд 41Самостоятельная работа
9. Каков заряд фотона?
10. Можно ли остановить фотон?
11. Как
12. Сколько квантов с различной энергией может испустить водород, если электрон находится на третьей орбите?
13. Какие серии излучения атома водорода вы знаете?
14. 1 постулат Бора
15. 2 постулат Бора
Слайд 42Домашняя работа
Повторить §93;
Выучить ; §94, §95;
Упражнение 13 № 1;
Задача №1175
(Задачник по физике.
А.П. Рымкевич )
Слайд 43Спасибо за урок!!!
Не существует ничего, кроме атомов и пустоты;
всё остальное
Демокрит
Учитесь у всех, не подражайте никому.
М. Горький