- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по физике на тему Основы МКТ (10 класс)
Содержание
- 1. Презентация по физике на тему Основы МКТ (10 класс)
- 2. ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ1. ВСЕ ТЕЛА СОСТОЯТ ИЗ
- 3. ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ1. ВСЕ ТЕЛА СОСТОЯТ ИЗ
- 4. ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ2. ЧАСТИЦЫ НАХОДЯТСЯ В ПОСТОЯННОМ
- 5. ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ
- 6. ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ
- 7. АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВАВещества могут находиться в различных
- 8. АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВАВ газах частицы (молекулы, атомы) находятся
- 9. СКОРОСТЬ ЧАСТИЦ ВЕЩЕСТВА1920 год - впервые были экспериментально определены скорости частиц вещества Отто Штерн (1888-1969)
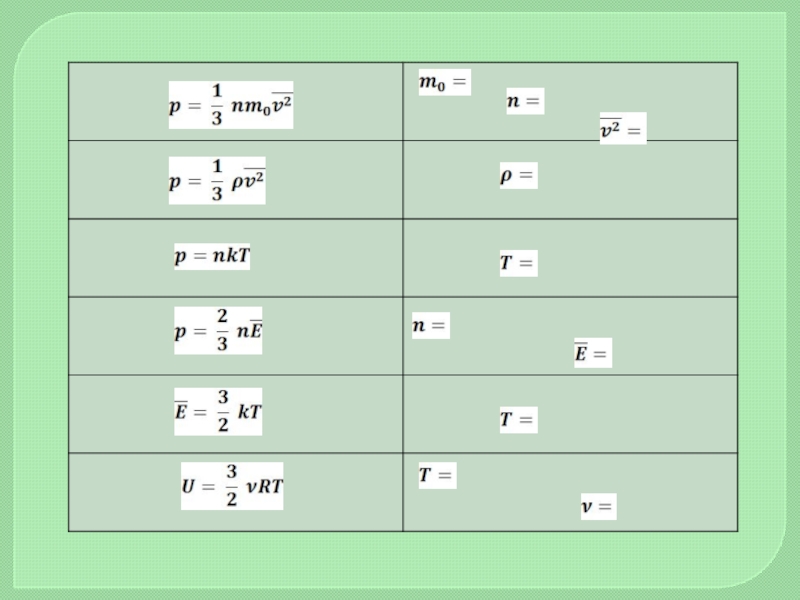
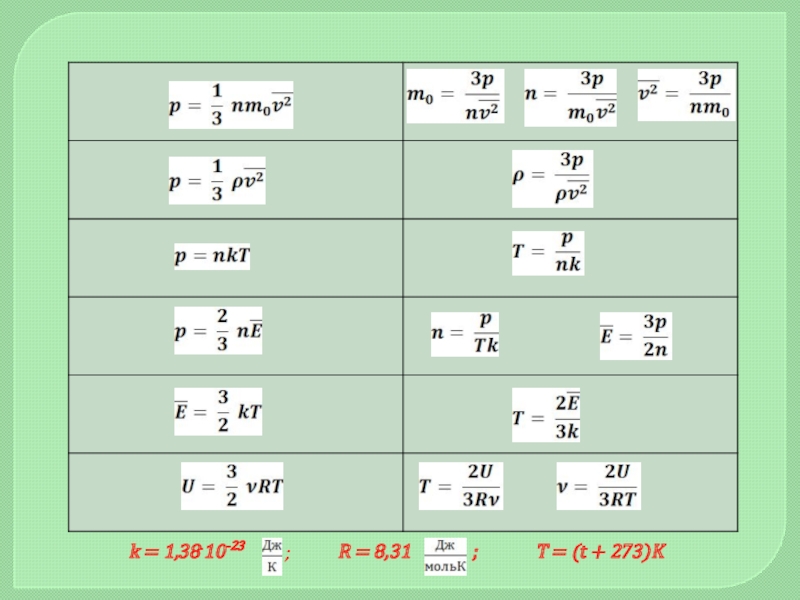
- 10. Основная задача МКТ – вывести уравнение состояния
- 11. Постоянная Авогадро численно равна количеству частиц, содержащихся
- 12. Слайд 12
- 13. Основные отличия идеального газа от реального газа:
- 14. Идеальный газ. Основное уравнение МКТ
- 15. ТЕМПЕРАТУРАГазовый термометр с постоянным объемом Зависимость давления
- 16. ТЕМПЕРАТУРАПостоянная Больцмана связывает температуру со средней кинетической
- 17. Слайд 17
- 18. k = 1,38.10-23
Слайд 2ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ
1. ВСЕ ТЕЛА СОСТОЯТ ИЗ МЕЛЬЧАЙШИХ ЧАСТИЦ – АТОМОВ
Молекула — наименьшая частица какого-либо сложного вещества — может состоять из одинаковых или различных атомов. Причем число атомов в ней бывает от двух до десятков тысяч. Например, в молекул газа водорода два атома водорода, а в молекуле глюкозы (фруктовый сахар) 24 атома (12 атомов водорода, по 6 атомов углерода и кислорода)
Главной молекулой живой природы по праву считается молекула ДНК (дезоксирибонуклеиновая кислота). Она передает из поколения в поколение наследственные признаки.
В 1647 году француз П. Гассенди высказал предположение, что атомы объединяются в небольшие группы, для которых он же придумал название — «молекулы» (уменьшительное от лат. moles — масса). «Молекула» — в буквальном переводе «массочка».
Слайд 3ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ
1. ВСЕ ТЕЛА СОСТОЯТ ИЗ МЕЛЬЧАЙШИХ ЧАСТИЦ – АТОМОВ
Размеры атомов — примерно стомиллионная доля сантиметра (10–8 см). Ядро атома в десятки тысяч раз меньше самого атома.
Чтобы представить разницу в размерах атома и его ядра, мысленно увеличим диаметр ядра атома водорода до 1 см. Размер всего атома в 100 000 раз больше, поэтому в нашем примере диаметр атома будет 100 000 сантиметров, или 1 километр! Атом в основном пустой! Но эта пустота в очень-очень малом объеме.
Демокрит (IV-V вв. до н.э.) был первым из тех, кто догадался о существовании атомов
В 1910 году английский физик Эрнест Резерфорд предложил планетарную модель атома.
Слайд 4ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ
2. ЧАСТИЦЫ НАХОДЯТСЯ В ПОСТОЯННОМ ХАОТИЧЕСКОМ ДВИЖЕНИИ
Диффузия – явление,
С ростом температуры скорость частиц вещества увеличивается, поэтому хаотическое движение частиц принято называть тепловым.
Броуновское движение – скачкообразное перемещение взвешенных в воде мелких крупинок под ударами молекул воды.
Слайд 5ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ
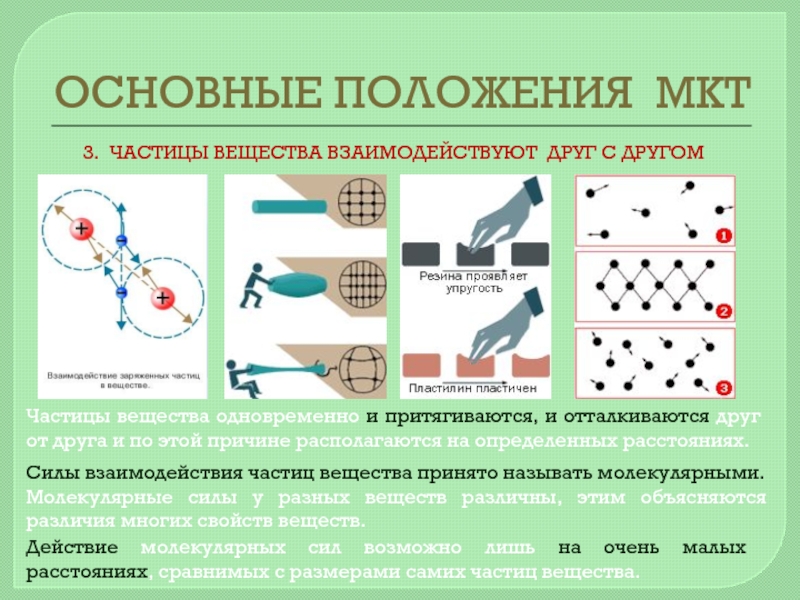
Силы взаимодействия частиц вещества принято называть молекулярными.
Молекулярные силы у разных веществ различны, этим объясняются различия многих свойств веществ.
Действие молекулярных сил возможно лишь на очень малых расстояниях, сравнимых с размерами самих частиц вещества.
Частицы вещества одновременно и притягиваются, и отталкиваются друг от друга и по этой причине располагаются на определенных расстояниях.
Слайд 6ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ
2. ЧАСТИЦЫ НАХОДЯТСЯ В ПОСТОЯННОМ ХАОТИЧЕСКОМ ДВИЖЕНИИ
1. ВСЕ ТЕЛА СОСТОЯТ ИЗ МЕЛЬЧАЙШИХ ЧАСТИЦ – АТОМОВ И МОЛЕКУЛ
Слайд 7АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВА
Вещества могут находиться в различных агрегатных состояниях – твердом,
Молекулярные силы в различных агрегатных состояниях различны: в твердом состоянии они наибольшие, а в газообразном – наименьшие.
Различием молекулярных сил объясняются свойства, которые проявляются в разных агрегатных состояниях:
твердые тела сохраняют объем и форму,
жидкости текучи, но сохраняют объем,
газы полностью занимают весь предоставленный им объем.
В зависимости от условий одно и тоже вещество находится в каком-либо из них. Например, лед, вода и водяной пар. Воздух в вашей комнате — газ, но если его охладить до -193°C, он станет жидкостью, а если охладить до -213°C — твердым телом
Слайд 8АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВА
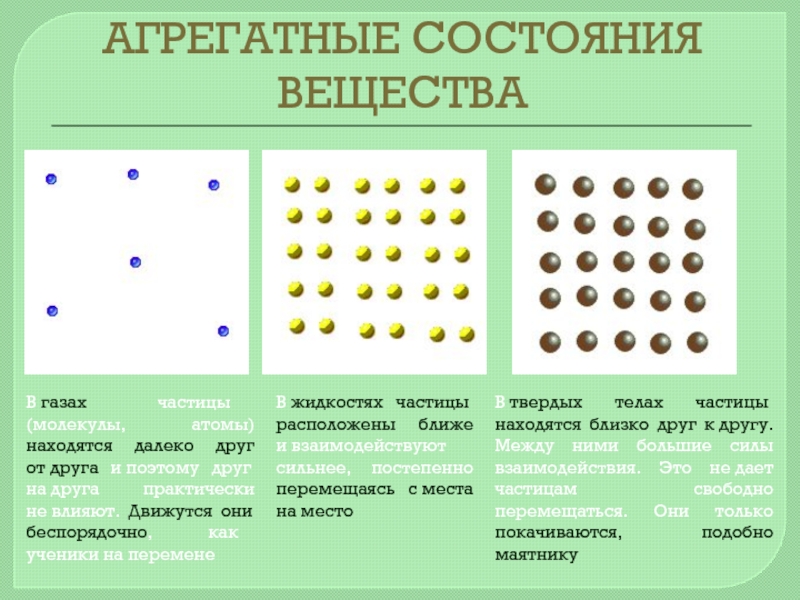
В газах частицы (молекулы, атомы) находятся далеко друг от друга и поэтому
В жидкостях частицы расположены ближе и взаимодействуют сильнее, постепенно перемещаясь с места на место
В твердых телах частицы находятся близко друг к другу. Между ними большие силы взаимодействия. Это не дает частицам свободно перемещаться. Они только покачиваются, подобно маятнику
Слайд 9СКОРОСТЬ ЧАСТИЦ ВЕЩЕСТВА
1920 год - впервые были экспериментально определены скорости частиц
Отто Штерн (1888-1969)
Слайд 10Основная задача МКТ – вывести уравнение состояния вещества, установив связь между
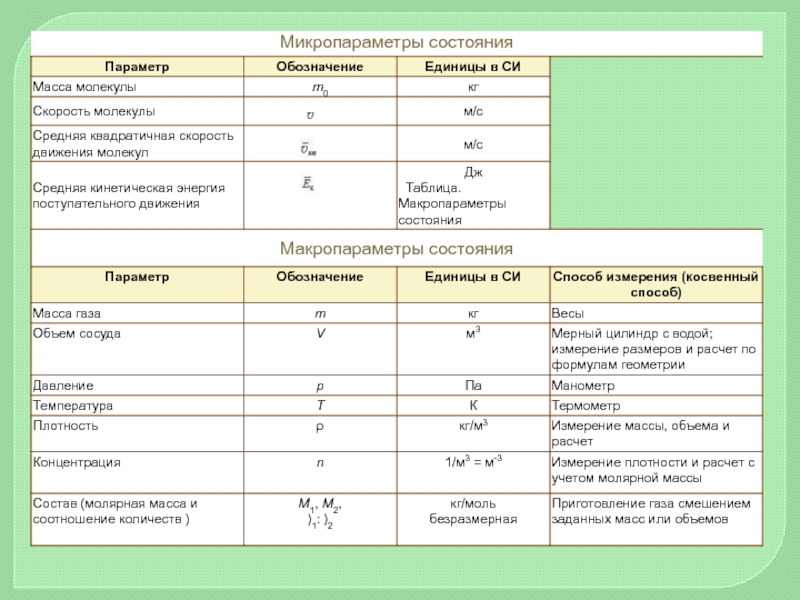
Величины, характерезующие свойства отдельных молекул вещества – микроскопические параметры.
Величины, характерезующие состояния макроскопических тел в целом – макроскопические параметры.
МАКРОСКОПИЧЕСКИЕ И МИКРОСКОПИЧЕСКИЕ ПАРАМЕТРЫ
Слайд 11Постоянная Авогадро численно равна количеству частиц, содержащихся в 1 моле любого
Концентрация (n) показывает, сколько частиц содержится в единице объема (чаще всего - в одном кубическом метре) данного вещества
Масса 1 моля вещества называется молярной массой (М). Численное значение молярной массы, выраженной в г/моль, равно значению относительной атомной или молекулярной массы
1 моль - это количество вещества, в котором содержится столько же частиц, сколько атомов содержится в 12 граммах углерода
Слайд 13Основные отличия идеального газа от реального газа:
1. Частицы идеального газа
Это уравнение устанавливает связь между давлением идеального газа, массой молекулы, концентрацией молекул, средним значением квадрата скорости и средней кинетической энергией - основное уравнение молекулярно-кинетической теории газов.
Идеальный газ. Основное уравнение МКТ
Слайд 15ТЕМПЕРАТУРА
Газовый термометр с постоянным объемом
Зависимость давления газа от температуры при
Тепловым или термодинамическим равновесием называют такое состояние, при котором все макроскопические параметры в системе сколь угодно долго остаются неизменными.
При тепловом равновесии: меняются положения молекул, их скорости при столкновениях. В системе тел, находящейся в состоянии термодинамического равновесия, объемы и давления могут быть различными, а температуры обязательно одинаковы.
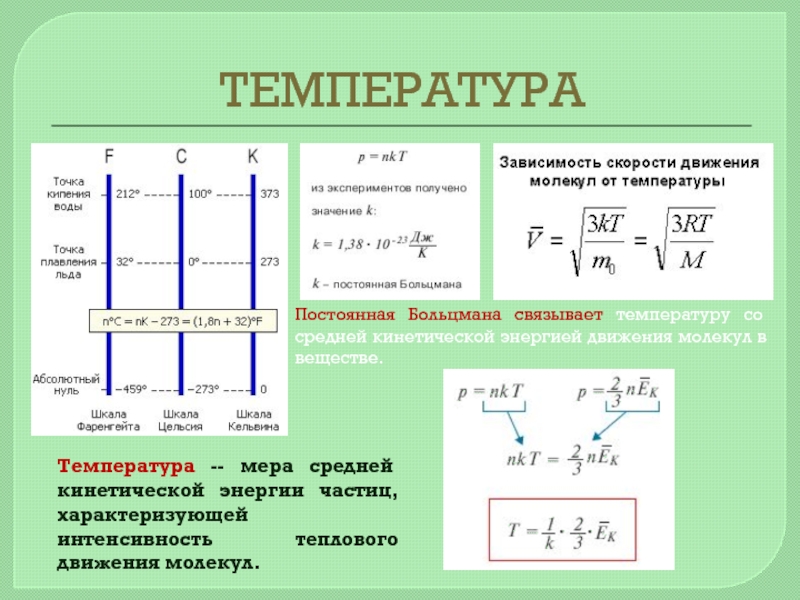
Температура характеризует состояние термодинамического равновесия изолированной системы тел
Слайд 16ТЕМПЕРАТУРА
Постоянная Больцмана связывает температуру со средней кинетической энергией движения молекул в
Температура -- мера средней кинетической энергии частиц, характеризующей интенсивность теплового движения молекул.