- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по физике на тему Масса молекул.Размеры молекул (10 класс)
Содержание
- 1. Презентация по физике на тему Масса молекул.Размеры молекул (10 класс)
- 2. Основные понятия молекулярно-кинетической теории– Относительная молекулярная масса;– количество вещества;– постоянная Авогадро;– молярная масса.
- 3. Так как массы молекул очень малы, удобно
- 4. Основные понятия молекулярно-кинетической теорииМассу частицы, измеренную в
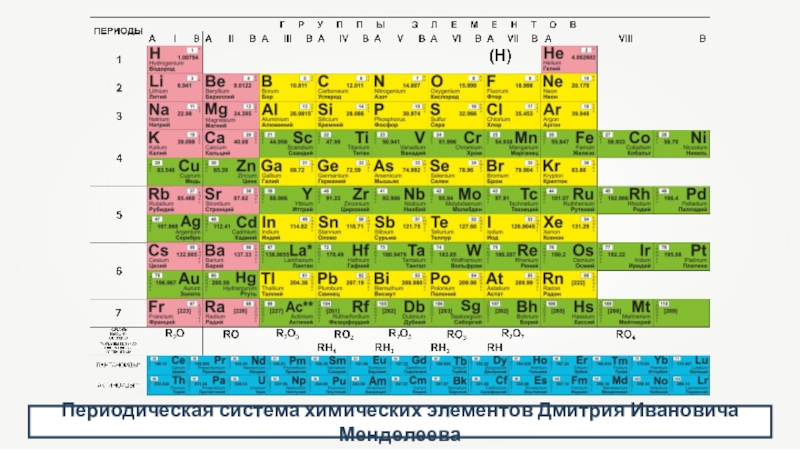
- 5. Периодическая система химических элементов Дмитрия Ивановича Менделеева
- 6. Основные понятия молекулярно-кинетической теорииОтносительная молекулярная масса молекулы
- 7.
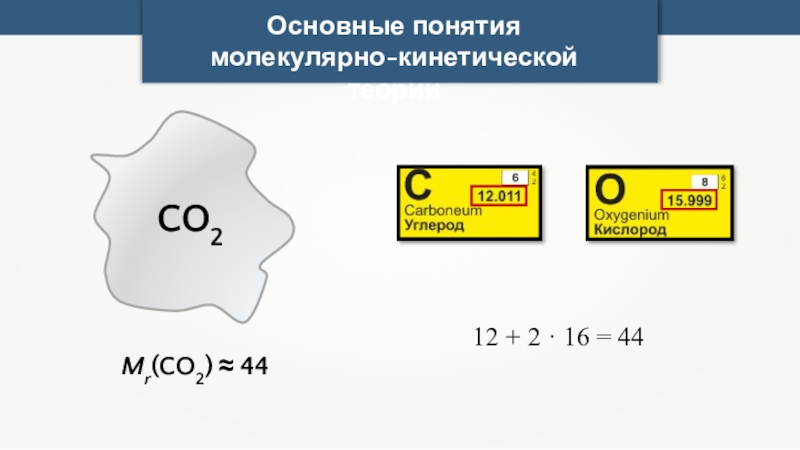
- 8. Основные понятия молекулярно-кинетической теорииCO2Mr(CO2) ≈ 4412 + 2 · 16 = 44
- 9.
- 10. 1 моль равен количеству вещества, в котором
- 11. Амедео Авогадро1776–1856 гг. Число Авогадро — число
- 12. Масса одного атома углерода: m0C = 1,995 · 10-23 кг. Число Авогадро
- 13. Количество вещества равно отношению числа частиц в
- 14. Если два разных тела состоят из одного
- 15. Молярная масса (M) равна массе вещества, взятого в количестве 1 моль.
- 16. Периодическая система химических элементов Дмитрия Ивановича Менделеева
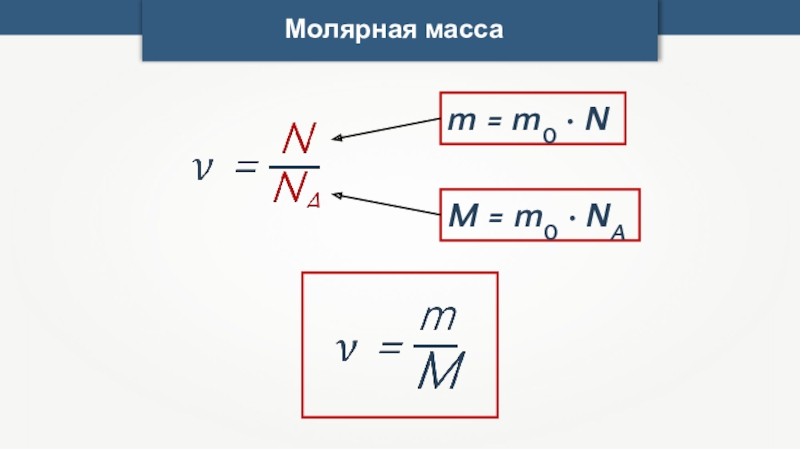
- 17. Молярная масса
- 18. Молярная масса
- 19. Молярная массаДля молекул более сложного состава при
- 20. Молярная массаm0 — масса одной молекулы вещества.M
- 21. Молярная масса M = m0 · NAm = m0 · N
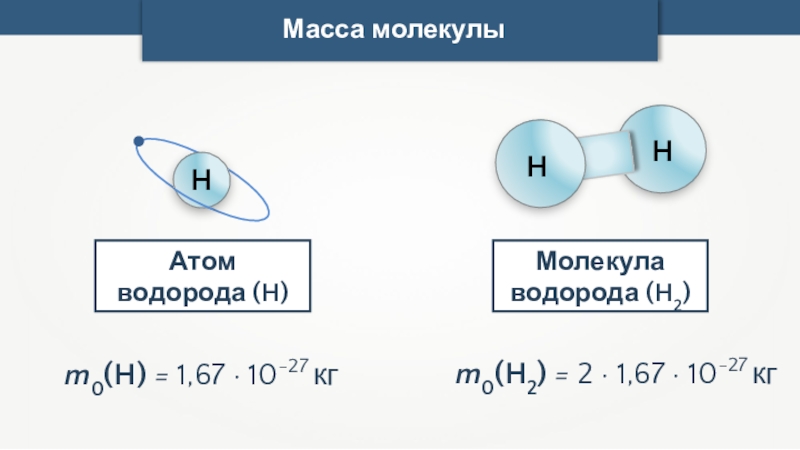
- 22. Масса молекулы (m0) может быть рассчитана на основе молярной массы (M) и числа Авогадро (NA).Масса молекулы
- 23. Масса молекулыМолекула водорода (H2)m0(H) = 1,67 ·
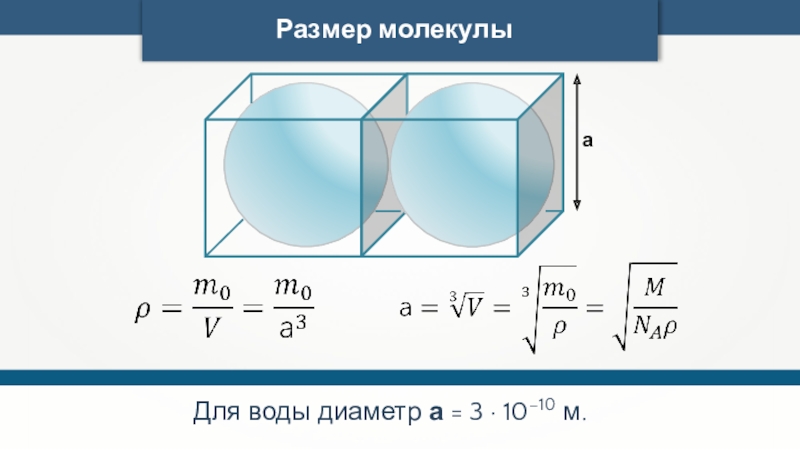
- 24. Размер молекулыа Для воды диаметр а = 3 · 10–10 м.
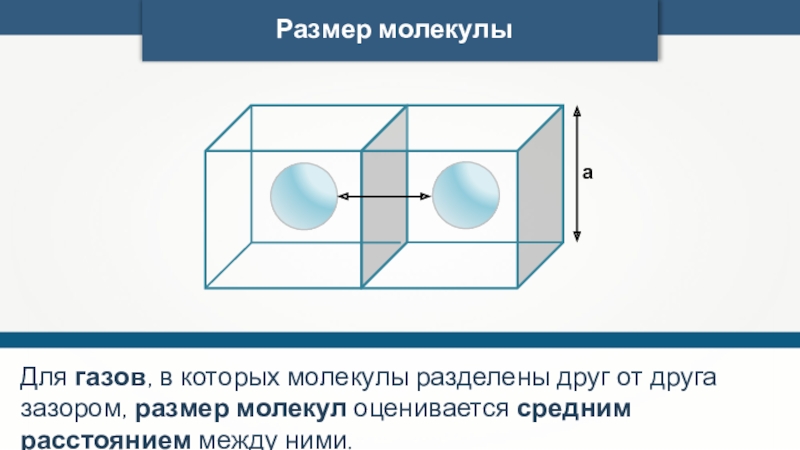
- 25. Размер молекулыаДля газов, в которых молекулы разделены
- 26. Концентрация (?) показывает, сколько частиц содержится в единице объёма данного вещества.
- 27. Определите молярную массу воды (H2O).Дано:Найти: M(H2O) =
- 28. Какое количество вещества содержится в воде массой
Слайд 2
Основные понятия
молекулярно-кинетической теории
– Относительная молекулярная масса;
– количество вещества;
– постоянная Авогадро;
–
Слайд 3
Так как массы молекул очень малы, удобно использовать в расчётах не
Слайд 4
Основные понятия
молекулярно-кинетической теории
Массу частицы, измеренную
в а.е.м. (атомная единица массы),
Слайд 6
Основные понятия
молекулярно-кинетической теории
Относительная молекулярная масса молекулы вещества равна сумме относительных
Слайд 10
1 моль равен количеству вещества, в котором содержится столько же атомов
NA — число Авогадро
Слайд 11
Амедео Авогадро
1776–1856 гг.
Число Авогадро — число молекул в одном моле
Слайд 13
Количество вещества равно отношению числа частиц
в теле к числу Авогадро
(числу молекул в 1 моле вещества).
Слайд 14
Если два разных тела состоят из одного и того же числа
6 · 1023 частиц
6 · 1023 частиц
Слайд 19
Молярная масса
Для молекул более сложного состава при расчёте учитывается число атомов
CO2
Слайд 20
Молярная масса
m0 — масса одной молекулы вещества.
M = m0 · NA
m
m = m0 · N
Слайд 22
Масса молекулы (m0) может быть рассчитана на основе молярной массы (M)
Масса молекулы
Слайд 23
Масса молекулы
Молекула водорода (H2)
m0(H) = 1,67 · 10-27 кг
H
Атом водорода
m0(H2) = 2 · 1,67 · 10-27 кг
Слайд 25
Размер молекулы
а
Для газов, в которых молекулы разделены друг от друга зазором,
Слайд 27
Определите молярную массу воды (H2O).
Дано:
Найти: M(H2O) = ?
Решение:
Mr(H2O) = 2 ·
Слайд 28
Какое количество вещества содержится в воде массой 200 г?
Дано:
Найти: ? =
Решение:
Ответ: ? = 11,1 моль.
СИ
0,2 кг