- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по физике для 1 курса на тему: Молекулярно-кинетическая теория. Основные понятия.
Содержание
- 1. Презентация по физике для 1 курса на тему: Молекулярно-кинетическая теория. Основные понятия.
- 2. Свойства вещества, которые обусловлены его молекулярным строением,
- 3. Цель молекулярно-кинетической теории – объяснение свойств макроскопических
- 4. Основная задача МКТОсновная задача молекулярно-кинетической теории –
- 5. Все вещества состоят из молекул и атомов.
- 6. Слайд 6
- 7. Наиболее убедительными доказательствами реального существования молекул являются броуновское движение и диффузия.Броуновское движение
- 8. Это явление открыто Р. Броуном в 1827 г., когда
- 9. Объяснить броуновское движение невозможно, если не предположить,
- 10. ДиффузияКак объясняется диффузия? Частицы веществ (например, краски
- 11. Исторические сведения
- 12. Еще задолго до нашей эры, в период
- 13. Древнегреческие философы Анаксагор и Демокрит (в IV
- 14. Взаимодействуют атомы давлением и ударом. Воззрения Демокрита,
- 15. Атомисты считали, что разнообразие веществ, имеющихся в
- 16. Эпоха средневековья не продвинула вперед учение об
- 17. Этим вращательным движением Ломоносов объяснил тепловые явления.
- 18. Рисунки М. В. ЛомоносоваМолекулярно-кинетические представления были развиты
- 19. Современные научные исследования в молекулярной физике
- 20. Каждое из положений МКТ строго доказано исследовательским
- 21. Платина в электронном микроскопеМолекулы нафталина в ионном
- 22. Сканирующий электронно-ионный микроскоп.Ионный микроскоп JEM-ARM200FИонный микроскоп - электронно-оптический
- 23. Сканирующий зондовый микроскоп.Предназначен для решения исследовательских и
- 24. Основные понятия молекулярной физики
- 25. Макроскопические тела (от греч. «макрос» – большой) -
- 26. Существование жидкостей и твёрдых тел, газовАгрегатное состояние —
- 27. Изменения агрегатного состояния - термодинамические процессы, называемые
- 28. Молекула — мельчайшая устойчивая частица вещества, сохраняющая его
- 29. Измерение диаметра молекулы
- 30. Размеры молекул и атомов чрезвычайно малы. Так,
- 31. Масса нейтрона mn = 1,674929∙10-27 кг масса
- 32. Масса произвольного атома может быть выражена в
- 33. Количеством вещества ν (ню) называется физическая величина,
- 34. Молярная массаМасса вещества m связана с его
- 35. Слайд 35
- 36. Постоянная АвогадроАмедео АвогадроИтальянский физик и химик9 августа
- 37. Подведём итоги.Для решения задач молекулярной физики необходимо
- 38. Спасибо за внимание
Слайд 1Молекулярно - кинетическая
теория. Основные понятия
ГБПОУ КДПИ им. К Фаберже
Преподаватель физики
Костенкова С.С.
Слайд 2 Свойства вещества, которые обусловлены его молекулярным строением, изучает
Молекулярная физика – раздел
При этом мы исключаем из рассмотрения те явления, которые связаны с изменением состава, перестройкой молекул, что является в значительной степени областью химии.
МОЛЕКУЛЯРНАЯ ФИЗИКА
Слайд 3Цель молекулярно-кинетической теории – объяснение свойств макроскопических тел и закономерностей тепловых
Основой молекулярной физики является
Молекулярно-кинетическая теория
строения вещества
(МКТ)
Слайд 4Основная задача МКТ
Основная задача молекулярно-кинетической теории – установить связь между микроскопическими
Например, зная массы молекул, их средние скорости и концентрацию, найти объём, давление и температуру данной массы газа. Или выразить давление газа через его объём и температуру.
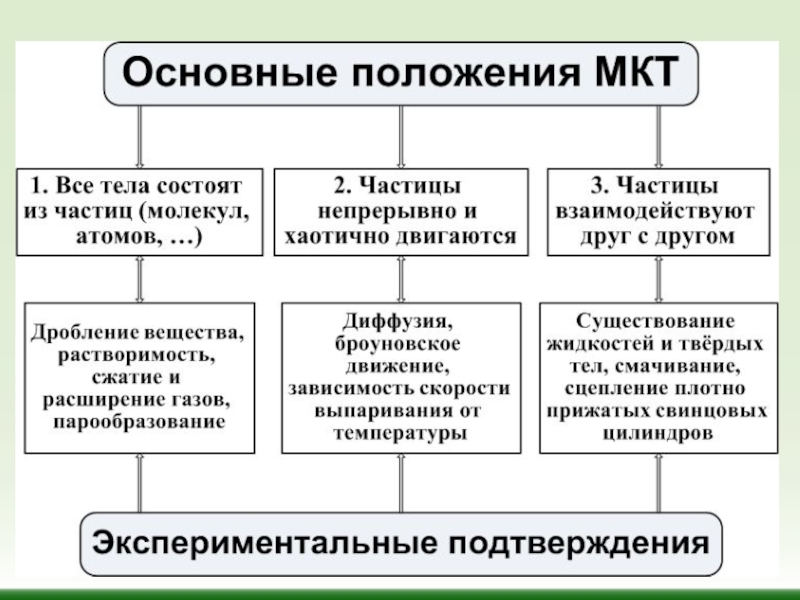
Слайд 5Все вещества состоят из молекул и атомов. Молекула – наименьшая электро-нейтральная
Молекулы и атомы всех веществ находятся в непрерывном хаотическом движении, называемом тепловым. Интенсивность этого движения возрастает с повышением температуры.
3.Молекулы (атомы) взаимодействуют между собой. Между ними действуют силы притяжения и отталкивания.
Основные положения МКТ
В основе МКТ лежат три утверждения:
Слайд 7Наиболее убедительными доказательствами реального существования молекул являются броуновское движение и диффузия.
Броуновское
Слайд 8Это явление открыто Р. Броуном в 1827 г., когда он проводил исследования пыльцы
Неожиданно Броун увидел, что мельчайшие твёрдые крупинки, которые едва можно было разглядеть в капле воды, непрерывно дрожат и передвигаются с места на место. Он установил, что эти движения, по его словам, «не связаны ни с потоками в жидкости, ни с её постепенным испарением, а присущи самим частичкам». Наблюдение Броуна подтвердили другие учёные. Мельчайшие частички вели себя, как живые, причем «танец» частиц ускорялся с повышением температуры и с уменьшением размера частиц и явно замедлялся при замене воды более вязкой средой. Это удивительное явление никогда не прекращалось: его можно было наблюдать сколь угодно долго.
Clarkia pulchella
Интересуясь, как пыльца участвует в процессе оплодотворения, он разглядывал под микроскопом выделенные из клеток пыльцы североамериканского растения Clarkia pulchella (кларкии хорошенькой) взвешенные в воде удлинённые цитоплазматические зерна.
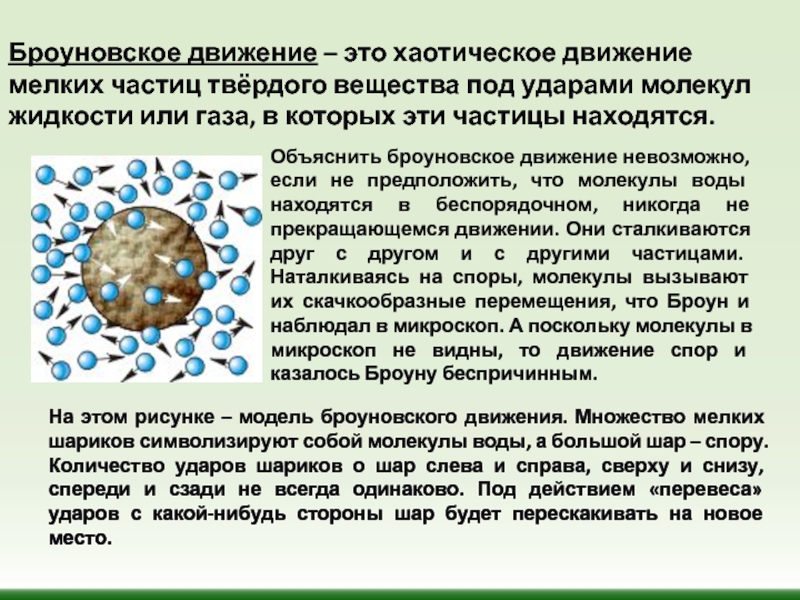
Слайд 9Объяснить броуновское движение невозможно, если не предположить, что молекулы воды находятся
На этом рисунке – модель броуновского движения. Множество мелких шариков символизируют собой молекулы воды, а большой шар – спору. Количество ударов шариков о шар слева и справа, сверху и снизу, спереди и сзади не всегда одинаково. Под действием «перевеса» ударов с какой-нибудь стороны шар будет перескакивать на новое место.
Броуновское движение – это хаотическое движение мелких частиц твёрдого вещества под ударами молекул жидкости или газа, в которых эти частицы находятся.
Слайд 10Диффузия
Как объясняется диффузия?
Частицы веществ (например, краски и воды), беспорядочно двигаясь,
Запах духов или бензина довольно быстро распространяется по комнате или гаражу. Так происходит потому, что духи и бензин испаряются – переходят в газообразное состояние, а диффузия в газах происходит быстро: за секунды-минуты. Заметно медленнее диффузия протекает в жидкостях: за недели-месяцы, а в твёрдых телах – очень медленно: за годы-столетия.
В тёплой комнате диффузия протекает быстрее.
Явление самопроизвольного проникновения частиц одного вещества в другое вещество принято называть диффузией.
Слайд 12Еще задолго до нашей эры, в период расцвета древних культур, возникло
Одна из древнеиндийских философских школ учила, что вечные части вселенной состоят из четырех элементов: воды, земли, огня и воздуха. Частички этих элементов вечны и несотворимы.
Слайд 13Древнегреческие философы Анаксагор и Демокрит (в IV веке до нашей эры)
считали, что любое вещество состоит из мельчайших неделимых частиц.
Анаксагор учил о вечных элементах мира, «семенах» (или «гомеомериях»), которые включают в себя всю полноту мировых качеств и управляются космическим Умом.
Гомеомерии Анаксагора не похожи и на атомы в нашем смысле, то есть на простые химические элементы, потому что в числе их у него приведены, между прочим, мясо, дерево и т. п.
«Гомеомерии», «семена вещей», вначале были в беспорядке смешаны и образовывали хаос.
Мировой «ум» — тончайшее и легчайшее вещество — приводит их в движение и упорядочивает: неоднородные элементы отделяются друг от друга, а однородные соединяются — так возникают вещи.
Слайд 14Взаимодействуют атомы давлением и ударом.
Воззрения Демокрита, весьма далекие от современных,
Эту идею поддержали и развили Левкипп и Демокрит. Согласно их учению, существуют только атомы и пустота (атом — греческое слово, означающее «неделимый»). Атомов бесконечное множество, и они бесконечно различны по форме, но качественного различия атомов не существует.
Слайд 15Атомисты считали, что разнообразие веществ, имеющихся в природе, объясняется не разнообразием
Атомы невидимы и не обнаружимы в отдельности только вследствие своей чрезвычайной малости. Именно в силу этого огромная совокупность атомов, образующая твердое или жидкое тело, внушает нам представление о непрерывности этих тел. Атомы находятся в непрерывном движении, соединения их могут распадаться, превращаясь в другие соединения, что и объясняет наблюдаемые нами превращения веществ (теперь мы называем такие перестройки молекул химическими превращениями вещества).
Слайд 16Эпоха средневековья не продвинула вперед учение об атомах и молекулах. В
Ряд высказываний, предвосхитивших некоторые положения молекулярной теории, принадлежат Ньютону (например, представления о кристаллической решетке, межмолекулярных силах и т. д. )
Слайд 17Этим вращательным движением Ломоносов объяснил тепловые явления. Он утверждал, что «должна
Большой шаг вперед в развитии молекулярно-кинетической теории был сделан великим русским ученым Михаилом Васильевичем Ломоносовым в середине XVIII в. Ломоносов сформулировал молекулярную гипотезу, основные черты которой весьма близки к современным воззрениям.
Согласно Ломоносову, частицы вещества, атомы или корпускулы — это шарики с шероховатыми поверхностями. Шарики беспорядочно двигаются, сталкиваются между собой и благодаря шероховатым поверхностям получают при столкновениях вращательное движение.
Слайд 18Рисунки М. В. Ломоносова
Молекулярно-кинетические представления были развиты Ломоносовым довольно глубоко, но
Гей-Люссак, Дальтон, Авогадро опытным путем установили основные газовые законы.
Слайд 20Каждое из положений МКТ строго доказано исследовательским путём. Реальное существование молекул
С помощью электронного микроскопа, дающего увеличение в сотни тысяч раз, удалось наблюдать и сфотографировать отдельные крупные органические молекулы.
Электронный микроскоп
Слайд 21Платина в электронном микроскопе
Молекулы нафталина в ионном микроскопе
Изображение предварительно отполированной, а
Слайд 22Сканирующий электронно-ионный микроскоп.
Ионный микроскоп JEM-ARM200F
Ионный микроскоп - электронно-оптический прибор, в котором изображение
Слайд 23Сканирующий зондовый микроскоп.
Предназначен для решения исследовательских и аналитических
задач в области нано-технологий.
Латексные
Изображение получено с помощью сканирующего зондового микроскопа в режиме атомно-силового микроскопа. Средний диаметр сфер порядка 94 нм.
Слайд 25Макроскопические тела (от греч. «макрос» – большой) - это все тела, которые
При макроскопическом подходе к изучению тел нас интересуют их макропараметры: их размеры, объёмы, массы, энергии и т.д.
При микроскопическом подходе нас интересуют микропараметры: размеры, объём, масса, энергия молекул, ионов и атомов.
МКТ объясняет явления и свойства тел с точки зрения их микроскопического строения.
Слайд 26Существование жидкостей и твёрдых тел, газов
Агрегатное состояние — состояние вещества, характеризующееся определёнными свойствами
Выделяют три основных агрегатных состояния:
твёрдое тело, жидкость и газ.
Существуют и другие агрегатные состояния, например, жидкие кристаллы.
Твёрдое тело - состояние, характеризующееся способностью сохранять объём и форму. Атомы твёрдого тела совершают лишь небольшие колебания вокруг состояния равновесия.
Жидкость - состояние вещества, при котором оно обладает малой сжимаемостью, то есть хорошо сохраняет объём, однако неспособно сохранять форму. Атомы или молекулы жидкости совершают колебания вблизи состояния равновесия, и часто перескакивают на другие свободные места.
Газ – состояние, характеризующееся хорошей сжимаемостью, отсутствием способности сохранять как объём, так и форму.
Слайд 27
Изменения агрегатного состояния - термодинамические процессы, называемые фазовыми переходами.
Выделяют следующие
из твёрдого в жидкое – плавление;
из жидкого в газообразное – испарение и кипение;
из твёрдого в газообразное – сублимация;
из газообразного в жидкое или твёрдое – конденсация.
Плазму выделяют в особое агрегатное состояние вещества в связи с тем, что заряженные частицы плазмы, в отличие от нейтральных молекул обычного газа, взаимодействуют друг с другом на больших расстояниях. Этим объясняется ряд своеобразных свойств плазмы.
Слайд 28Молекула — мельчайшая устойчивая частица вещества, сохраняющая его основные химические свойства.
Молекулы, образующие
Молекулы состоят из более мелких частиц — атомов.
Масса и размеры атомов и молекул
Атомы — мельчайшие частицы химического элемента, сохраняющие его химические свойства.
Число различных атомов сравнительно невелико и равно числу химических элементов (116) и их изотопов (около 1500).
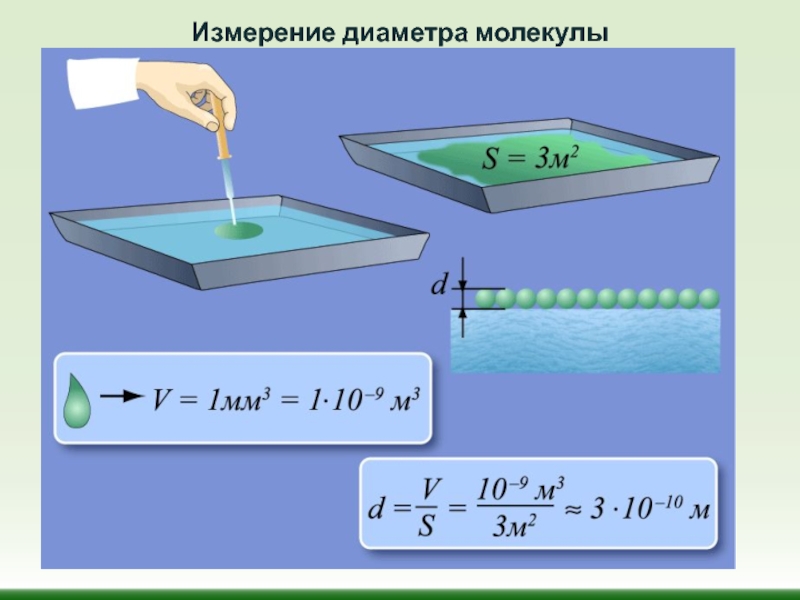
Слайд 30Размеры молекул и атомов чрезвычайно малы. Так, линейные размеры молекул кислорода
Соответственно, чрезвычайно малы и массы атомов и молекул. Поэтому для решения задач молекулярной физики вместо собственно масс атомов и молекул используют их относительные величины, сравнивая массу атома или молекулы с 1/12 массы атома изотопа Карбона (углерода)
Это сравнение было принято в 1961 г. по предложению Международного союза теоретической и прикладной химии (International Union of Pure and Applied Chemistry, в 1960 г. с таким же предложением выступал Международный союз теоретической и прикладной физики). Такой выбор обусловлен тем, что Карбон входит в состав многих химических соединений.
Слайд 31Масса нейтрона mn = 1,674929∙10-27 кг
масса протона mp = 1,672623∙10-27
В ядре атома углерода содержится 12 нуклонов. Массы нейтрона и протона примерно равны. Поэтому в качестве единицы массы удобно использовать среднюю массу нуклона в атоме определённого химического элемента.
Атомная единица массы (а.е.м., она же «дальтон») – средняя масса нуклона в атоме углерода
Атомная единица массы равна 1/12 массы атома углерода
Слайд 32Масса произвольного атома может быть выражена в атомных единицах массы или
Относительная атомная масса Ar - число атомных единиц массы, содержащихся в массе атома.
Относительная атомная масса почти совпадает с числом нуклонов в его ядре: Ar ≈ A. (A = Z + N)
Относительная молекулярная масса Mr – это отношение массы молекулы к 1/12 массы атома Карбона (углерода) mc
Слайд 33Количеством вещества ν (ню) называется физическая величина, определяющая число молекул (или
Количество вещества
Для определения количества вещества в теле сравнивают число молекул в нём с числом атомов в 0,012 кг (12 г) изотопа углерода .
Поскольку число молекул в макроскопических телах очень велико, в расчётах используется не абсолютное, а относительное число молекул.
Количество вещества, в котором содержится столько же молекул (атомов), сколько их содержится в 12 г углерода, называется молем.
Слайд 34Молярная масса
Масса вещества m связана с его молярной массой M и
Молярная масса – это масса одного моля вещества.
Единица молярной массы в СИ – килограмм на моль (кг/моль), M = Mr∙10-3.
Масса вещества m связана с его молярной массой M и количеством вещества ν формулой m = M ν.
Молярная масса – это масса одного моля вещества.
Так, молекулярная масса углекислого газа Mr C = 44, молярная MC = 44·10 -3 кг/моль.
Зная массу вещества и его молярную массу М, можно найти число молей (количество вещества) в теле:
ν = m / M .
Слайд 36Постоянная Авогадро
Амедео Авогадро
Итальянский физик и химик
9 августа 1776 г. – 9
Число частиц в одном моле вещества называется постоянной Авогадро NA.
Физический смысл постоянной Авогадро: число Авогадро показывает, что в одном моле любого вещества содержится 6,02∙1023 молекул.
Закон Авогадро: в равных объёмах разных газов при одинаковых условиях всегда содержится одинаковое количество молекул.
Более точное значение постоянной Авогадро: 6,02214084(18) ∙1023
Слайд 37Подведём итоги.
Для решения задач молекулярной физики необходимо уметь вычислять массу молекулы
Масса молекулы mо :
M – молярная масса вещества, NA – число Авогадро;
m – масса всего вещества, N – количество молекул в нём;
ρ – плотность вещества, n – концентрация молекул (число молекул в единице объёма)
Число молекул N : N = NA ∙ ν = n ∙ V = m / mо
V – объём вещества