- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по физике 11 класс Строение атома.Опыты Резерфорда
Содержание
- 1. Презентация по физике 11 класс Строение атома.Опыты Резерфорда
- 2. Цель: расширить знания учащихся по теме, доказать ядерную модель атома с помощью опытов Резерфорда.
- 3. Актуализация знанийЧто вам известно о строении вещества?Как
- 4. Гипотеза о том, что вещества состоят из
- 5. Конкретные представления о строении атома развивались по
- 6. Модель строения атома ТомсонаАтом – шар,
- 7. Слайд 7
- 8. Модель Томсона нуждалась в экспериментальной проверке.
- 9. В 1899 г. открыл альфа - и
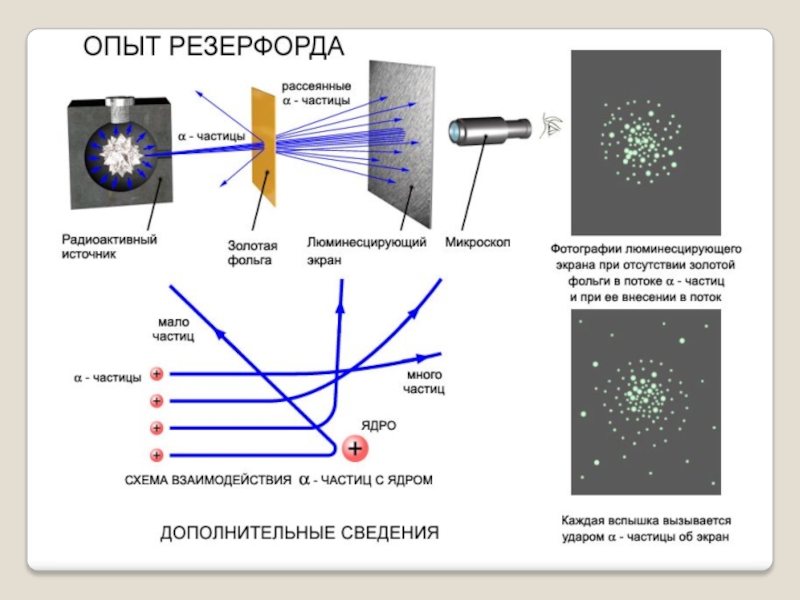
- 10. Идея опыта Резерфорда:Зондировать атом альфа–частицами.Альфа-частицы возникают при
- 11. Слайд 11
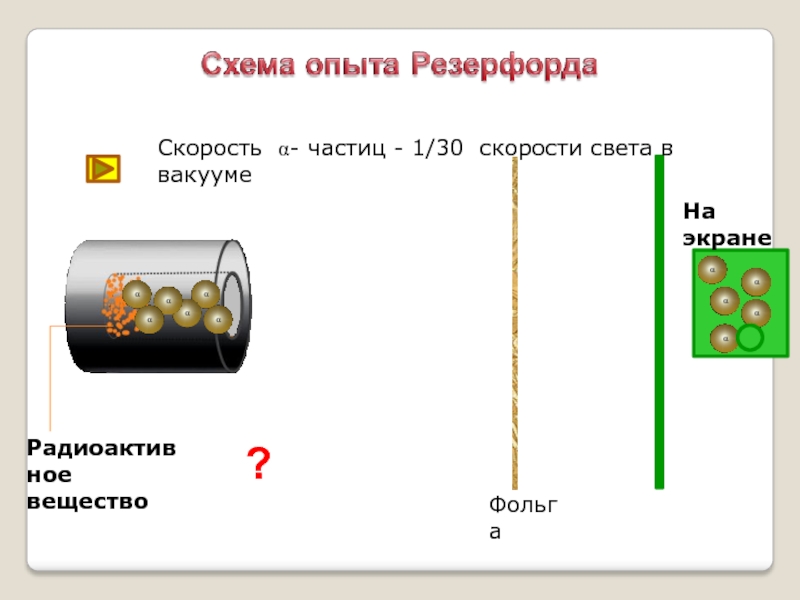
- 12. ?ФольгаРадиоактивное веществоСкорость a- частиц - 1/30 скорости света в вакуумеНа экране
- 13. Слайд 13
- 14. Опыты показали: Подавляющая часть альфа-частиц проходит
- 15. Обнаружилось, что некоторые α-частицы отклонялись
- 16. Выводы из опытов:Положительный заряд сосредоточен в малой
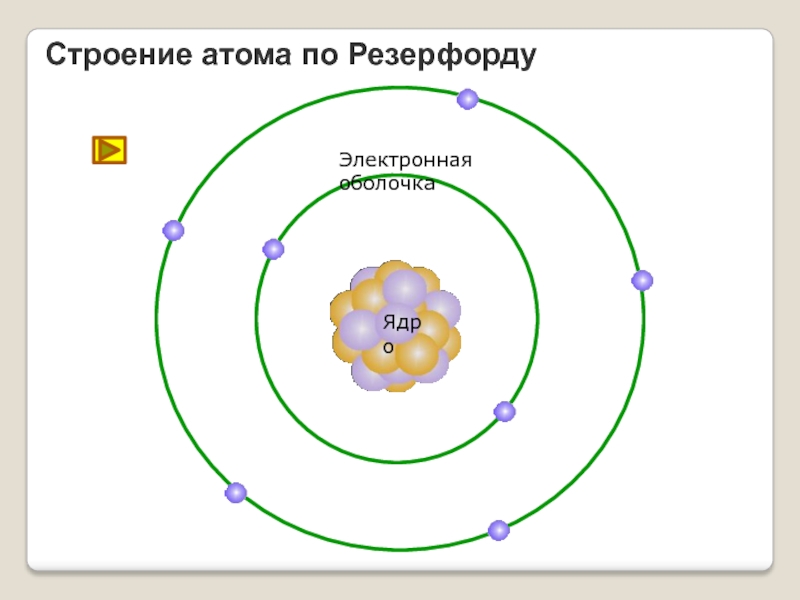
- 17. Конец ХIХ - начало ХХ векаНа основе выводов из опытов Резерфордом была предложена планетарная модель атома
- 18. Строение атома по РезерфордуЯдроЭлектронная оболочка
- 19. Недостатки атома РезерфордаЭта модель не согласуется с
- 20. Попыткой спасения планетарной модели атома стали постулаты Нильса Бора
- 21. Вопросы на закрепление:1. В чём заключается сущность
- 22. Желаю удачи в изучении физики!
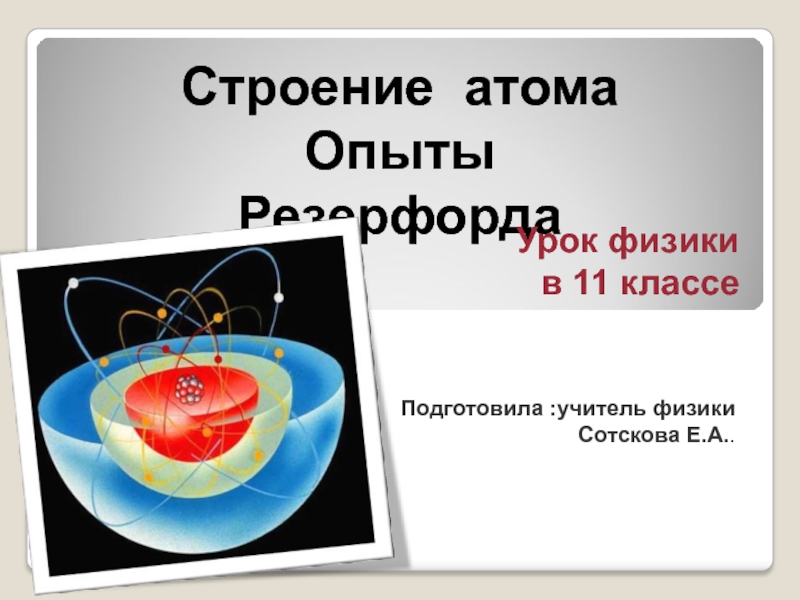
Слайд 1Строение атома Опыты Резерфорда
Урок физики
в 11 классе
Подготовила :учитель физики Сотскова
Слайд 2Цель: расширить знания учащихся по теме, доказать ядерную модель атома с
Слайд 3Актуализация знаний
Что вам известно о строении вещества?
Как мы узнаем о строении
Каково строение атома?
Как можно узнать
о строении атома?
Имеет ли ядро атома
внутреннюю структуру?
Что такое электрон?
Входят ли электроны
в состав ядра?
Слайд 4Гипотеза о том, что вещества состоят из большого числа атомов, зародилась
Позиция Демокрита: «Существует предел деления – атом».
Позиция Аристотеля:
« Делимость вещества бесконечна».
Слайд 5Конкретные представления о строении атома развивались по мере накопления физикой фактов
1897 г - Дж. Дж. Томсон доказал существование электрона, измерил его заряд и массу.
1897 г - В. Вебер впервые высказал мысль об электронном строении атома ( электроны входят в состав атома).
1905 г - Ф. Линдеман утверждал, что атом кислорода имеет форму кольца, а атом серы- форму лепешки.
1903-1904 гг - Дж. Дж. Томсон предложил модель атома в виде положительно заряженного шара, в котором «плавают» электроны.
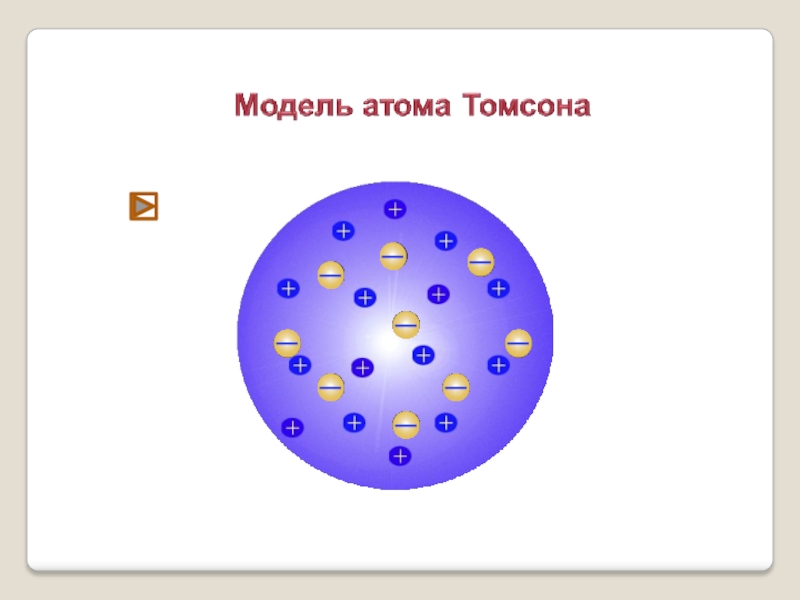
Слайд 6 Модель строения атома Томсона
Атом – шар, по всему объёму которого
Внутри шара находятся электроны.
Каждый электрон может совершать колебательные движения около своего положения равновесия.
Положительный заряд шара равен по модулю суммарному заряду электронов, поэтому заряд атома в целом равен нулю.
Слайд 8Модель Томсона нуждалась в экспериментальной проверке. Важно было убедиться, действительно ли положительный
В 1909г. Эрнест Резерфорд совместно со своими сотрудниками Г. Гейгером и Э. Марсденом провёл ряд опытов по исследованию состава и строения атомов.
Слайд 9В 1899 г. открыл альфа - и бета-лучи. Вместе с Ф.
В 1908 г. ему была присуждена Нобелевская премия.
Резерфорд Эрнест (1871–1937) – английский физик, основоположник ядерной физики. Его исследования посвящены атомной и ядерной физике, радиоактивности.
Своими фундаментальными открытиями в этих областях заложил основы современного учения о радиоактивности и теории строения атома.
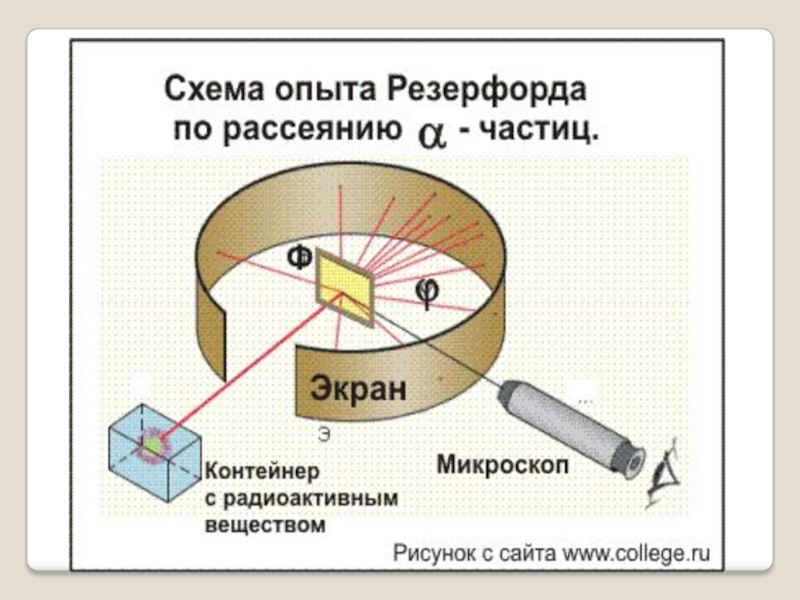
Слайд 10Идея опыта Резерфорда:
Зондировать атом альфа–частицами.
Альфа-частицы возникают при распаде радия.
Масса альфа-частицы
Электрический заряд альфа-частицы в 2 раза больше заряда электрона.
Скорость альфа-частицы около 15 000 км/с.
Альфа-частица является ядром атома гелия.
Слайд 14Опыты показали: Подавляющая часть альфа-частиц проходит сквозь фольгу практически без отклонения или
Слайд 15 Обнаружилось, что некоторые α-частицы отклонялись на большие углы, до
Резерфорд понял, что такое отклонение возможно лишь при встрече с положительно заряженной частицей большой массы. Малая вероятность отклонения на большие углы говорила о том, что эта положительная частица имеет малые размеры, порядка 10–14 м.
Электроны, по Резерфорду, движутся вокруг ядра.
Оказалось, что радиус ядра R(1014 ÷ 1015)м и зависит от числа нуклонов в ядре.
Слайд 16Выводы из опытов:
Положительный заряд сосредоточен в малой части атома – ядре;
Практически
Отклонения альфа-частиц на большие углы происходят в результате столкновения альфа – частиц с ядром одного из атомов;
Теоретические расчеты позволили оценить размеры ядер атомов – порядка 10-14 м, тогда как размеры атома в 10 000 раз больше.
Слайд 17Конец ХIХ - начало ХХ века
На основе выводов из опытов Резерфордом
Слайд 19Недостатки атома Резерфорда
Эта модель не согласуется с наблюдаемой стабильностью атомов. По
Эта модель не объясняет наблюдаемые на опыте оптические спектры атомов. Оптические спектры атомов не непрерывны, как это следует из теории Резерфорда, а состоят из узких спектральных линий, т.е. атомы излучают и поглощают электромагнитные волны лишь определенных частот, характерных для данного химического элемента.
К явлениям атомных масштабов законы классической физики неприменимы.
Слайд 21Вопросы на закрепление:
1. В чём заключается сущность модели Томсона?
2. В чём
3. Объясните по схеме опыт Резерфорда по рассеиванию альфа-частиц.
4. Объясните причину рассеивания альфа-частиц атомами вещества.
5. В чём сущность планетарной модели атома?
6. В чем противоречивость модели атома Резерфорда?