- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку по физике 11 класс Квантовые постулаты Бора
Содержание
- 1. Презентация к уроку по физике 11 класс Квантовые постулаты Бора
- 2. Несостоятельность модели резерфорда:Изначально предложенная планетарная модель атома
- 3. На смену планетарной теории пришли постулаты Бора.
- 4. I постулат - постулат стационарных состояний:В атоме существуют стационарные
- 5. Условие квантования:Или же:Момент импульса (момент количества движения) электрона, движущегося вокруг ядра, кратен ħ — деленной на 2π постоянной Планка.
- 6. В соответствии с классической механикой энергия электрона,
- 7. II постулат - правило частот:Каждой разрешенной условием квантования электронной
- 8. При переходе электрона на более низкий энергетический
- 9. Второй постулат Бора также противоречит электродинамике Максвелла,
- 10. Модель атома водорода по бору:Свои постулаты Бор
- 11. Линейчатый спектр атома водорода состоит из линий, сгруппированных в
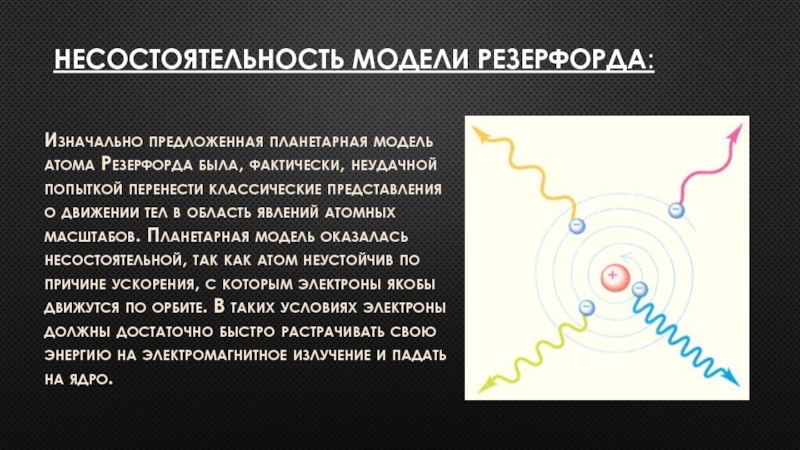
Слайд 2Несостоятельность модели резерфорда:
Изначально предложенная планетарная модель атома Резерфорда была, фактически, неудачной
Слайд 3На смену планетарной теории пришли постулаты Бора. В 1913 году выдающийся датский
Слайд 4I постулат - постулат стационарных состояний:
В атоме существуют стационарные (квантовые) состояния, не изменяющиеся
Слайд 5Условие квантования:
Или же:
Момент импульса (момент количества движения) электрона, движущегося вокруг ядра,
Слайд 6В соответствии с классической механикой энергия электрона, движущегося по орбите вокруг
Слайд 7II постулат - правило частот:
Каждой разрешенной условием квантования электронной орбите соответствует определенный энергетический
Слайд 8При переходе электрона на более низкий энергетический уровень испускается квант излучения,
При переходе электрона с орбиты m на орбиту n выделяется энергия E. Частота испускаемого излучения в соответствии с E=mc2определяется соотношением
Слайд 9Второй постулат Бора также противоречит электродинамике Максвелла, так как частота излучения
Слайд 10Модель атома водорода по бору:
Свои постулаты Бор применил для теории строения
возможные радиусы орбит электрона и размеры атома - энергии стационарных состояний атома - частоты излучаемых и поглощаемых электромагнитных волн.
Распределение энергетических уровней при излучении (испускании) и поглощении атомом водорода электромагнитных волн:
При (n = 1) - основное энергетическое состояние, ему соответствует радиус орбиты электрона r = 0,5 • 10 -11 м.
При (n больше 1) - возбужденные состояния.
При поглощении атомом кванта энергии (фотона) атом переходит в возбужденное состояние, при этом электрон переходит на более отдаленную орбиту и его связь с ядром слабеет.
Переходы в первое возбужденное состояние (Е2) с верхних уровней соответствует частотам видимой части (кр з с с) спектра водорода.
Слайд 11Линейчатый спектр атома водорода состоит из линий, сгруппированных в серии:
Частоты каждой серии спектра
В спектре водорода обнаружены следующие серии:
n = I - серия Лаймана - ультрафиолетовое излучение
n = 2 - серия Бальмера - видимое излучение
n = 3 - серия Пашена - инфракрасное излучение и т.д.
Однако, надо помнить, что для атомов с большим числом электронов ( больше 1) расчеты по теории Бора неприемлемы.