- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад интегрированного урока по химии и физике на тему Строение атома (9 класс)
Содержание
- 1. Презентация интегрированного урока по химии и физике на тему Строение атома (9 класс)
- 2. Слайд 2
- 3. Тема урока: «Строение атома»
- 4. Цель урока: Сформировать
- 5. Гипотеза о том, что вещества состоят из
- 6. Исторические факты, свидетельствующие о делимости атома1897 г.
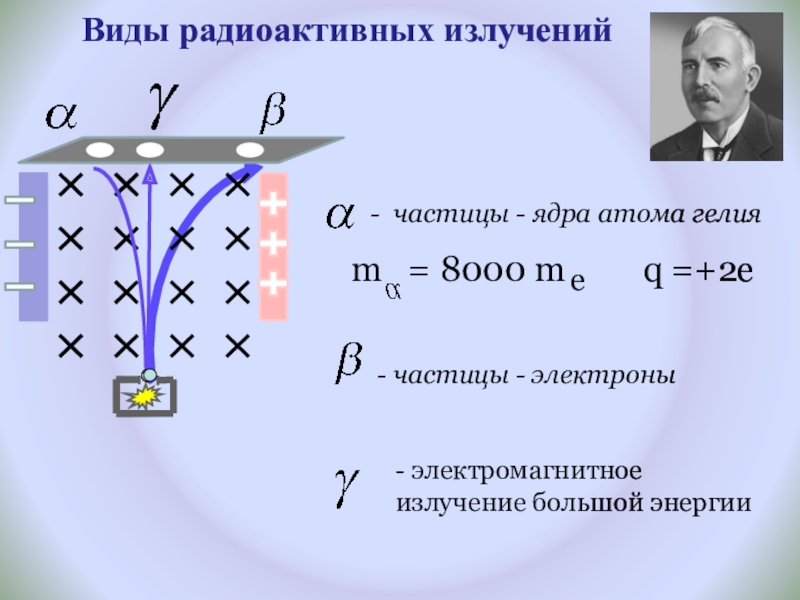
- 7. Виды радиоактивных излученийm = 8000 m q =+2e e
- 8. Как обнаружить элементарную частицу?Обычно изучают и анализируют следы (траектории или треки), оставленные частицами, по фотографиям
- 9. Модель строения атома Томсона1903 г.1. Атом –
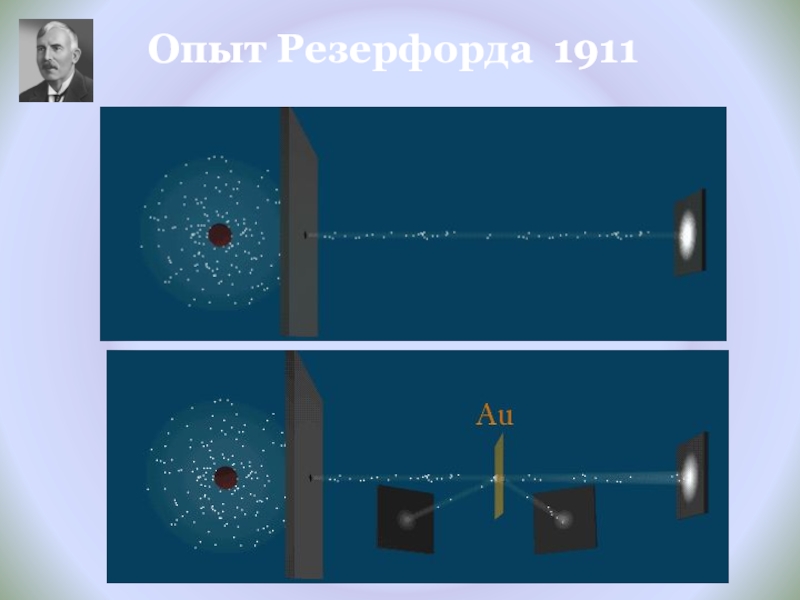
- 10. Опыт Резерфорда 1911
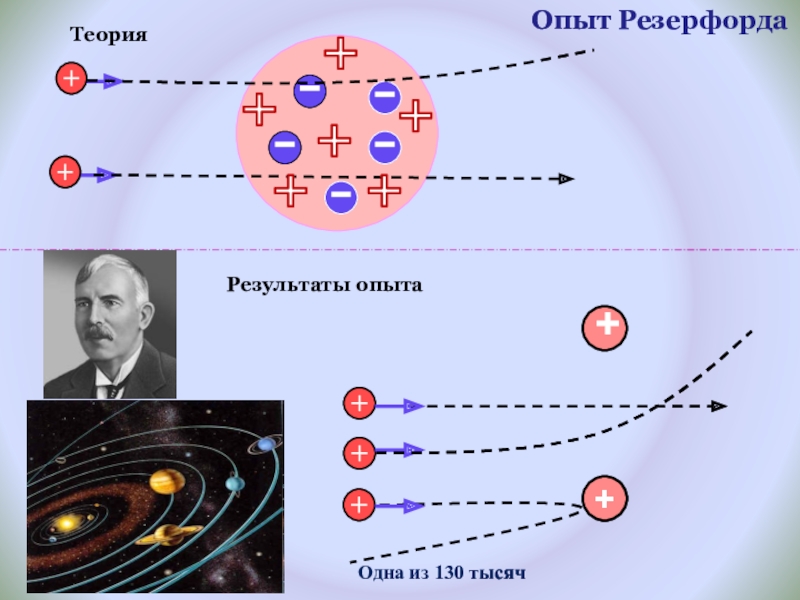
- 11. Опыт Резерфорда++Одна из 130 тысячРезультаты опытаТеория
- 12. Слайд 12
- 13. Планетарная модель атома электрон+Общий заряд атома равен
- 14. Изменяем количество электронов +Общий
- 15. Слайд 15
- 16. Изменяем количество нейтронов в атомеПротийДейтерийТритий+13Изотопы – это
- 17. Задание 2 Определите число нейтронов
- 18. Изменяем количество протоновВодородГелийЛитий+3 7Изменяя количество протонов, мы получили новые химические элементы, новый вид атома.14
- 19. Задание 3 Измените число протонов Na-11,
- 20. Задание на дом
Слайд 4 Цель урока: Сформировать целостное представление об атоме и показать единство
Задачи:
Познакомить с историческими фактами открытия атома и его сложного строения.
Показать, что заряд ядра является главной характеристикой химического элемента.
Рассмотреть факты, доказывающие сложное строение атома.
Слайд 5Гипотеза о том, что вещества состоят из большого числа атомов, зародилась
Позиция Аристотеля:
« Делимость вещества бесконечна».
Позиция Демокрита:
«Существует предел деления – атом».
«Ничего не существует, кроме атомов и пустоты…»
Атом –
(от греческого atomos – неделимый»)
мельчайшая частица химического элемента
Слайд 6Исторические факты, свидетельствующие о делимости атома
1897 г. Дж. Дж. Томсон открыл
1896 г. Анри Беккерель открыл явление радиоактивности.
Радиоактивность – способность атомов к самопроизвольному (спонтанному) излучению
1899 г. Эрнест Резерфорд обнаружил, что радиоактивное излучение неоднородно
Слайд 8Как обнаружить элементарную частицу?
Обычно изучают и анализируют следы (траектории или треки),
Слайд 9Модель строения атома Томсона
1903 г.
1. Атом – шар, по всему объёму
Внутри шара находятся электроны.
3. Каждый электрон может совершать колебательные движения около своего положения равновесия.
4. Положительный заряд шара равен по модулю суммарному заряду электронов, поэтому заряд атома в целом равен нулю.
«Кекс с изюмом»
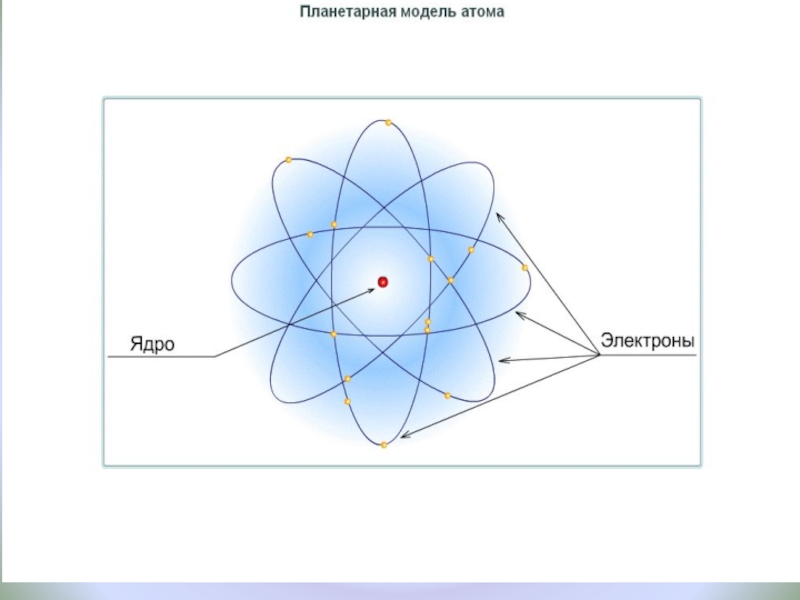
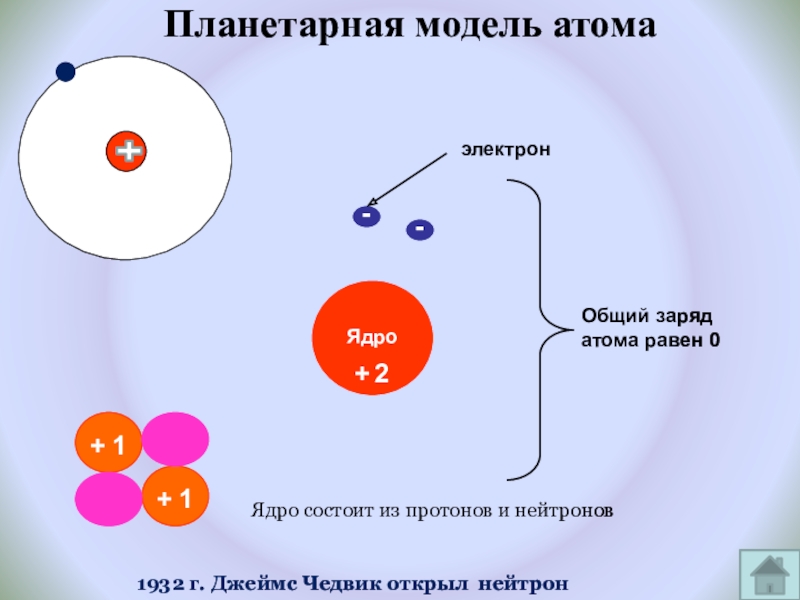
Слайд 13Планетарная модель атома
электрон
+
Общий заряд атома равен 0
-
2
-
Ядро состоит из протонов и
1932 г. Джеймс Чедвик открыл нейтрон
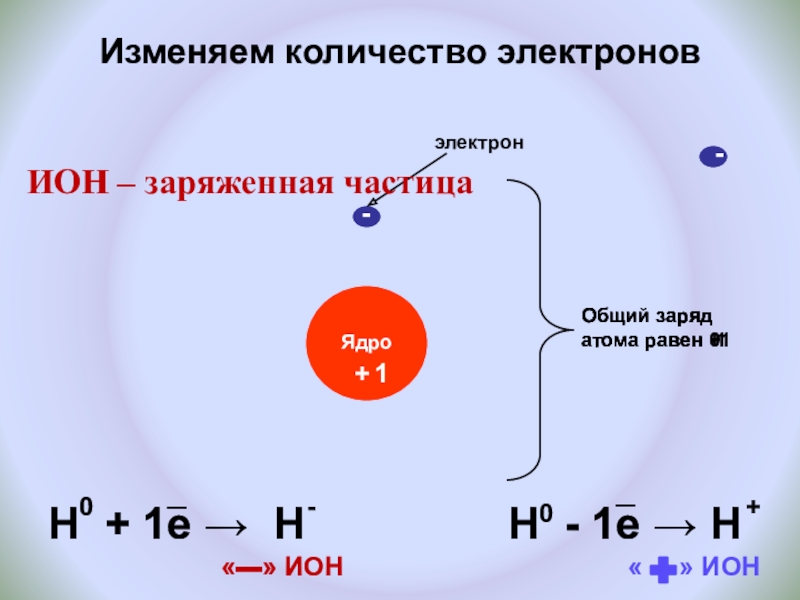
Слайд 14Изменяем количество электронов
+
Общий заряд атома равен 0
-
1
-
Общий
Общий заряд атома равен +1
электрон
H + 1e → H
0
─
-
H - 1e → H
0
─
+
«▬» ИОН
« » ИОН
ИОН – заряженная частица
Слайд 15 Задание 1 1.Число
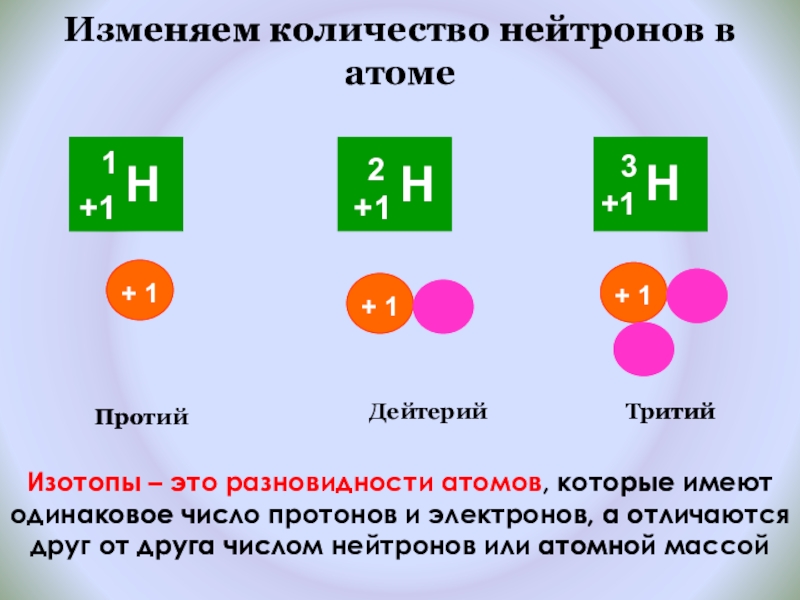
Слайд 16Изменяем количество нейтронов в атоме
Протий
Дейтерий
Тритий
+1
3
Изотопы – это разновидности атомов, которые имеют
1
2
Слайд 17 Задание 2 Определите число нейтронов Сl атомной массой 35 и 37
Слайд 18Изменяем количество протонов
Водород
Гелий
Литий
+3
7
Изменяя количество протонов, мы получили новые химические
1
4