- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад для подготовки к ЕГЭ по физике тема Молекулярная физика
Содержание
- 1. Презентация для подготовки к ЕГЭ по физике тема Молекулярная физика
- 2. Основные положения МКТМолекулярно-кинетической теорией называют учение о
- 3. Модели строения газов, жидкостей и твердых В
- 4. Тепловое движение атомов и молекул Беспорядочное
- 5. Модель идеального газа Моль – это
- 6. Слайд 6
- 7. Ν
- 8. М =m0NА – молярная масса вещества (это
- 9. Связь между давлением и средней кинетической энергией
- 10. Слайд 10
- 11. Слайд 11
- 12. Броуновское движение – это непрерывное хаотическое движение
- 13. Броуновское движение Диффузия Броуновское движение -
- 14. Силы взаимодействия молекул.rrrr – расстояние между центрами
- 15. Идеальный газ.Идеальный газ –простейшая физическаямодель реального газа.Расстояние
- 16. pДавление газа возникает врезультате столкновений молекулсо стенками сосуда, в которомнаходится газ.
- 17. Основное уравнение МКТ.
- 18. Тепловое равновесие. Температура.р – давлениеV – объем
- 19. Газы в состоянии теплового равновесия.HeПри тепловом равновесии,когда
- 20. Абсолютная температура как мера средней
- 21. Слайд 21
- 22. Абсолютный нуль
- 23. Средняя квадратичная скорость молекул
- 24. Абсолютная температура как мера средней кинетической
- 25. Уравнение Менделеева – Клапейрона.
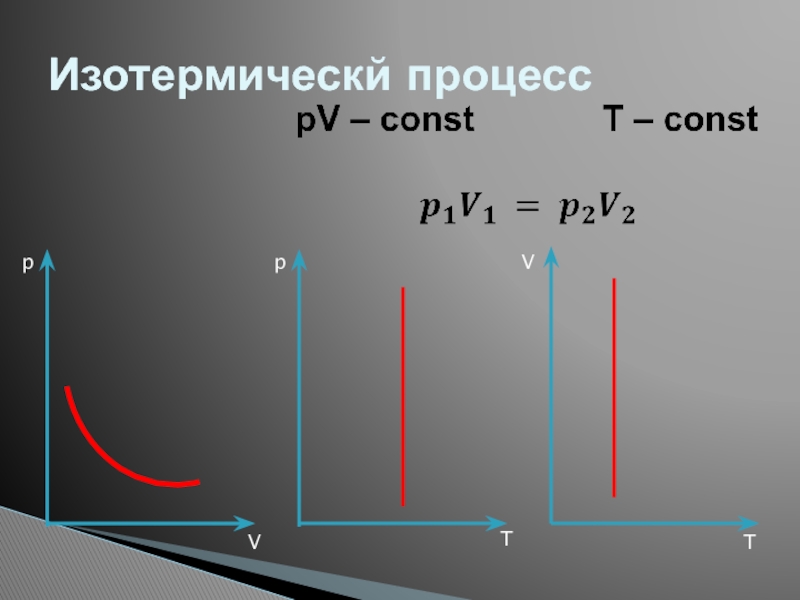
- 26. Изотермическй процессppVVTT
- 27. Изопроцессы: изотермический процесс.Изопроцессы – это процессы, в
- 28. Слайд 28
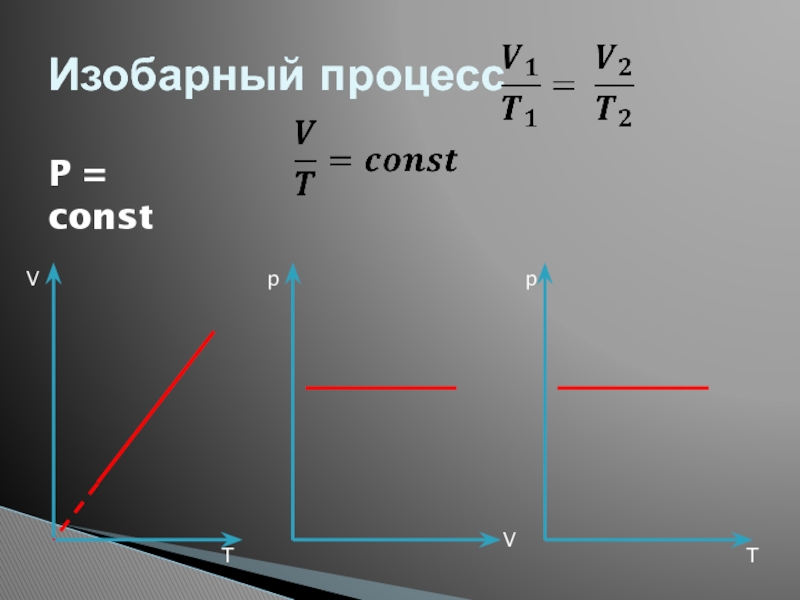
- 29. Изобарный процессP = constppVVTT
- 30. Изопроцессы: изобарный. процессИзопроцессы – это процессы,
- 31. Слайд 31
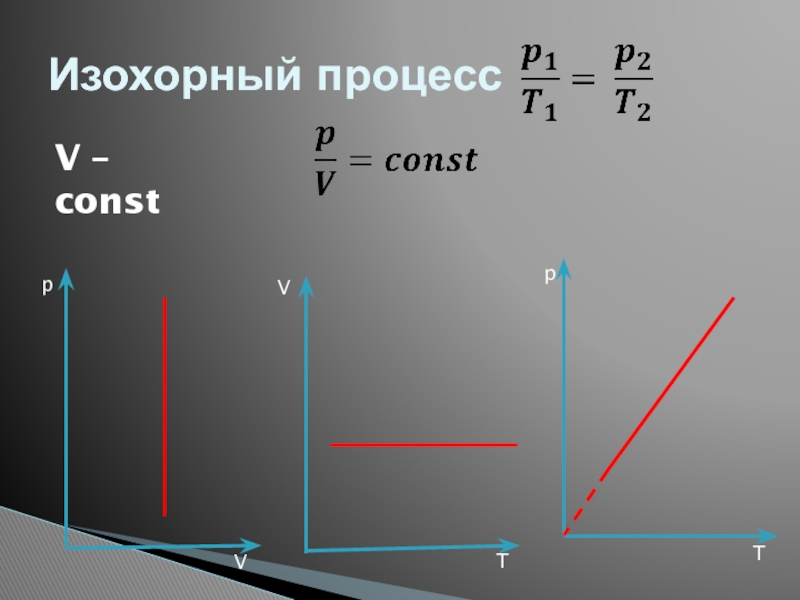
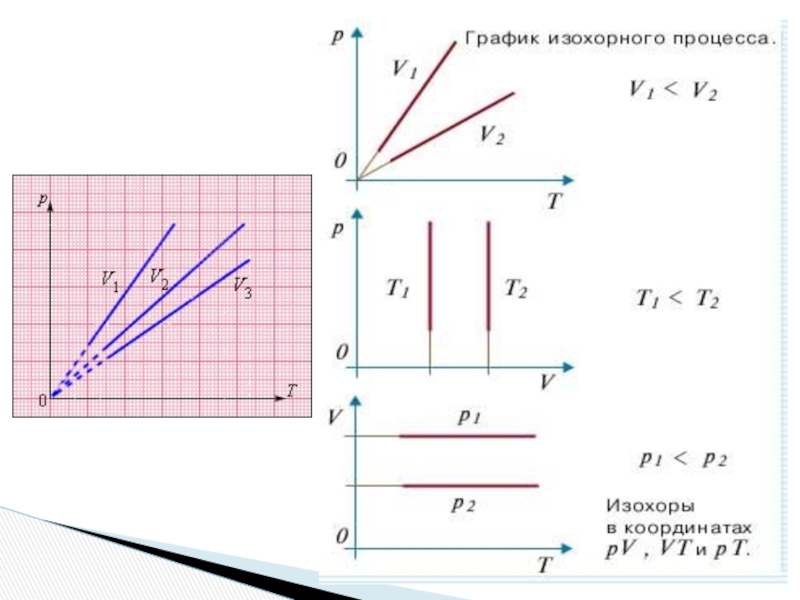
- 32. Изохорный процессV – constppVVTT
- 33. Изопроцессы: , изохорный, процесс.Изопроцессы – это процессы,
- 34. Слайд 34
- 35. Рассмотрим задачи: ЕГЭ (Демо, КИМ)ГИА-9 (Демо)
- 36. (ЕГЭ ) А10. Согласно расчетам, температура жидкости
- 37. (ЕГЭ ., Демо) А11. На рисунке показана
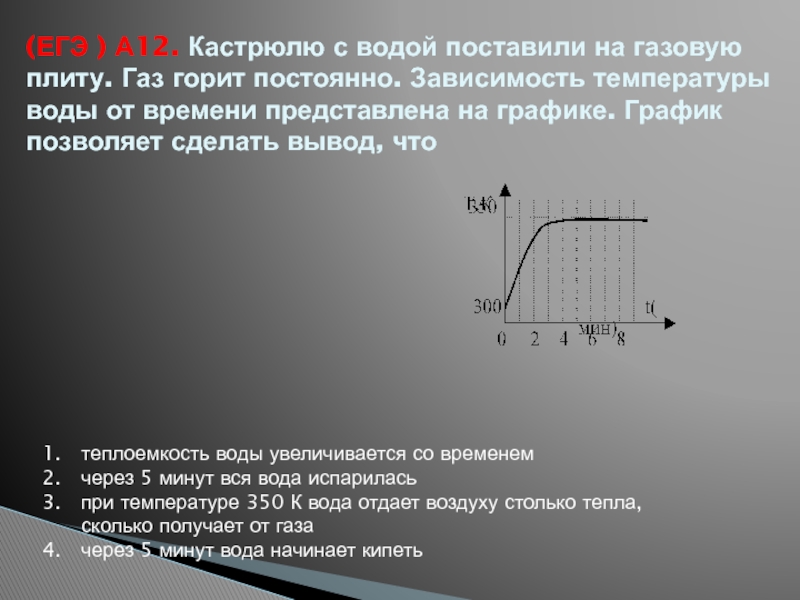
- 38. (ЕГЭ ) А12. Кастрюлю с водой поставили
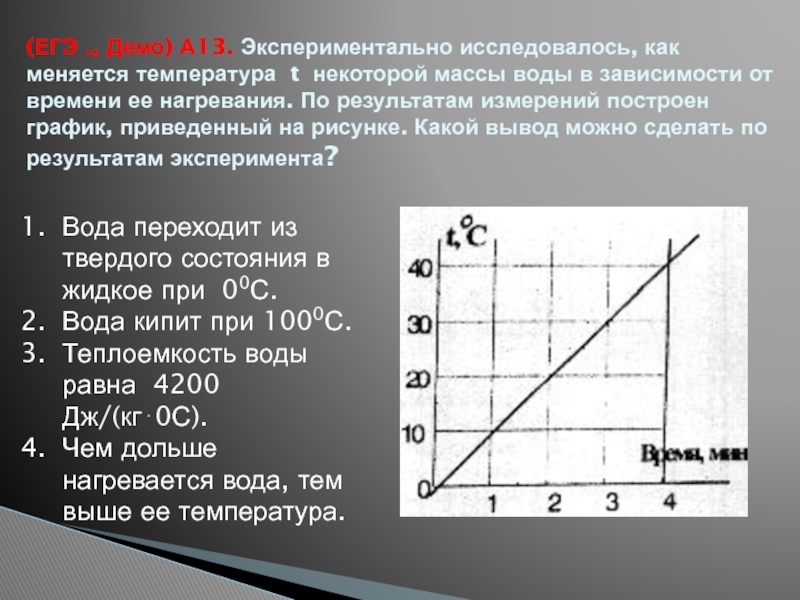
- 39. (ЕГЭ ., Демо) А13. Экспериментально исследовалось, как
- 40. (ЕГЭ ., Демо) А14. Испарение жидкости происходит
- 41. (ЕГЭ ., Демо) А15. Тела, имеющие разные
- 42. (ЕГЭ ) А33. Представления о строении вещества
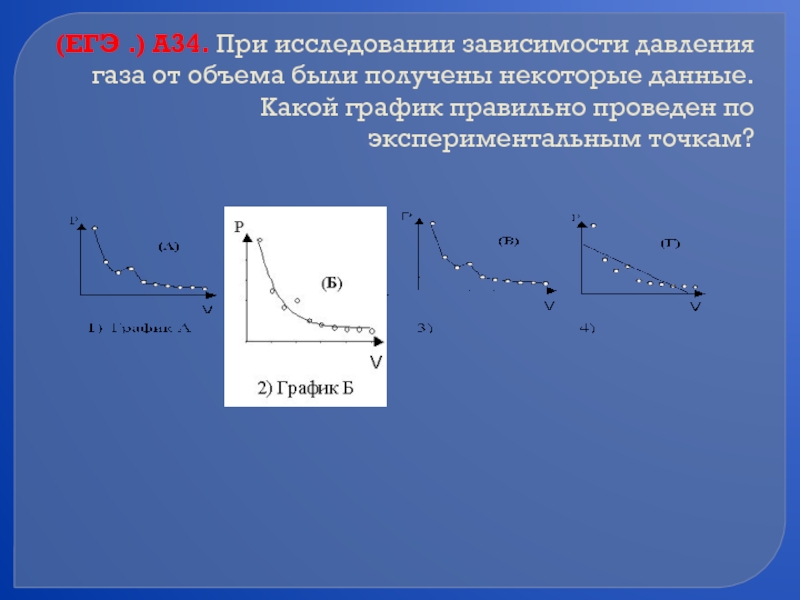
- 43. (ЕГЭ .) А34. При исследовании зависимости давления
- 44. (ЕГЭ ) А35. Одинаковые количества одного и
- 45. (ЕГЭ , Демо) А8. Какой из перечисленных
- 46. (ЕГЭ , Демо) А9. Какой график (см.
- 47. ЕГЭ. А9 (КИМ). В баллоне находится 6 моль газа. Сколько примерно молекул газа находится в баллоне?
- 48. (ЕГЭ ., Демо) А12. Какой из графиков,
- 49. (ЕГЭ., Демо) А13. При испарении жидкость остывает.
- 50. ЕГЭ. А13 (КИМ). При сжатии идеального газа
- 51. ЕГЭ. А14 (КИМ). В результате нагревания газа
- 52. ЕГЭ . А29 (КИМ). Идеальный газ сначала
- 53. (ЕГЭ., Демо) А30. Какова температура идеального газа
- 54. (ЕГЭ ., КИМ) А8. Диффузия происходит быстрее
- 55. (ЕГЭ ., КИМ) А9. При неизменной концентрации
- 56. (ЕГЭ ., КИМ) А10. На рисунке изображен
- 57. (ЕГЭ , демо) А7. Давление идеального газа
- 58. (ЕГЭ ., демо) А23. При переходе из
- 59. (ЕГЭ , ДЕМО) А8. В жидкостях частицы
- 60. (ЕГЭ , ДЕМО) А27. Экспериментаторы закачивают воздух
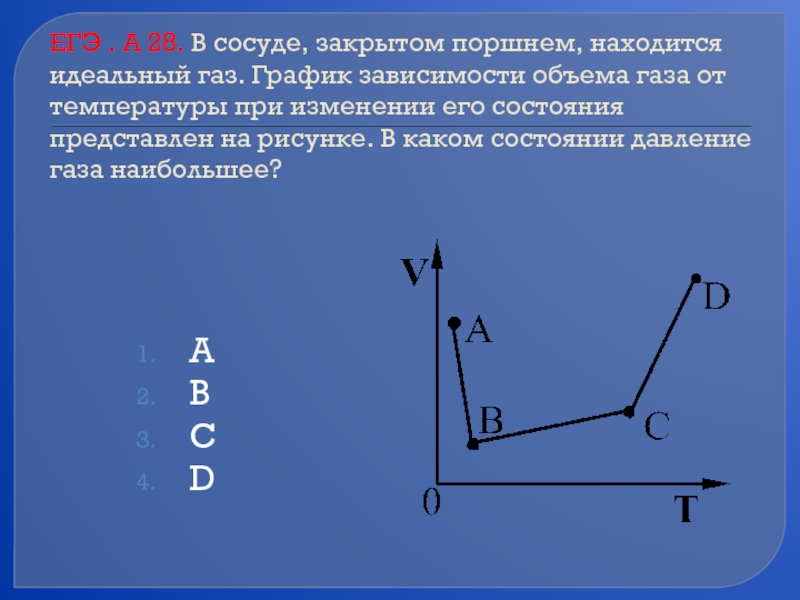
- 61. ЕГЭ . А 28. В сосуде, закрытом
- 62. (ЕГЭ , ДЕМО) А10. 3 моль водорода находятся
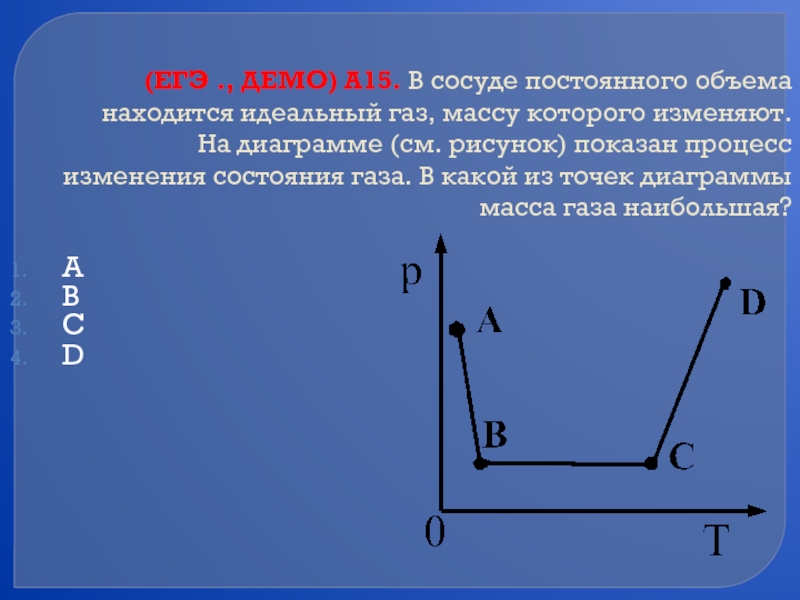
- 63. (ЕГЭ ., ДЕМО) А15. В сосуде постоянного
- 64. (ЕГЭ , ДЕМО) А8. При понижении абсолютной
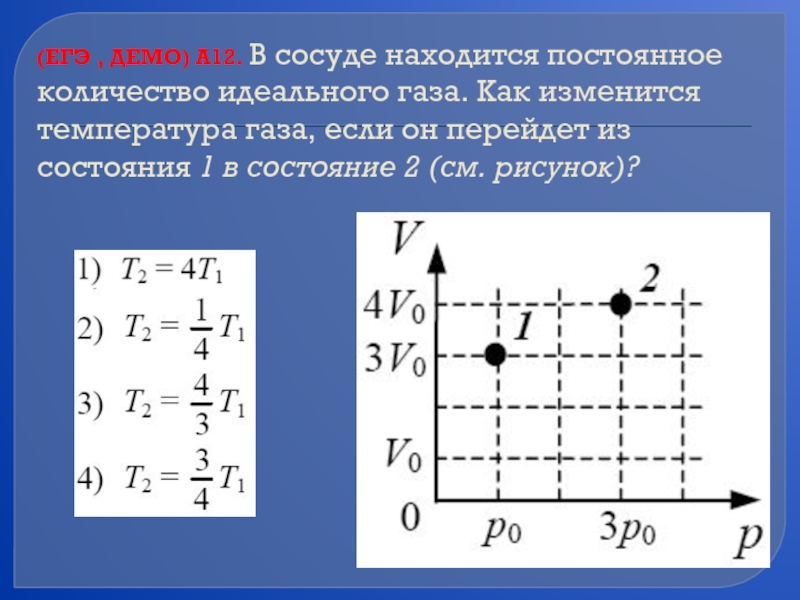
- 65. (ЕГЭ , ДЕМО) А12. В сосуде находится
- 66. (ЕГЭ., ДЕМО) В2. Используя первый
- 67. (ЕГЭ , ДЕМО) А9. На рисунке приведены
- 68. (ЕГЭ, ДЕМО) В1. В сосуде
Слайд 2Основные положения МКТ
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества
В основе молекулярно-кинетической теории лежат
три основных положения:
Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»).
Атомы и молекулы находятся в непрерывном хаотическом движении.
Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
Слайд 3Модели строения газов, жидкостей и твердых
В твердых телах молекулы совершают
В жидкостях молекулы имеют значительно большую свободу для теплового движения. Они не привязаны к определенным центрам и могут перемещаться по всему объему жидкости. Этим объясняется текучесть жидкостей.
В газах расстояния между молекулами обычно значительно больше их размеров, каждая молекула движется вдоль прямой линии до очередного столкновения с другой молекулой или со стенкой сосуда.
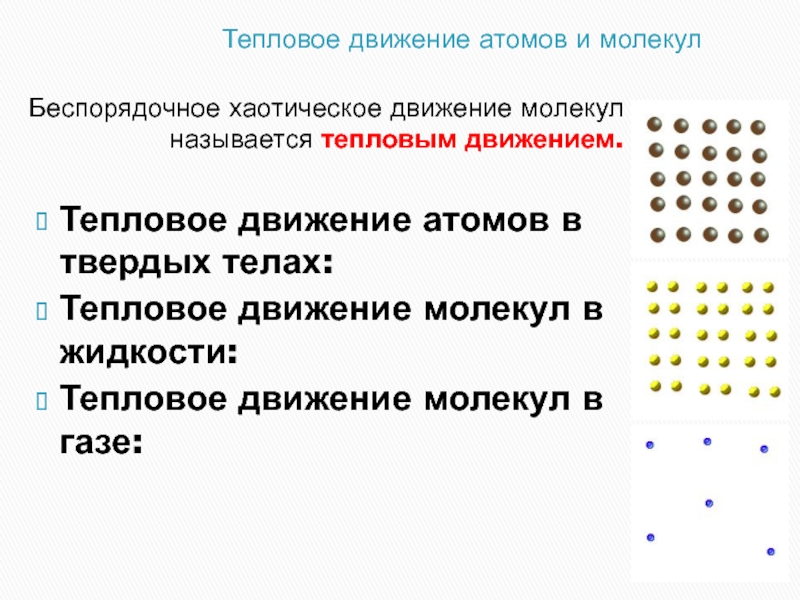
Слайд 4Тепловое движение атомов и молекул
Беспорядочное хаотическое движение молекул называется тепловым
Тепловое движение атомов в твердых телах:
Тепловое движение молекул в жидкости:
Тепловое движение молекул в газе:
Слайд 5Модель идеального
газа
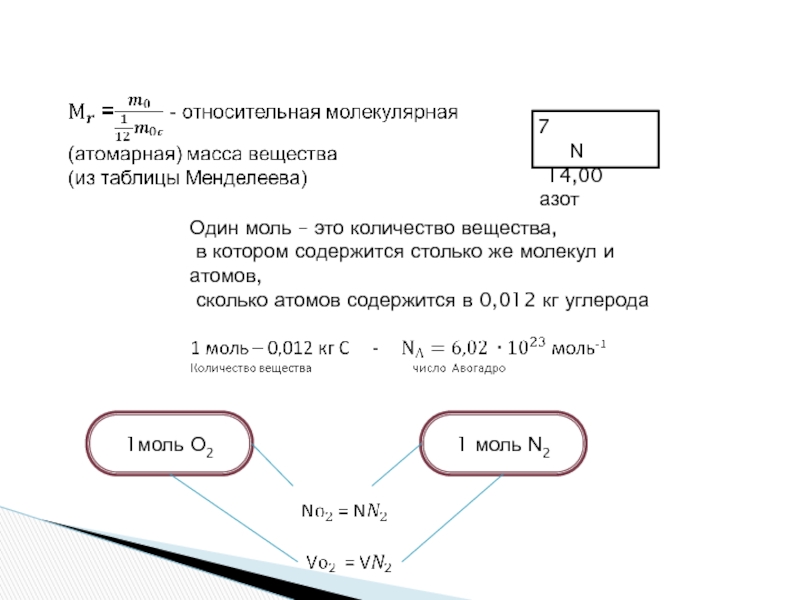
Моль – это количество вещества, содержащее столько же
в одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется постоянной Авогадро NА: NА = 6,02·1023 моль–1.
Массу одного моля вещества принято называть молярной массой M.
Молярная масса выражается в килограммах на моль (кг/моль)
Отношение массы атома или молекулы данного вещества к 1/12 массы атома углерода 12C называется относительной массой.
Слайд 7 Ν
14,00 азот
Один
в котором содержится столько же молекул и атомов,
сколько атомов содержится в 0,012 кг углерода
1моль О2
1 моль Ν2
Слайд 8М =m0NА – молярная масса вещества (это масса 1 моля вещества)
N
m = m0N = ν NА m0 = ν∙М - масса вещества.
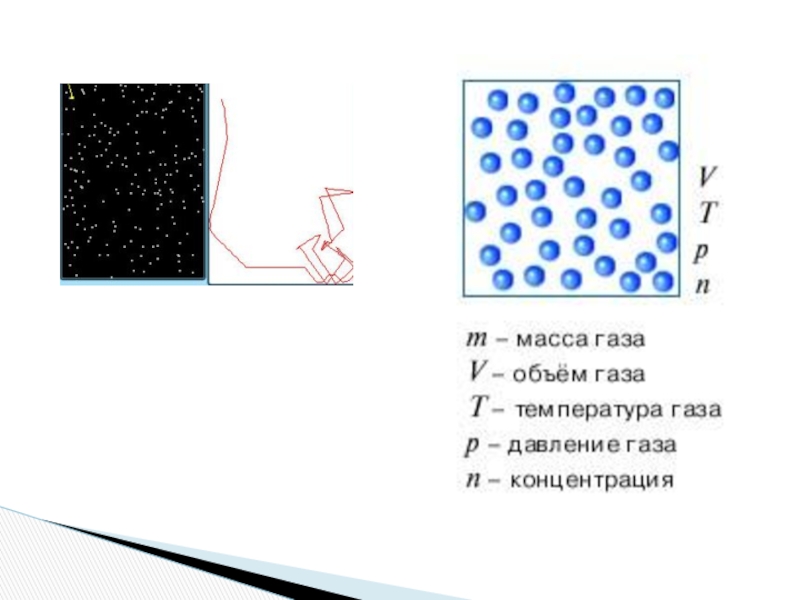
Слайд 9Связь между давлением и средней кинетической энергией теплового движения молекул идеального
Основное уравнение МКТ газов.
Давление газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объема
p = nkT,
где n = N / V – концентрация молекул (т. е. число молекул в единице объема сосуда)
k –постоянной Больцмана, в честь австрийского физика. Ее численное значение в СИ равно:
k = 1,38·10–23 Дж/К.
Закон Дальтона: давление в смеси химически невзаимодействующих газов равно сумме их парциальных давлений
p = p1 + p2 + p3 + … = (n1 + n2 + n3 + …)kT.
Слайд 12Броуновское движение – это непрерывное хаотическое движение
частиц, помещенных в жидкость
Причина броуновского движения частиц в том, что удары молекул о нее не компенсируют друг друга.
(Частицы краски в воде, пылинки в луче света.)
Слайд 13Броуновское движение
Диффузия
Броуновское движение - это тепловое движение мельчайших частиц,
Броуновское движение :
Броуновская частица среди молекул:
Траектория движения 3-х броуновских частиц :
Диффузией называется явление проникновения двух или нескольких соприкасающихся веществ друг в друга.
Диффузия приближает систему к состоянию термодинамического равновесия
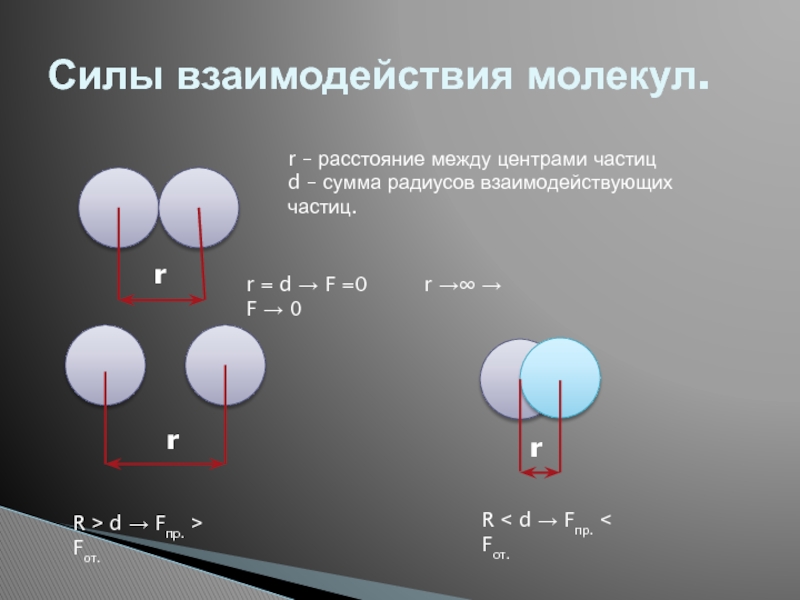
Слайд 14Силы взаимодействия молекул.
r
r
r
r – расстояние между центрами частиц
d – сумма радиусов
r = d → F =0 r →∞ → F → 0
R ˃ d → Fпр. ˃ Fот.
R ˂ d → Fпр. ˂ Fот.
Слайд 15Идеальный газ.
Идеальный газ –
простейшая физическая
модель реального газа.
Расстояние между молекулами ˃ d
Молекулы
Силы притяжения стремятся к 0
Отталкивание только при ударах
Движение только по законам Ньютона
Слайд 16p
Давление газа возникает в
результате столкновений молекул
со стенками сосуда, в котором
находится газ.
Слайд 18Тепловое равновесие. Температура.
р – давление
V – объем
t - температура
Макроскопические или термодинамические
параметры, характеризующие состояние вещества
без учета его молекулярного строения.
А
В
С
С
Два тела – А и В, каждое из которых находится
в теплом равновесии с телом С. Находится
в тепловом равновесии друг с другом. Тело С может
служить прибором, измеряющим степень нагретости
тела А и В.
Слайд 19Газы в состоянии теплового равновесия.
He
При тепловом равновесии,
когда давление газа данной
массы и
средняя кинетическая энергия
молекул всех газов одинакова
(как и температура.)
Слайд 20
Абсолютная температура как мера средней кинетической энергии его частиц
Тепловое
Температура – это физический параметр, одинаковый для всех тел, находящихся в тепловом равновесии.
Для измерения температуры используются физические приборы – термометры
В системе СИ принято единицу измерения температуры по шкале Кельвина называть кельвином и обозначать буквой K.
TК = TС + 273,15
Температурная шкала Кельвина называется абсолютной шкалой температур.
Кроме точки нулевого давления газа, которая называется абсолютным нулем температуры, достаточно принять еще одну фиксированную опорную точку - температура тройной точки воды (0,01° С), в которой в тепловом равновесии находятся все три фазы – лед, вода и пар - 273,16 К.
Слайд 24
Абсолютная температура как мера средней кинетической энергии его частиц
Средняя кинетическая
Температура есть мера средней кинетической энергии поступательного движения молекул.
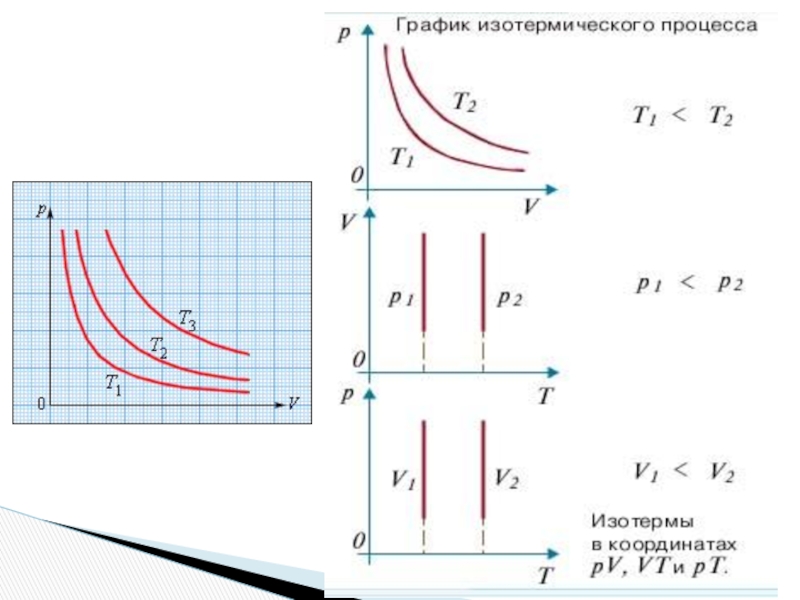
Слайд 27Изопроцессы: изотермический процесс.
Изопроцессы – это процессы, в которых один из параметров
Изотермический процесс (T = const) -квазистатический процесс, протекающий при постоянной температуре T.
Закон Бойля–Мариотта: при постоянной температуре T и неизменном количестве вещества ν в сосуде произведение давления p газа на его объем V должно оставаться постоянным:
pV = const
T3 > T2 > T1
Слайд 30Изопроцессы: изобарный. процесс
Изопроцессы – это процессы, в которых один из
Изобарным процессом называют квазистатический процесс, протекающий при неизменным давлении p.
Закон Гей-Люссака:
где V0 – объем газа при температуре 0 °С.
α = 1/273,15 К–1 - температурныЙ коэффициент объемного расширения газов.
p3 > p2 > p1
Слайд 33Изопроцессы: , изохорный, процесс.
Изопроцессы – это процессы, в которых один из
Изохорный процесс – это процесс квазистатического нагревания или охлаждения газа при постоянном объеме V и при условии, что количество вещества ν в сосуде остается неизменным.
Закон Шарля: при постоянном объеме V и неизменном количестве вещества ν в сосуде давление газа p изменяется прямо пропорционально его абсолютной температуре :
V3 > V2 > V1
Слайд 36(ЕГЭ ) А10. Согласно расчетам, температура жидкости должна быть равна 143
термометр не рассчитан на высокие температуры и требует замены
термометр показывает более высокую температуру
термометр показывает более низкую температуру
термометр показывает расчетную температуру
Слайд 37(ЕГЭ ., Демо) А11. На рисунке показана часть шкалы термометра, висящего
180С.
140С
210С.
220С.
Слайд 38(ЕГЭ ) А12. Кастрюлю с водой поставили на газовую плиту. Газ
теплоемкость воды увеличивается со временем
через 5 минут вся вода испарилась
при температуре 350 К вода отдает воздуху столько тепла, сколько получает от газа
через 5 минут вода начинает кипеть
Слайд 39(ЕГЭ ., Демо) А13. Экспериментально исследовалось, как меняется температура t некоторой
Вода переходит из твердого состояния в жидкое при 00С.
Вода кипит при 1000С.
Теплоемкость воды равна 4200 Дж/(кг0С).
Чем дольше нагревается вода, тем выше ее температура.
Слайд 40(ЕГЭ ., Демо) А14. Испарение жидкости происходит потому, что . .
разрушается кристаллическая решетка.
самые быстрые частицы покидают жидкость.
самые медленные частицы покидают жидкость.
самые крупные частицы покидают жидкость.
Слайд 41(ЕГЭ ., Демо) А15. Тела, имеющие разные температуры, привели в соприкосновение
В положении I теплопередача осуществляется от тела 1 к телу 2.
В положении II теплопередача осуществляется от тела 1 к телу 2.
В любом положении теплопередача осуществляется от тела 2 к телу 1.
Теплопередача осуществляется только в положении II.
Слайд 42(ЕГЭ ) А33. Представления о строении вещества в XVIII веке не
опыты давали искаженные результаты, не соответствующие действительности
представления требовали дополнений или корректировки
теория имеет дело с идеальными объектами, а эксперимент – с реальными. Они не могут друг другу соответствовать
ни опыты, ни научные представления в XVIII веке не отражали истинную картину строения веществ
Слайд 43(ЕГЭ .) А34. При исследовании зависимости давления газа от объема были
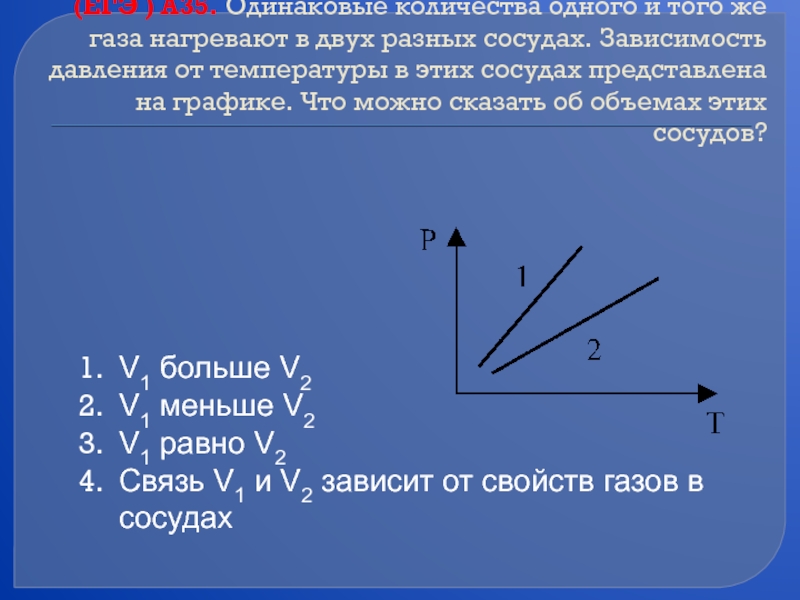
Слайд 44(ЕГЭ ) А35. Одинаковые количества одного и того же газа нагревают
V1 больше V2
V1 меньше V2
V1 равно V2
Связь V1 и V2 зависит от свойств газов в сосудах
Слайд 45(ЕГЭ , Демо) А8. Какой из перечисленных ниже опытов (А, Б
только А
только Б
только В
А, Б и В
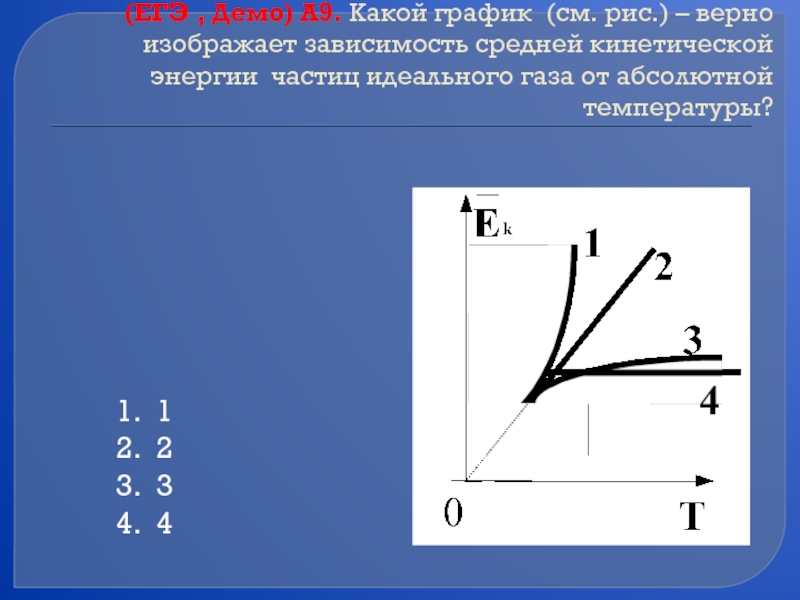
Слайд 46(ЕГЭ , Демо) А9. Какой график (см. рис.) – верно изображает
1
2
3
4
Слайд 47ЕГЭ. А9 (КИМ). В баллоне находится 6 моль газа. Сколько примерно молекул
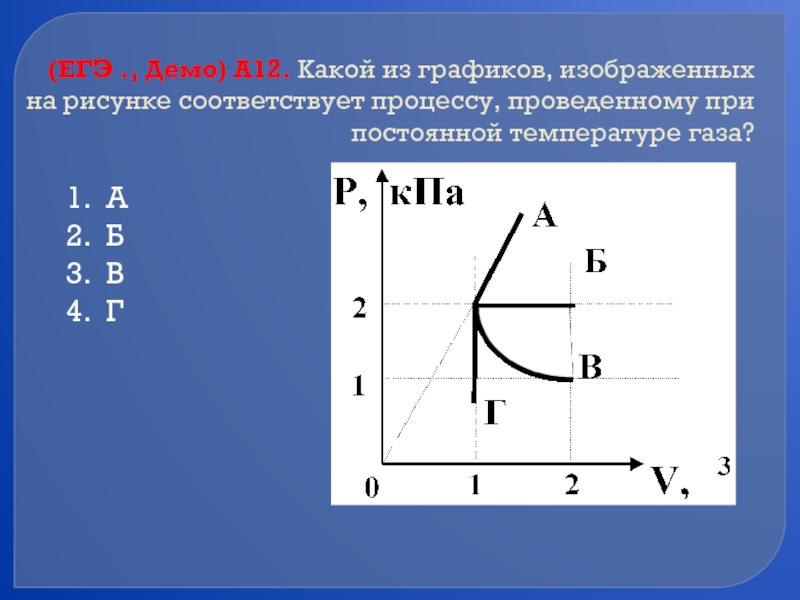
Слайд 48(ЕГЭ ., Демо) А12. Какой из графиков, изображенных на рисунке соответствует
А
Б
В
Г
Слайд 49(ЕГЭ., Демо) А13. При испарении жидкость остывает. Молекулярно-кинетическая теория объясняет это
равна средней кинетической энергии молекул жидкости
превышает среднюю кинетическую энергию молекул жидкости
меньше средней кинетической энергии молекул жидкости
равна суммарной кинетической энергии молекул жидкости
Слайд 50ЕГЭ. А13 (КИМ). При сжатии идеального газа объем уменьшился в 2
Слайд 51ЕГЭ. А14 (КИМ). В результате нагревания газа средняя кинетическая энергия теплового
Слайд 52ЕГЭ . А29 (КИМ). Идеальный газ сначала нагревался при постоянном давлении,
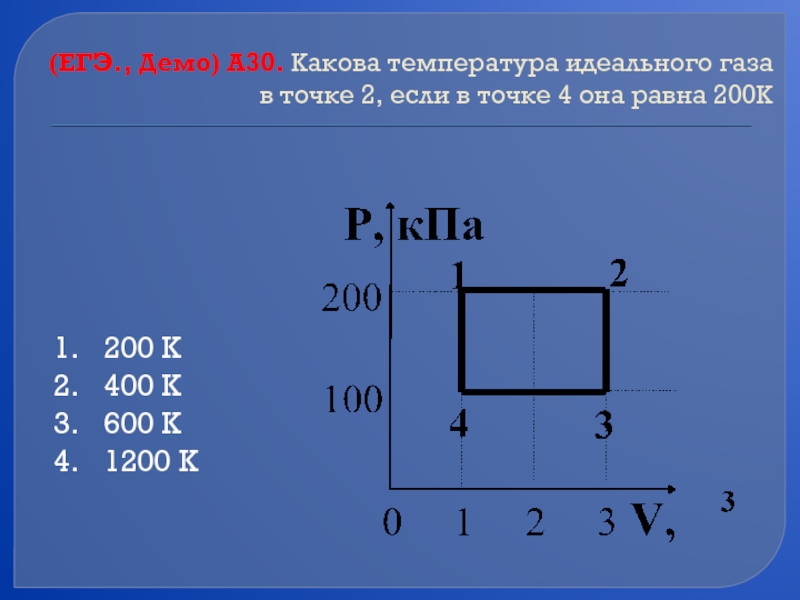
Слайд 53(ЕГЭ., Демо) А30. Какова температура идеального газа в точке 2, если
200 К
400 К
600 К
1200 К
Слайд 54(ЕГЭ ., КИМ) А8. Диффузия происходит быстрее при повышении температуры вещества,
увеличивается скорость движения частиц
увеличивается взаимодействие частиц
тело при нагревании расширяется
уменьшается скорость движения частиц
Слайд 55(ЕГЭ ., КИМ) А9. При неизменной концентрации частиц идеального газа средняя
уменьшилось в 3 раза
увеличилось в 3 раза
увеличилось в 9 раз
не изменилось
Слайд 56(ЕГЭ ., КИМ) А10. На рисунке изображен график зависимости давления газа
изобарное нагревание
изохорное охлаждение
изотермическое сжатие
изохорное нагревание
Слайд 57(ЕГЭ , демо) А7. Давление идеального газа зависит от А. концентрации
только от А
только от Б
и от А, и от Б
ни от А, ни от Б
Слайд 58(ЕГЭ ., демо) А23. При переходе из состояния А в состояние
увеличилась в 2 раза
увеличилась в 4 раза
уменьшилась в 2 раза
уменьшилась в 4 раза
Слайд 59(ЕГЭ , ДЕМО) А8. В жидкостях частицы совершают колебания возле положения
малую сжимаемость
текучесть
давление на дно сосуда
изменение объема при нагревании
Слайд 60(ЕГЭ , ДЕМО) А27. Экспериментаторы закачивают воздух в стеклянный сосуд, одновременно
в 2 раза
в 3 раза
в 6 раз
в 1,5 раза
Слайд 61ЕГЭ . А 28. В сосуде, закрытом поршнем, находится идеальный газ.
А
В
С
D
Слайд 62(ЕГЭ , ДЕМО) А10. 3 моль водорода находятся в сосуде при температуре
32Т
16Т
2Т
Т
Слайд 63(ЕГЭ ., ДЕМО) А15. В сосуде постоянного объема находится идеальный газ,
А
В
С
D
Слайд 64(ЕГЭ , ДЕМО) А8. При понижении абсолютной температуры одноатомного идеального газа
увеличится в 1,5 раза
уменьшится в 1,5 раза
уменьшится в 2,25 раза
не изменится
Слайд 65(ЕГЭ , ДЕМО) А12. В сосуде находится постоянное количество идеального газа.
Слайд 66(ЕГЭ., ДЕМО) В2. Используя первый закон термодинамики, установите соответствие между
1
4
Слайд 67(ЕГЭ , ДЕМО) А9. На рисунке приведены графики зависимости давления 1
Слайд 68(ЕГЭ, ДЕМО) В1. В сосуде неизменного объема находилась при комнатной
1
2
3