Сегодня: *
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Краткий курс лекций по физике
Содержание
- 1. Краткий курс лекций по физике
- 2. Тема 1. Модели атомов.Атом водорода по теории
- 3. Концепция атомизма 1.Дихотомия Демокрита
- 4. ? Легенда о яблоке
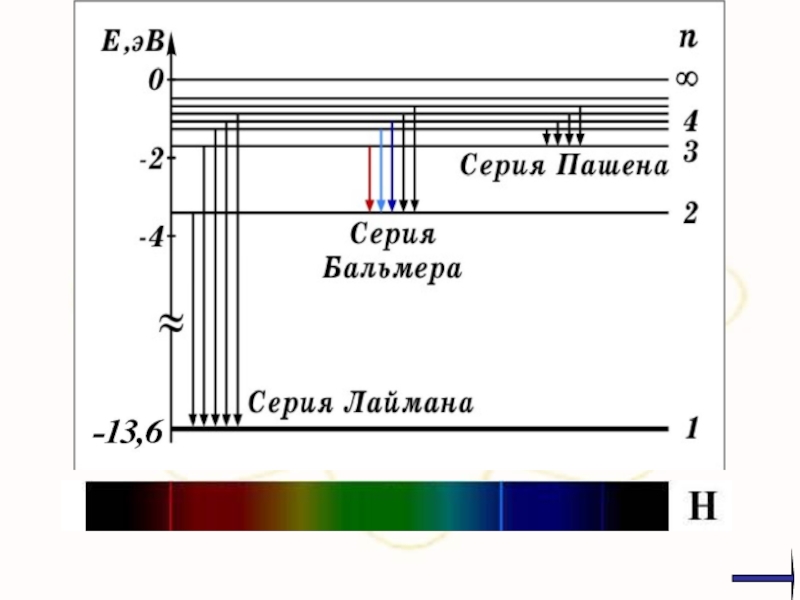
- 5. 1.1. Закономерности в атомных спектрах.хИтак, что же
- 6. Слайд 6
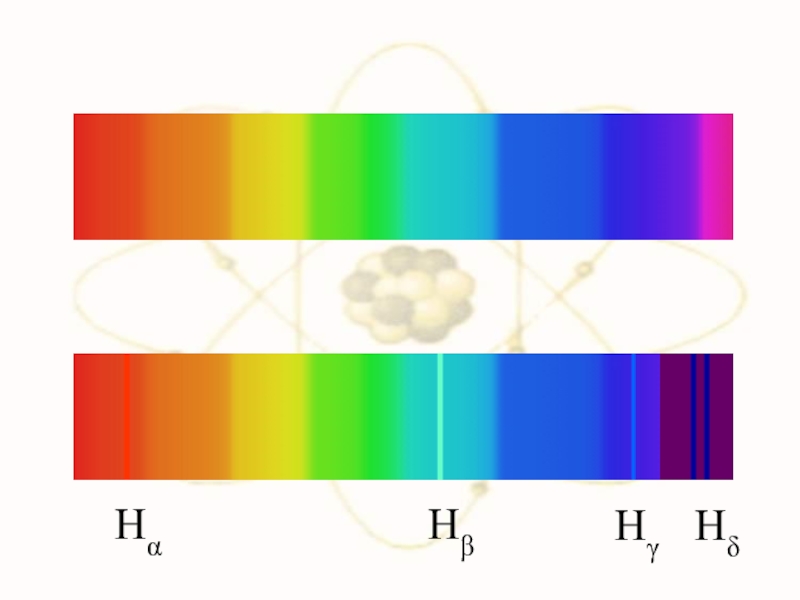
- 7. Линейчатые спектры излучения в видимой области: водород,
- 8. Швейцарский физик Й. Бальмер в 1885 году
- 9. Дальнейшие исследования показали, что в спектре водорода имеется еще несколько серий: х
- 10. Обобщенная формула Й. Бальмера где k = 1,
- 11. Атом сложная система, имеющая сложный спектрхВидимая областьИнфракрасная обл.Ультрафиолетовая обл.
- 12. В то время учеными рассматривались многие модели атомов Рисунок 1.2
- 13. «То, что внизу, подобнотому, что вверху»
- 14. Планетарная модель строенияатома
- 15. Конец ХIХ -- начало ХХ века
- 16. Закон постоянства состава соединений Лавуазье (1743-1794) Открытие атомов в химии
- 17. Слайд 17
- 18. Интерпретация Дальтона: имеются определенные минимальные количества элементов и веществ (соединений)
- 19. Проблема внутреннего строения атома Открытие электрона Исследование тока в разреженных газах
- 20. Трубка Крукса катодные лучи ("лучистая материя", "4 состояние")
- 21. 3- свойства К-лучей не зависят от типа
- 22. К-лучи - это поток отрицательно заряженных частиц вещества. ВЫВОДЫ:
- 23. Дж.Дж.Томсон в 1897 году определил величину отношения "заряд"/"масса" для этих частиц.
- 24. В состав всех атомов входят частицы малой
- 25. 1895- открытие Х-лучей Рентгеном1896- открытие радиоактивности Беккерелем
- 26. 1896 - основание ТПУ!1897 - открытие электрона
- 27. Физики «отобрали» атом у химиков
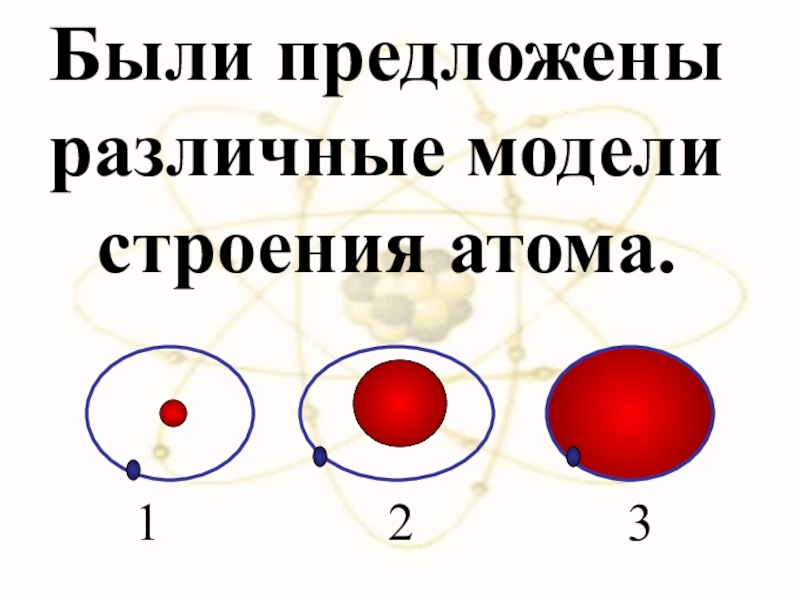
- 28. Были предложены различные модели строения атома. 1
- 29. Слайд 29
- 30. «То, что находится внизу,подобно тому, что находится
- 31. Модель Ж. Перрена (1901)
- 32. Модель Х. Нагаока (1904)
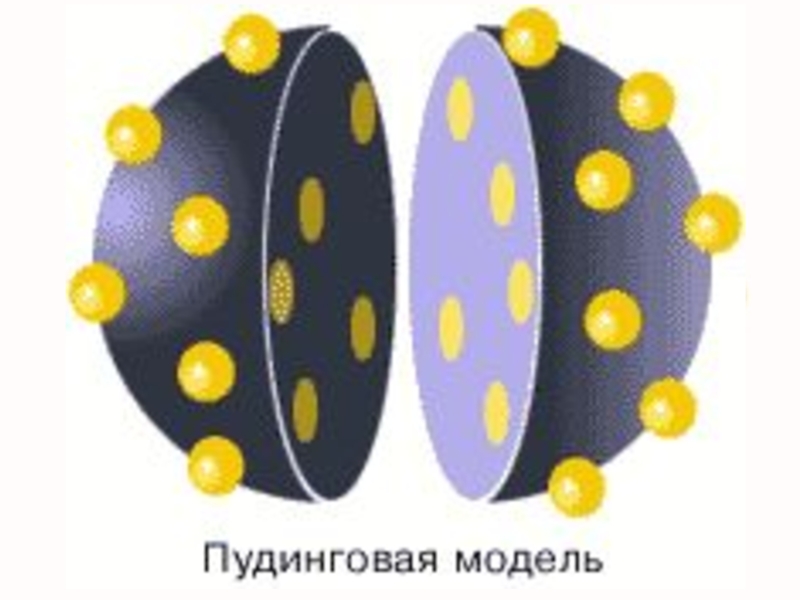
- 33. х В 1903 году Дж. Дж. Томсон, предложил
- 34. Модель Дж.Дж Томсона (1904)
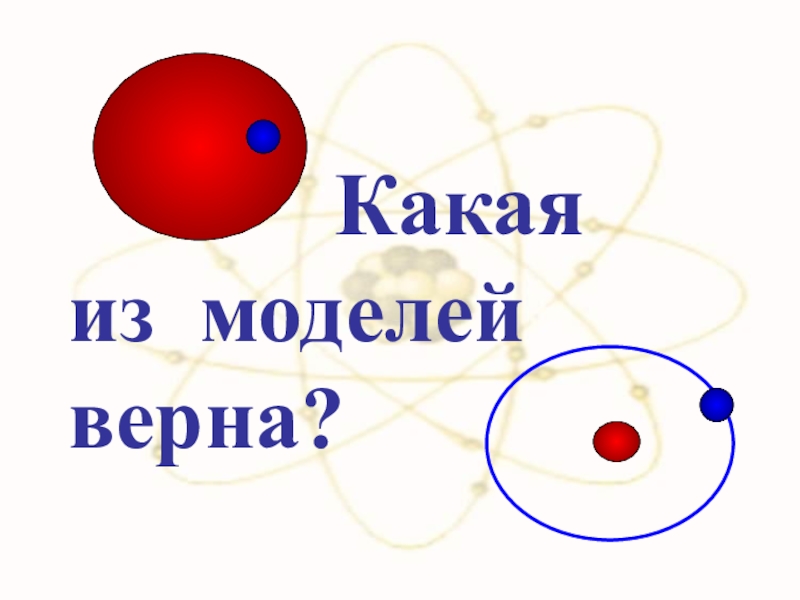
- 35. Какая из моделей верна?
- 36. Планетарная модель строенияатома
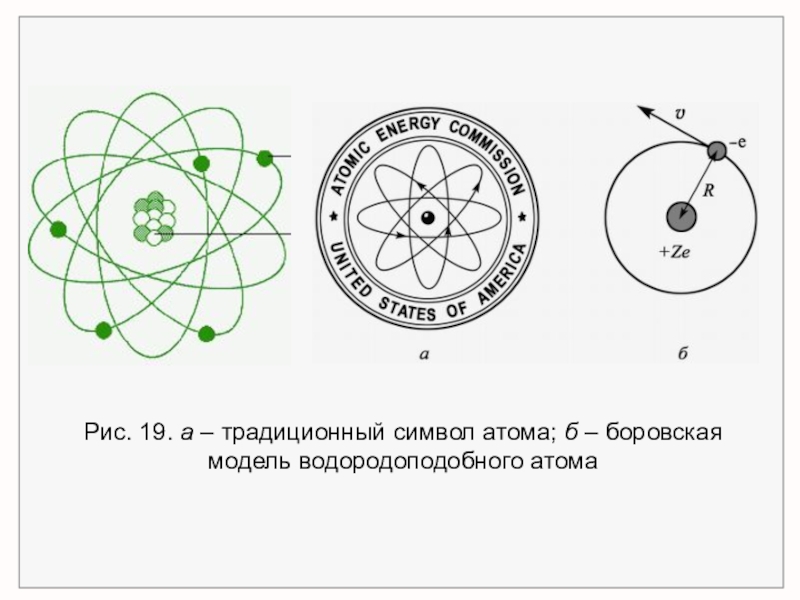
- 37. Рис. 19. а – традиционный символ атома; б – боровская модель водородоподобного атома
- 38. Своими фундаментальными открытиями в
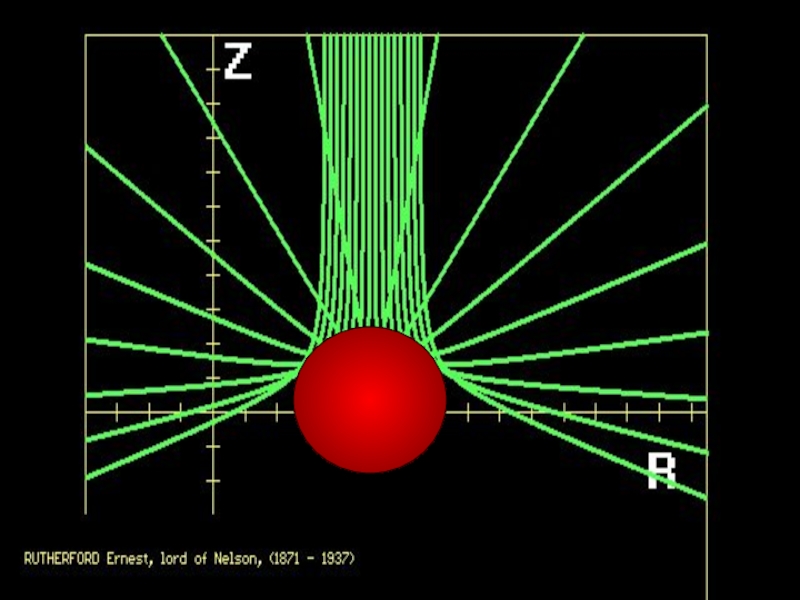
- 39. RUTHERFORD Ernest, Lord of NELSON (1871-1937)
- 40. х1.2. Ядерная модель атома (модель Резерфорда). Скорость
- 41. Большинство α-частиц рассеивалось на углы
- 42. Малая вероятность отклонения на большие углы свидетельствует
- 43. Движение α-частицы происходит по
- 44. Дифференциальное сечение рассеяния –
- 45. Слайд 45
- 46. 10-15м Радиус ядра R
- 47. Альфа - частицаАтом золота?
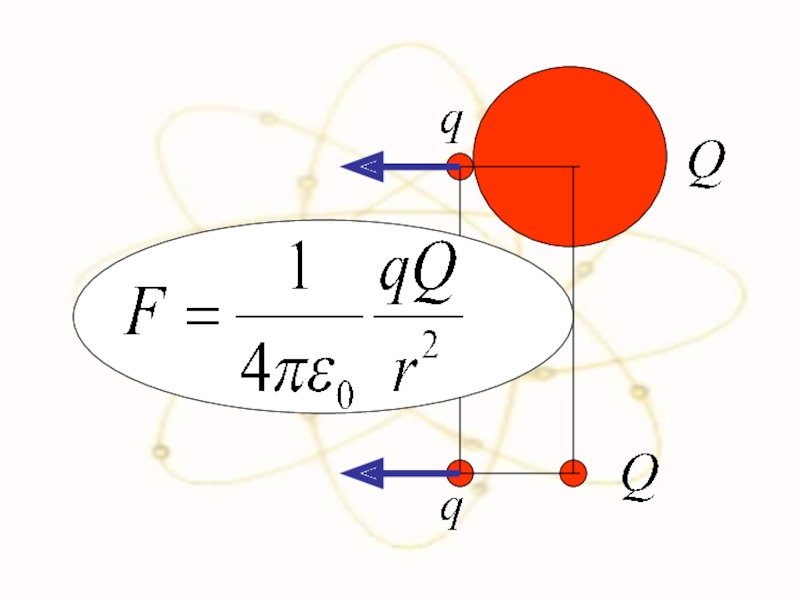
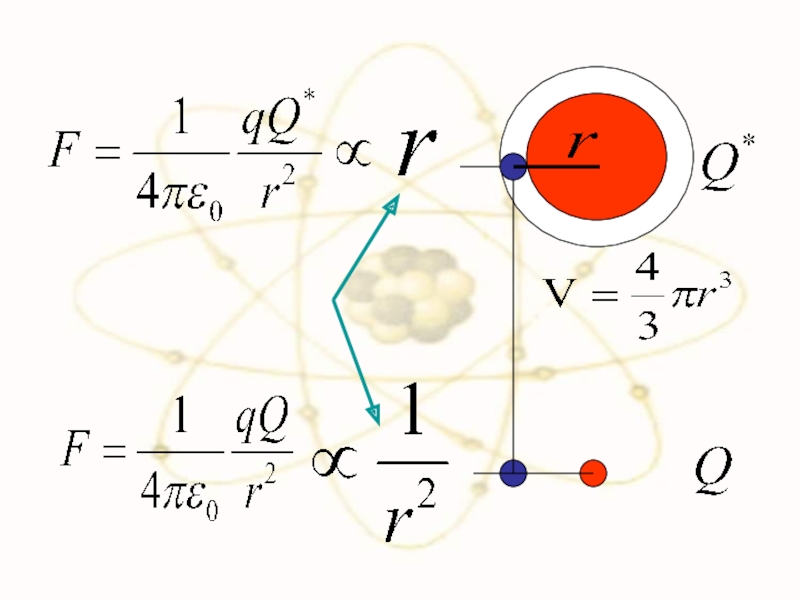
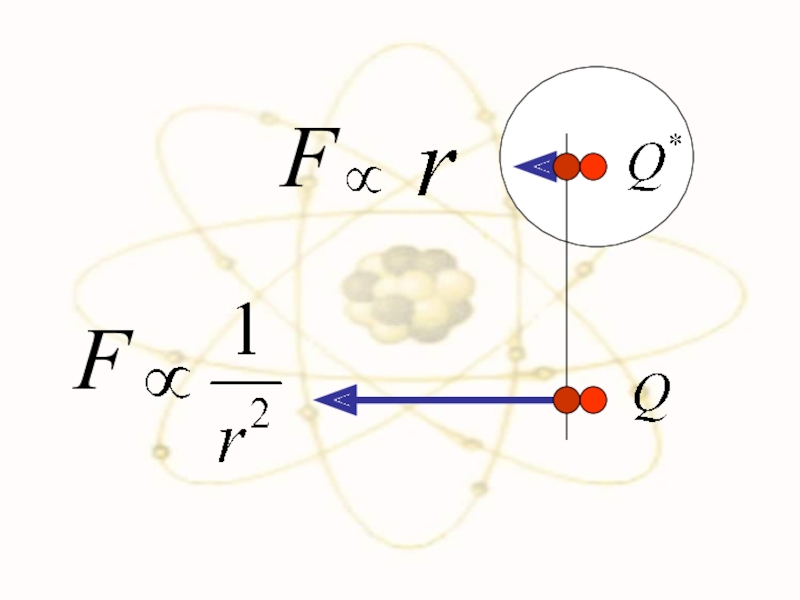
- 48. Сравним силы взаимодействия двух положительно заряженных частиц в разных моделях
- 49. Слайд 49
- 50. Слайд 50
- 51. FF
- 52. С помощью компьютера ...
- 53. Слайд 53
- 54. Однако, планетарная модель
- 55. Слайд 55
- 56. Планетарная модель атома противоречит электродинамике Максвелла!!!
- 57. Согласно теории Максвелла, ускоренно движущийся заряд излучает электромагнитные волны.
- 58. При движении по окружности имеется центростремительное ускорение.
- 59. … излучать и падать...
- 60. Нестабильный атом?!Падать на ядро!
- 61. Попыткой спасения планетарной модели атома стали постулаты Н. Бора
- 62. х1.3. Элементарная теория Бора. БОР Нильс Хендрик
- 63. Слайд 63
- 64. 1. Атом следует описывать как «пирамиду» стационарных
- 65. Слайд 65
- 66. 2. При переходах между стационарными состояниями атом
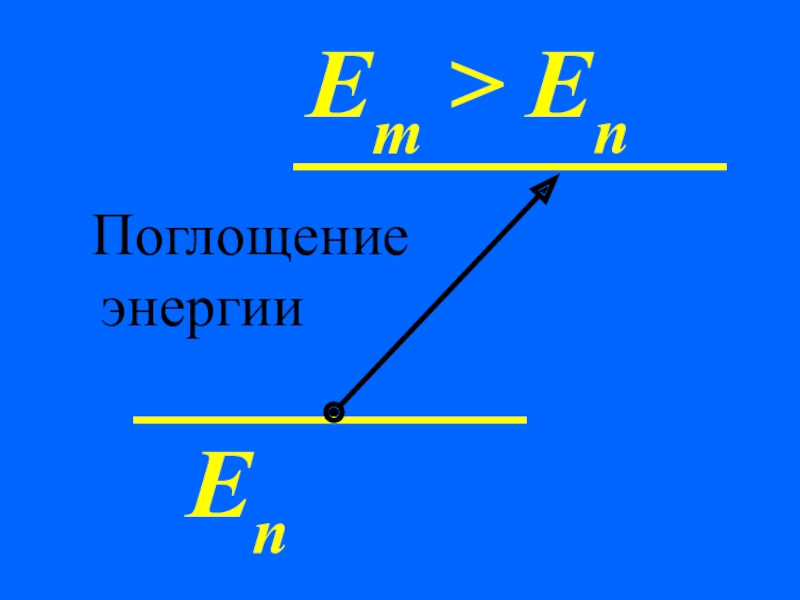
- 67. ЕnEm > En Поглощение энергии
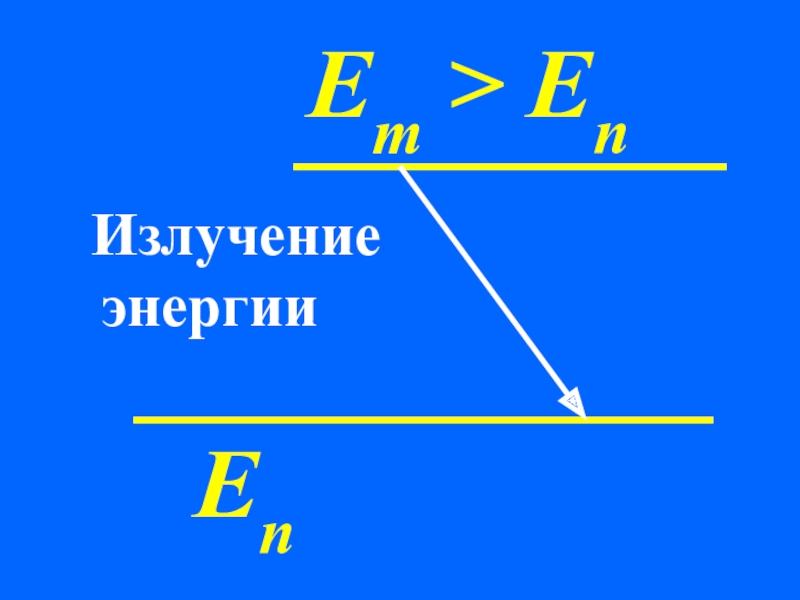
- 68. ЕnEm > En Излучение энергии
- 69. Теория Бора
- 70. 1. Электроны движутся только по определенным (стационарным)
- 71. 2. Излучение или поглощение энергии в виде
- 72. х Уравнение движения
- 73. Радиус первой орбиты водородного атома называют Боровским
- 74. Внутренняя энергия атома слагается из кинетической
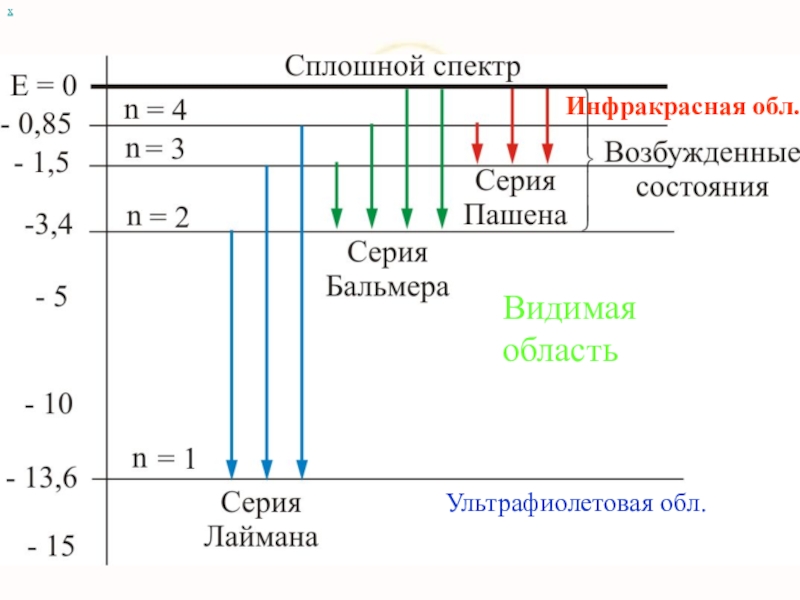
- 75. хВидимая областьИнфракрасная обл.Ультрафиолетовая обл.
- 76. При переходе электрона в атоме водорода из
- 77. Серьезным успехом теории Бора явилось: вычисление постоянной
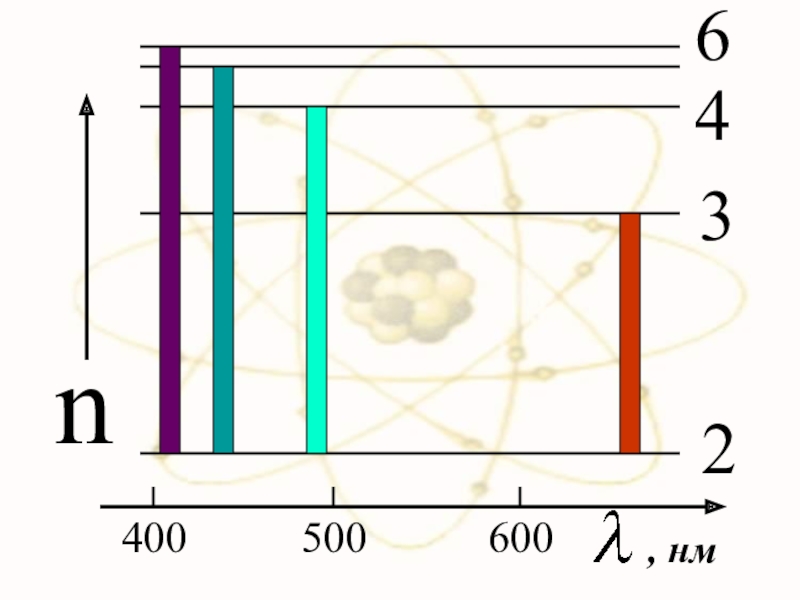
- 78. 400500600n2 346, нм
- 79. Слайд 79
- 80. Бор теоретически вычислил отношение массы протона к
- 81. «Портрет» атома радия( Н. Бор, 1925 )
- 82. х Однако наряду с успехами в теории Бора
- 83. Аналогия теории Бора как слияния двух описаний микромира(Feline)
- 84. х Стало ясно, что теория Бора является лишь
- 85. Дальнейшее развитие квантовой механики привело к отказу
- 86. х1.4. Опыт Франка и Герца. Существование
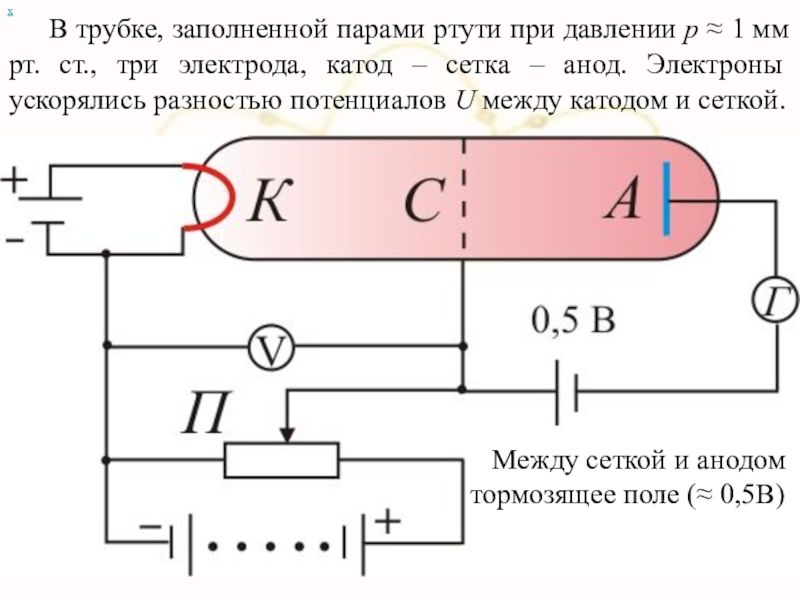
- 87. В трубке, заполненной парами ртути при давлении
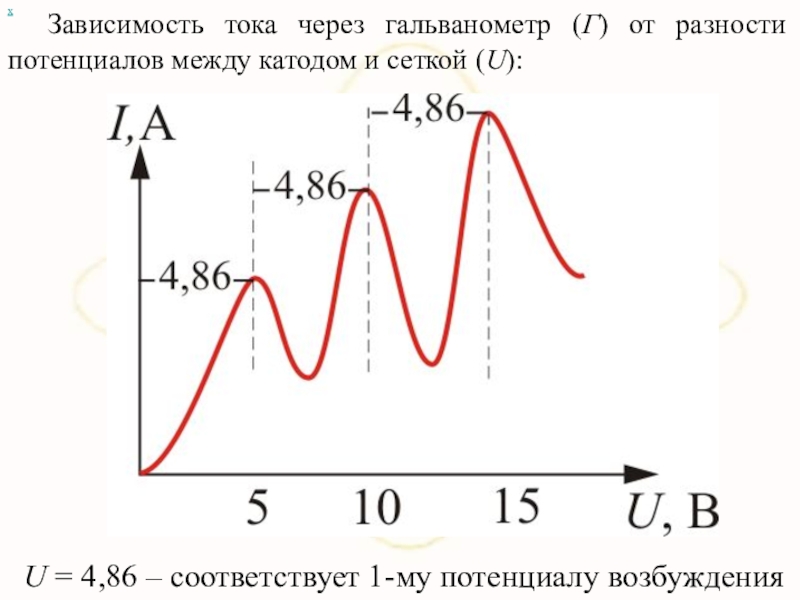
- 88. х Зависимость тока через гальванометр (Г) от разности
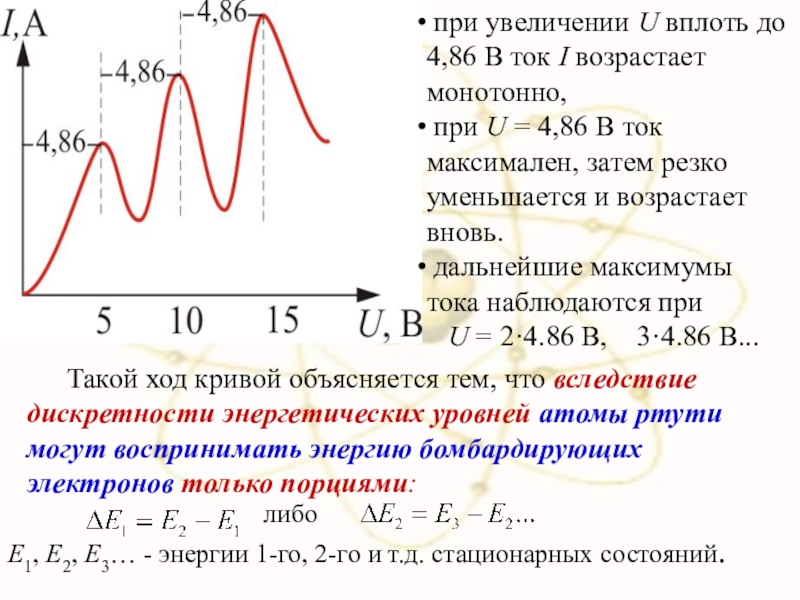
- 89. Такой ход кривой объясняется тем, что вследствие
- 90. При U < 4,86
- 91. Атомы ртути, получившие при соударении с электронами
- 92. Таким образом, опыты Франка и Герца экспериментально
Слайд 1
Краткий курс лекций
по физике
Магомедов Абдул Маграмович
Слайд 2Тема 1. Модели атомов.
Атом водорода по теории Бора.
1.1. Закономерности в атомных
1.2. Ядерная модель атомов.
1.3. Элементарная теория Бора.
1.4. Опыт Франка и Герца.
х
Слайд 51.1. Закономерности в атомных спектрах.
х
Итак, что же такое атом?
Изолированные атомы
Прежде всего было замечено, что линии в спектрах расположены не беспорядочно, а сериями. Расстояние между линиями в серии закономерно уменьшается по мере перехода от длинных волн к коротким.
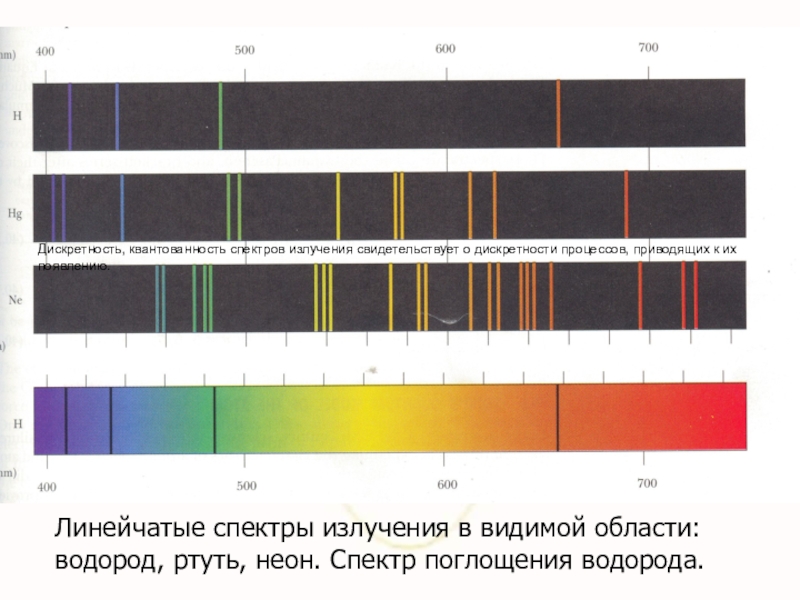
Слайд 7Линейчатые спектры излучения в видимой области: водород, ртуть, неон. Спектр поглощения
Дискретность, квантованность спектров излучения свидетельствует о дискретности процессов, приводящих к их появлению.
Слайд 8 Швейцарский физик Й. Бальмер в 1885 году установил, что длины волн
х
λ0 = const, n = 3, 4, 5,…
В физике постоянной Ридберга называют и другую величину равную R = R′·с.
R = 3,29·1015c-1
R′ = 1,09·107 м-1 – постоянная Ридберга, n = 3, 4, 5,…
или
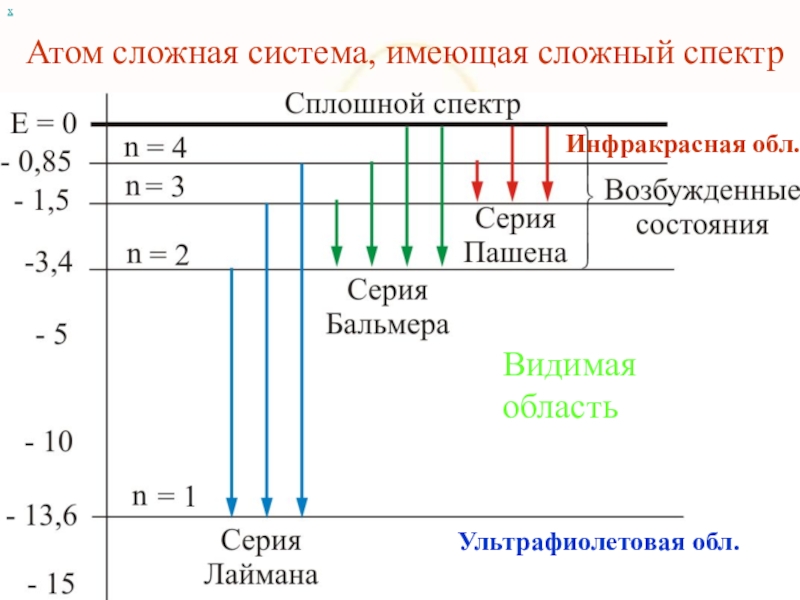
Слайд 11 Атом сложная система, имеющая сложный спектр
х
Видимая
область
Инфракрасная обл.
Ультрафиолетовая обл.
Слайд 18Интерпретация Дальтона:
имеются определенные минимальные количества элементов и веществ (соединений)
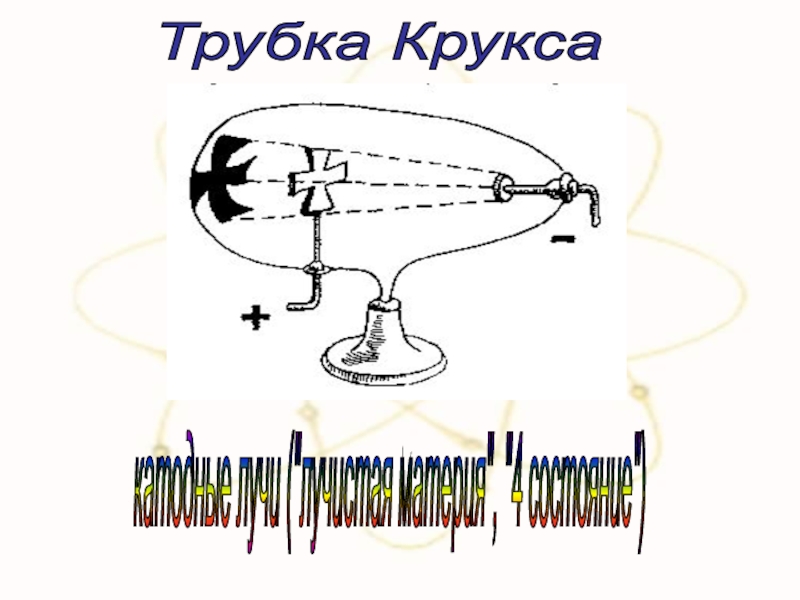
Слайд 19Проблема внутреннего строения атома
Открытие электрона
Исследование тока в разреженных газах
Слайд 213- свойства К-лучей не зависят от типа газа
1 - отклоняются
2 - имеют отрицательный заряд
Результаты:
Слайд 24В состав всех атомов входят частицы малой массы - э л
Как же "устроен" атом?
Слайд 30«То, что находится внизу,
подобно тому,
что находится вверху»
Слайд 33
х
В 1903 году Дж. Дж. Томсон, предложил модель атома: сфера, равномерно
Слайд 38
Своими фундаментальными открытиями в этих областях заложил основы
В 1908 г. ему была присуждена Нобелевская премия.
Резерфорд Эрнест (1871–1937) – английский физик, основопо-ложник ядерной физики.
Исследования посвящены атомной и ядерной физике, радиоактивности.
Слайд 40
х
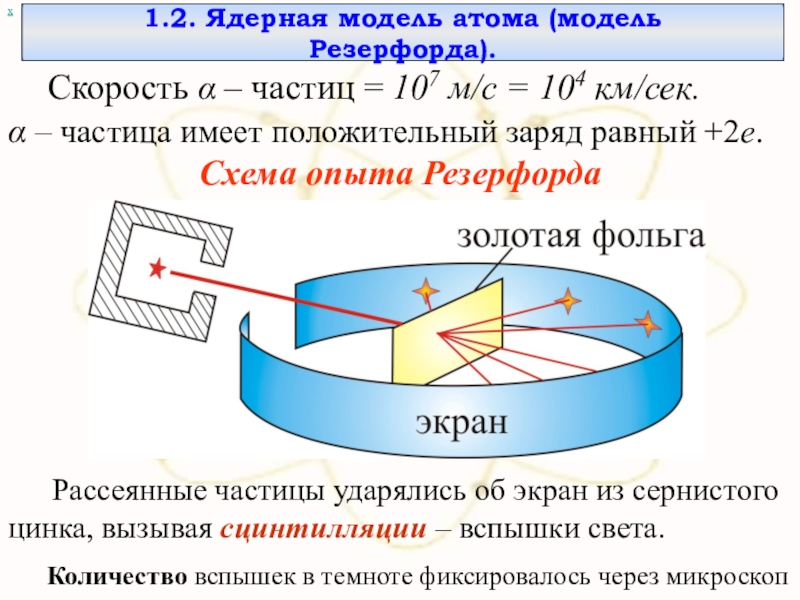
1.2. Ядерная модель атома (модель Резерфорда).
Скорость α – частиц =
α – частица имеет положительный заряд равный +2е.
Схема опыта Резерфорда
Рассеянные частицы ударялись об экран из сернистого цинка, вызывая сцинтилляции – вспышки света.
Количество вспышек в темноте фиксировалось через микроскоп
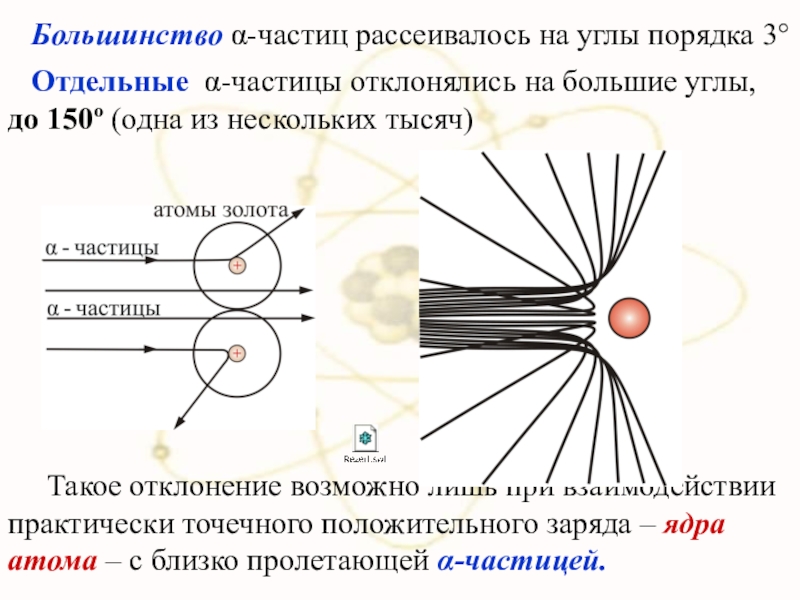
Слайд 41 Большинство α-частиц рассеивалось на углы порядка 3°
Такое отклонение возможно лишь при взаимодействии практически точечного положительного заряда – ядра атома – с близко пролетающей α-частицей.
Слайд 42
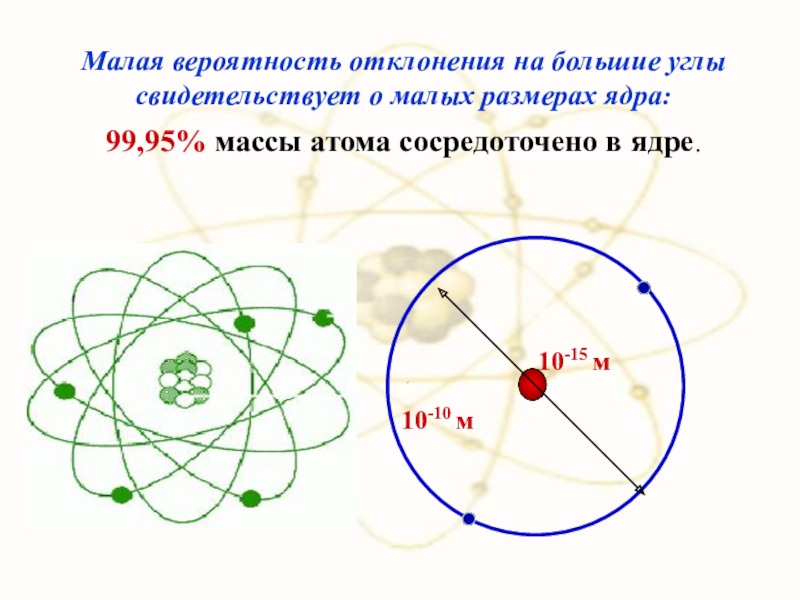
Малая вероятность отклонения на большие углы свидетельствует о малых размерах ядра:
99,95%
10-15 м
10-10 м
Слайд 43 Движение α-частицы происходит по гиперболе:
Угол рассеяния равен углу
m – масса α-частицы,
v – ее скорость вдали от ядра;
Ze – заряд ядра;
b – прицельный параметр.
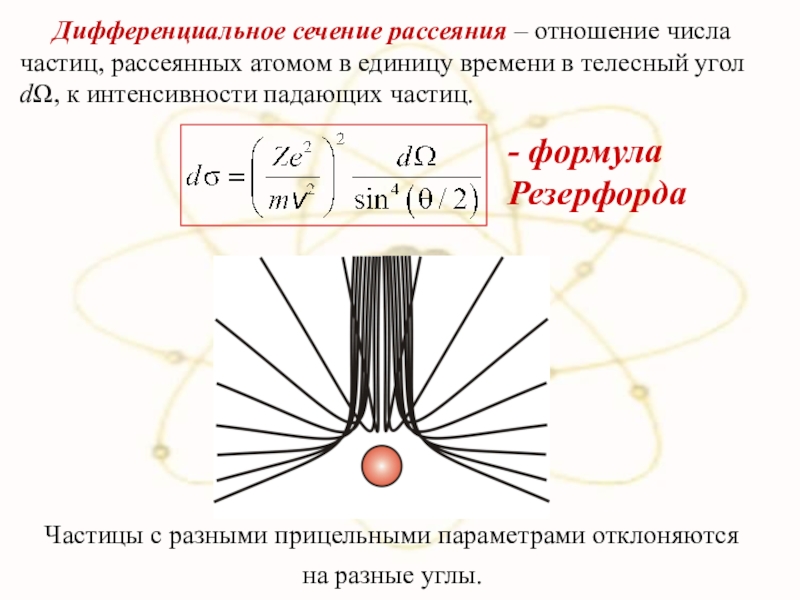
Слайд 44 Дифференциальное сечение рассеяния – отношение числа частиц, рассеянных
Частицы с разными прицельными параметрами отклоняются на разные углы.
- формула Резерфорда
Слайд 54 Однако, планетарная модель была в явном противоречии
Т.о. модель Резерфорда не могла объяснить, почему атом устойчив
Планетарная модель атома
Слайд 58При движении по окружности имеется центростремительное ускорение. Поэтому электрон должен терять
Слайд 62
х
1.3. Элементарная теория Бора.
БОР Нильс Хендрик Давид (1885–1962) – Выдающийся
Сформулировал идею о дискретности
энергетических состояний атомов, в свете новых идей построил атомную модель, открыв условия устойчивости атомов, и объяснил большой круг явлений. Создал первую квантовую модель атома, основанную на двух постулатах, которые прямо противоречили классическим представлениям и законам. Бор много сделал для развития ядерной физики. Он – автор теории составного ядра, один из создателей капельной модели ядра и теории деления атомного ядра.
Слайд 641. Атом следует описывать как «пирамиду» стационарных энергетических состояний. Пребывая в
Слайд 662. При переходах между стационарными состояниями атом поглощает или излучает квант
Слайд 70
1. Электроны движутся только по определенным (стационарным) орбитам. При этом не
Постулаты Бора
n = 1, 2, 3,… главное
квантовое число.
me vr = nħ
Условие для стационарных орбит:
из всех орбит электрона возможны только те, для которых момент импульса электрона, равен целому кратному постоянной Планка:
Слайд 71
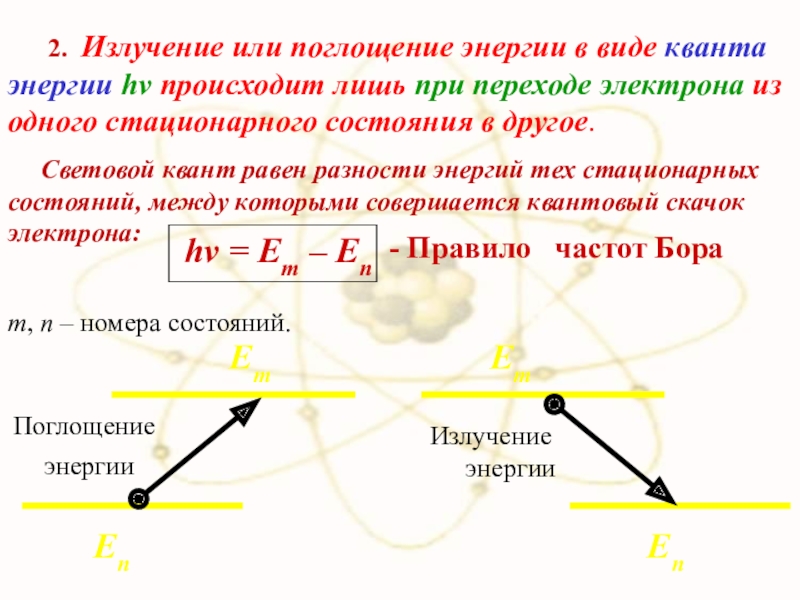
2. Излучение или поглощение энергии в виде кванта энергии hν происходит
Световой квант равен разности энергий тех стационарных состояний, между которыми совершается квантовый скачок электрона:
m, n – номера состояний.
- Правило частот Бора
Поглощение энергии
Еn
Em
Излучение энергии
hv = Em – En
Слайд 72
х
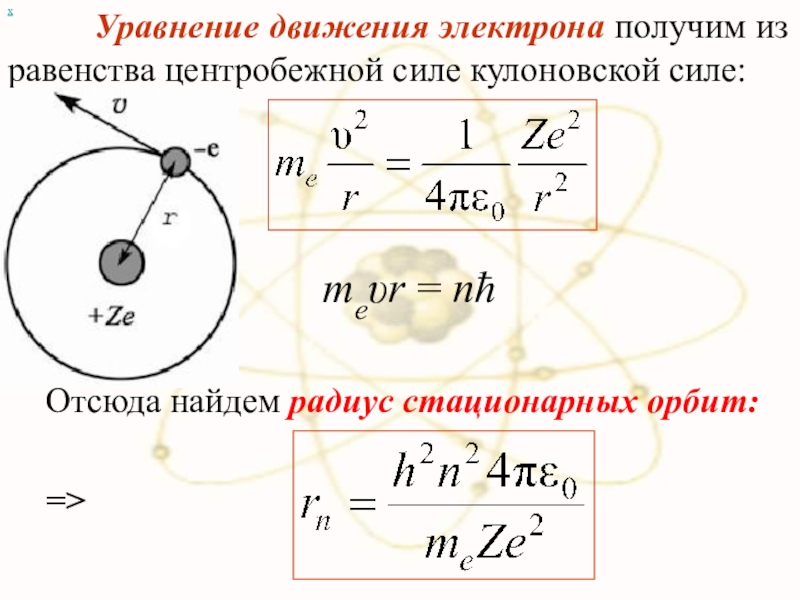
Уравнение движения электрона получим из равенства
=>
Отсюда найдем радиус стационарных орбит:
meυr = nħ
Слайд 73 Радиус первой орбиты водородного атома называют Боровским радиусом:
При n =1,
х
= 0,529·10–10 м.
Å=
Слайд 74 Внутренняя энергия атома слагается из кинетической энергии электрона и потенциальной
х
Отсюда видно, что:
энергия электрона может принимать только
дискретные значения,
т.к.n = 1, 2, 3,…
Отсюда
Слайд 76 При переходе электрона в атоме водорода из состояния n в состояние
х
и частота излучения,
Мы получили обобщенную формулу Бальмера, которая хорошо согласуется с экспериментом, где постоянная Ридберга
Слайд 77 Серьезным успехом теории Бора явилось:
вычисление постоянной Ридберга для водородоподобных систем
объяснение структуры их линейчатых спектров.
Бору удалось объяснить линии спектра ионизованного гелия.
Слайд 80
Бор теоретически вычислил отношение массы протона к массе электрона mp/me =
Теория Бора сыграла огромную роль в создании атомной физики. В период ее развития (1913 – 1925 г.г.) были сделаны важные открытия, навсегда вошедшие в сокровищницу мировой науки.
х
Слайд 82
х
Однако наряду с успехами в теории Бора с самого начала обнаружились
Главнейшее – внутренняя противоречивость теории: механическое соединение классической физики с квантовыми постулатами.
Теория не могла объяснить вопрос об интенсивностях спектральных линий.
Серьезной неудачей являлась абсолютная невозможность применить теорию для объяснения спектров гелия (He) (два электрона на орбите, и уже теория Бора не справляется).
Слайд 84
х
Стало ясно, что теория Бора является лишь переходным этапом на пути
Слайд 85Дальнейшее развитие квантовой механики привело к отказу от механической картины движения
Слайд 86
х
1.4. Опыт Франка и Герца.
Существование дискретных энергетических уровней атома
Немецкие ученые Джеймс Франк и Густав Герц, за экспериментальные исследования дискретности энергетического уровня получили Нобелевскую премию в 1925 г.
Слайд 87 В трубке, заполненной парами ртути при давлении р ≈ 1 мм
х
Между сеткой и анодом тормозящее поле (≈ 0,5В)
Слайд 88
х
Зависимость тока через гальванометр (Г) от разности потенциалов между катодом и
U = 4,86 – соответствует 1-му потенциалу возбуждения
Слайд 89
Такой ход кривой объясняется тем, что вследствие дискретности энергетических уровней атомы
либо
Е1, Е2, Е3… - энергии 1-го, 2-го и т.д. стационарных состояний.
при увеличении U вплоть до 4,86 В ток I возрастает монотонно,
при U = 4,86 В ток максимален, затем резко уменьшается и возрастает вновь.
дальнейшие максимумы тока наблюдаются при
U = 2·4.86 B, 3·4.86 B...
Слайд 90 При U < 4,86 В
энергия электронов
соударения между электронами и атомами ртути носят упругий характер.
При U = 4,86 В
энергия электрона становится достаточной, чтобы вызвать неупругий удар, при котором электрон отдает атому ртути энергию ΔЕ1 и продолжает двигаться с меньшей скоростью;
число электронов, достигающих А, резко уменьшается и ток падает
атом ртути переходит в возбужденное состояние.
При U, кратном 4,86 В
электроны могут испытывать с атомами ртути 2, 3, … неупругих соударения, теряя при этом полностью свою энергию.
анодный ток каждый раз резко уменьшается.
Слайд 91 Атомы ртути, получившие при соударении с электронами энергию ΔЕ1 и перешедшие
-что соответствует
ультрафиолетовому
излучению.
При этом длина волны светового кванта:
Опыт действительно обнаруживает ультрафиолетовую линию с
Слайд 92 Таким образом, опыты Франка и Герца экспериментально подтвердили не только первый,
Эти опыты сыграли огромное значение в развитии атомной физики.