- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Физические свойства воды
Содержание
- 1. Физические свойства воды
- 2. 1.Введение2.Что такое вода?3.Физические свойства вещества 1)Агрегатные состояния вещества 2)Основные характеристики состояний 3)Физические свойства воды 4)Эксперименты4.Термометр 1)История появления термометра 2)Температурные шкалы5.Вывод Содержание.
- 3. Знаете ли вы, что струей воды можно
- 4. какими ещё физическими свойствами обладает вода, и
- 5. Цель : выяснить, какими физическими свойствами обладает
- 6. наблюдение;сбор информации;эксперимент;обобщение.Методы исследования:
- 7. Вода – это окись
- 8. Все вещества могут существовать
- 9. Под свойствами воды понимают совокупность биохимических, органолептических,
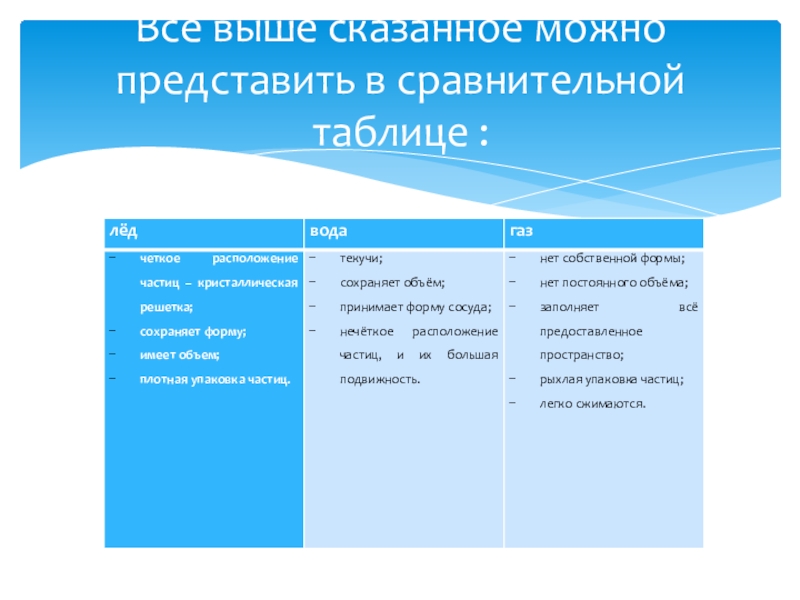
- 10. Всё выше сказанное можно представить в сравнительной таблице :
- 11. Многие свойства воды аномальны, это
- 12. Лёд – является кристаллическим состоянием воды. Этот
- 13. Вода
- 14. Среди всех жидкостей вода имеет
- 15. Как мы выяснили, вода единственное
- 16. Плавление – процесс перехода вещества
- 17. Переход вещества из жидкого состояния
- 18. Сублимация
- 19. - При температуре в 0°C вода замерзает,
- 20. Опыт 1. «Кипение воды»Цель: пронаблюдать кипение различных
- 21. 1 день
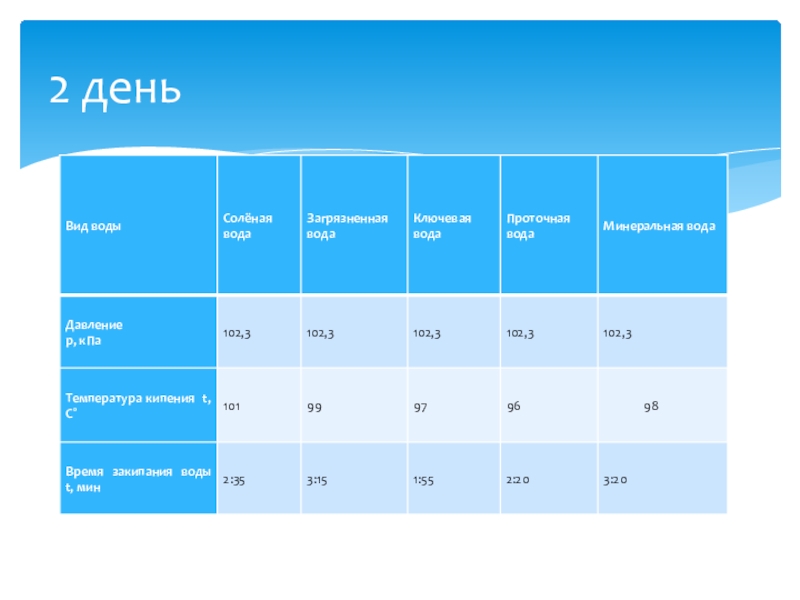
- 22. 2 день
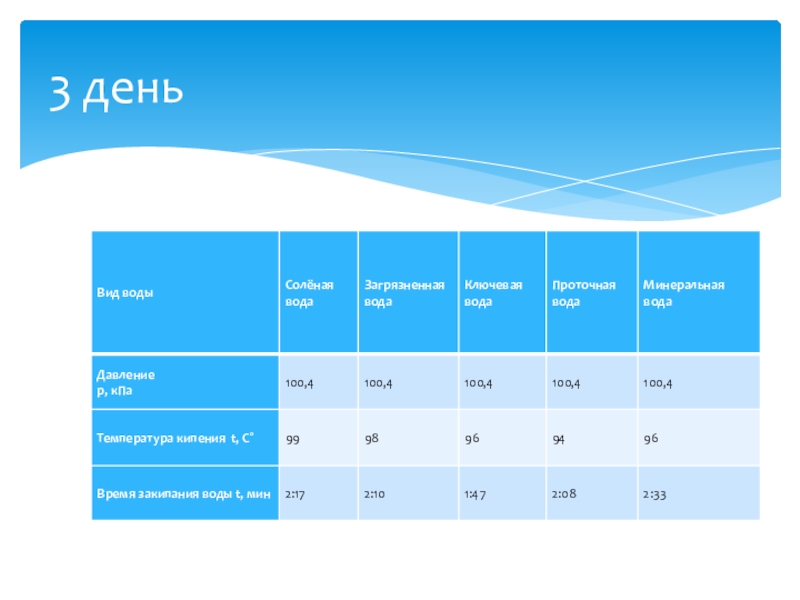
- 23. 3 день
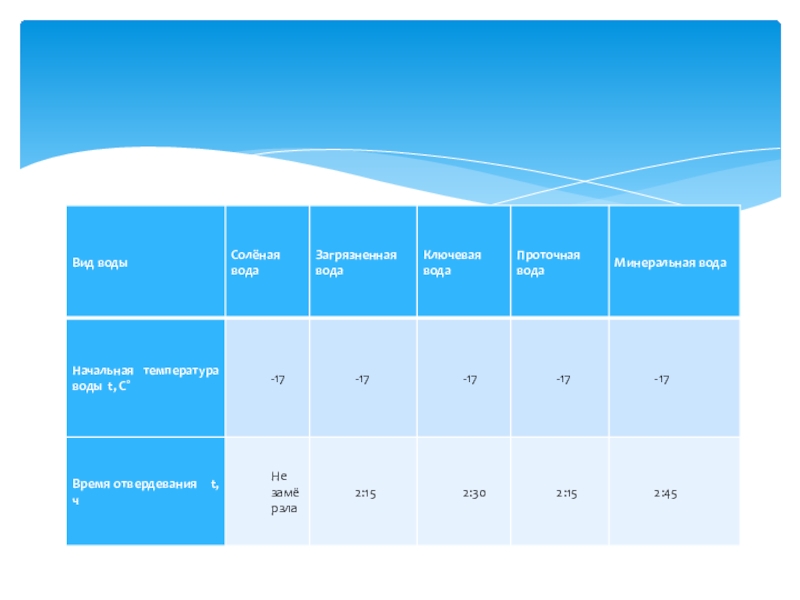
- 24. Опыт 2. «Кристаллизация воды»Цель: пронаблюдать отвердевание различных
- 25. Слайд 25
- 26. Термометр - прибор для измерения температуры воздуха,
- 27. До изобретения такого обыденного и
- 28. учитывалось. В 1694 году Карло Ренальдини предложил
- 29. Слайд 29
- 30. В мире существует и используется
- 31. На сегодняшний день используются термометры со шкалой
- 32. 1.«Я познаю мир: Детская энциклопедия: Химия» :
- 33. Спасибо за внимание!
Слайд 1Проект по теме «Физические свойства воды».
Выполнила: ученица 6Г класса МБОУСОШ№12 имени
Руководитель : Сухарева Лариса Алексеевна.
Слайд 21.Введение
2.Что такое вода?
3.Физические свойства вещества
1)Агрегатные состояния вещества
2)Основные характеристики состояний
3)Физические свойства воды
4)Эксперименты
4.Термометр
1)История
2)Температурные шкалы
5.Вывод
Содержание.
Слайд 3Знаете ли вы, что струей воды можно перерезать стальную броню или
Технику резки водой разработал в 1967 году Норман Франц из американского университета Индиана. Изобретатель доказал, что струя воды, мчащаяся вдвое быстрее звука, режет сильнее и точнее, чем стальной резец. Такую скорость можно получить, пропуская воду через микро дырку в сверхтвердом техническом кристалле сапфира под огромным давлением.
Введение.
Слайд 4какими ещё физическими свойствами обладает вода, и каковы её агрегатные состояния.
Актуальность темы:
Слайд 5 Цель : выяснить, какими физическими свойствами обладает вода.
Задачи :
Изучить физические свойства
Провести практические исследования.
Используя информационные источники, расширить свои теоретические знания о физических свойствах воды.
Рассказать о процессах и явлениях, связанных с физическими свойствами воды.
Цель и задачи проекта:
Слайд 7 Вода – это окись водорода, она является наиболее
По массе в состав воды входит почти 89 % кислорода и 11 % водорода, вода кипит при температуре +100°С, а замерзает при 0°С. Является плохим проводником для электричества, но хороший растворитель.
Что такое вода?
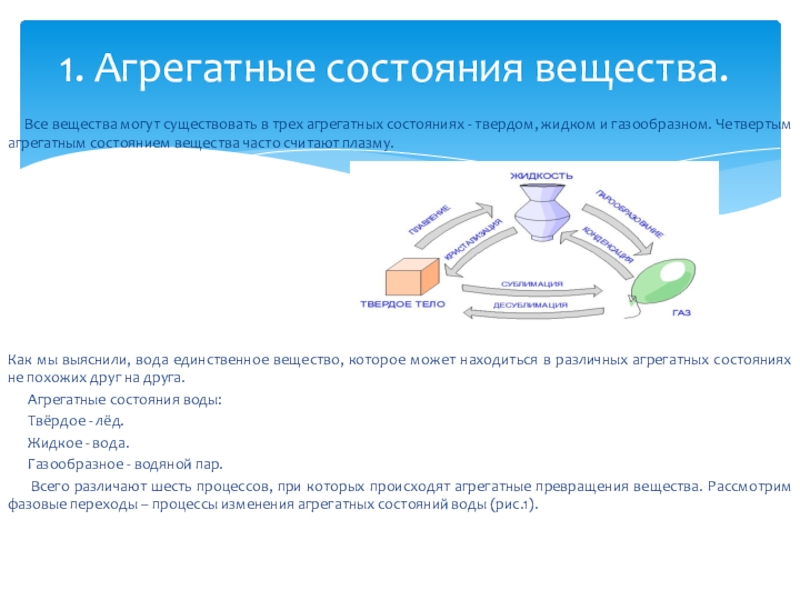
Слайд 8 Все вещества могут существовать в трех агрегатных состояниях
Как мы выяснили, вода единственное вещество, которое может находиться в различных агрегатных состояниях не похожих друг на друга.
Агрегатные состояния воды:
Твёрдое - лёд.
Жидкое - вода.
Газообразное - водяной пар.
Всего различают шесть процессов, при которых происходят агрегатные превращения вещества. Рассмотрим фазовые переходы – процессы изменения агрегатных состояний воды (рис.1).
1. Агрегатные состояния вещества.
Слайд 9Под свойствами воды понимают совокупность биохимических, органолептических, физико-химических, физических, химических и
Физические свойства вещества
Слайд 11 Многие свойства воды аномальны, это вызвано особенностями строения молекулы
Физические свойства воды аномальны, вода является единственным веществом на Земле, существующим в жидком, твердом и газообразном состояниях.
2.Основновные характеристики состояний.
Слайд 12Лёд – является кристаллическим состоянием воды. Этот минерал имеет химическую формулу
Структура кристаллов льда схожа со структурой алмаза: любая молекула находится в окружении четырех ближайших к ней молекул, которые располагаются на равных 2,76А расстояниях от нее и находящихся в углах правильного тетраэдра. Поскольку координационное число низкое, то лед имеет ажурную структуру, что сказывается на его плотности (0,917).
Вода, превращаясь в лёд, увеличивает свой объём примерно на 9 %. Лёд, будучи легче жидкой воды, образуется на поверхности водоёмов, что препятствует дальнейшему замерзанию воды.
Высокая удельная теплота плавления льда, равная 330 кДж/кг, (для сравнения — удельная теплоты плавления железа равна 270 кДж/кг) , служит важным фактором в обороте тепла на Земле. Так, чтобы растопить 1 кг льда или снега, нужно столько же тепла, сколько требуется, чтобы нагреть литр воды от 0 до 80 °C.
Лёд встречается в природе в виде собственно льда (материкового, плавающего, подземного) , а также в виде снега, инея и т. д. Под действием собственного веса лёд приобретает пластические свойства и текучесть.
Природный лёд обычно значительно чище, чем вода, так как при кристаллизации воды в первую очередь в решётку встают молекулы воды. Лёд может содержать механические примеси — твёрдые частицы, капельки концентрированных растворов, пузырьки газа. Наличием кристалликов соли и капелек рассола объясняется солоноватость морского льда.
А также он является бесцветным. Синеватый оттенок лед получает в немалых скоплениях. Имеет стеклянный блеск. Прозрачный. Не обладает спайностью. Твердость – 1,5. Непрочный. Показатель преломления весьма низкий (n = 1,309).
лёд
Слайд 14 Среди всех жидкостей вода имеет самое высокое поверхностное натяжение,
По массе в состав воды входит 88,81% кислорода и 11,19% водорода, вода кипит при температуре +100С, а замерзает при 0С , она плохой проводник для электричества и теплоты, но хороший растворитель.
Существуют разновидные воды: обычная и тяжелая.
Тяжелой водой (DO) называется та вода, в состав которой входит изотоп водорода дейтерии, химические реакции с такой водой протекают медленнее, чем с обычной. Используют в ядерной энергетике (ядерные реакторы).
Особенностью воды является то, что ее молекулы способны при колебании температуры изменять характер связи друг с другом. Основные свойства ее при этом не меняются. Если нагревать воду, ее молекулы начинают двигаться быстрее. Те, которые соприкасаются с воздухом, разрывают свои связи и смешиваются с его молекулами.
Вода в газообразном состоянии (газ) сохраняет все свои качества, но приобретает также свойства газа. Ее частицы находятся на большом расстоянии друг от друга и интенсивно двигаются. Чаще всего такое состояние называют водяным паром. Это бесцветный прозрачный газ, который при определенных условиях опять превратится в воду. Он повсеместно распространен на Земле, но чаще всего его не видно. Примеры воды в газообразном состоянии - это облака, туман или водяной пар, образующийся при кипении жидкости. Кроме того, она везде находится в составе воздуха. Ученые заметили, что при его увлажнении дышать становится легче.
Переходы между ними сопровождаются скачкообразным изменением ряда физических свойств (плотности, теплопроводности и др.).
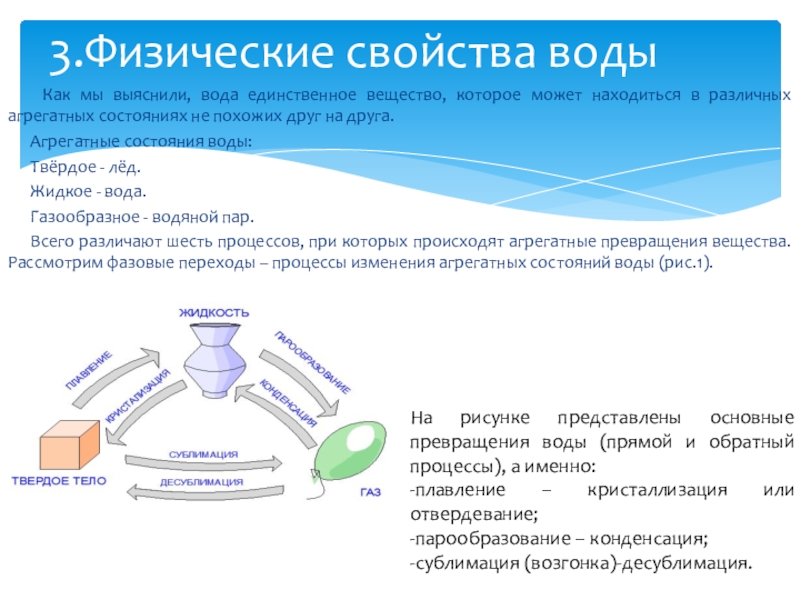
Слайд 15 Как мы выяснили, вода единственное вещество, которое может находиться
Агрегатные состояния воды:
Твёрдое - лёд.
Жидкое - вода.
Газообразное - водяной пар.
Всего различают шесть процессов, при которых происходят агрегатные превращения вещества. Рассмотрим фазовые переходы – процессы изменения агрегатных состояний воды (рис.1).
3.Физические свойства воды
На рисунке представлены основные превращения воды (прямой и обратный процессы), а именно:
-плавление – кристаллизация или отвердевание;
-парообразование – конденсация;
-сублимация (возгонка)-десублимация.
Слайд 16 Плавление – процесс перехода вещества из твердого состояния в
Плавления
Слайд 17 Переход вещества из жидкого состояния в газообразное называется парообразованием,
парообразование
Слайд 19- При температуре в 0°C вода замерзает, то есть превращается в
- При давлении в 611,73 Па (около 0,006 атм) температура кипения и плавления совпадает и становится равной 0,01°C. Такое давление и температура называются тройной точкой воды. При температуре 374°C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают.
- При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки льда падает со снижением давления.
- При более высоком давлении нет разницы между жидкой водой и водяным паром, следовательно, нет и кипения или испарения. Так же возможны метастабильные состояния - пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход.
В природе распространены тепловые явления: нагревание и охлаждение, испарение и конденсация, кипение, плавление и отвердевание. Тепловое расширение тел — тепловое явление, которое проявляется в природе, учитывается в быту и технике.
Особенности фазовых переходов
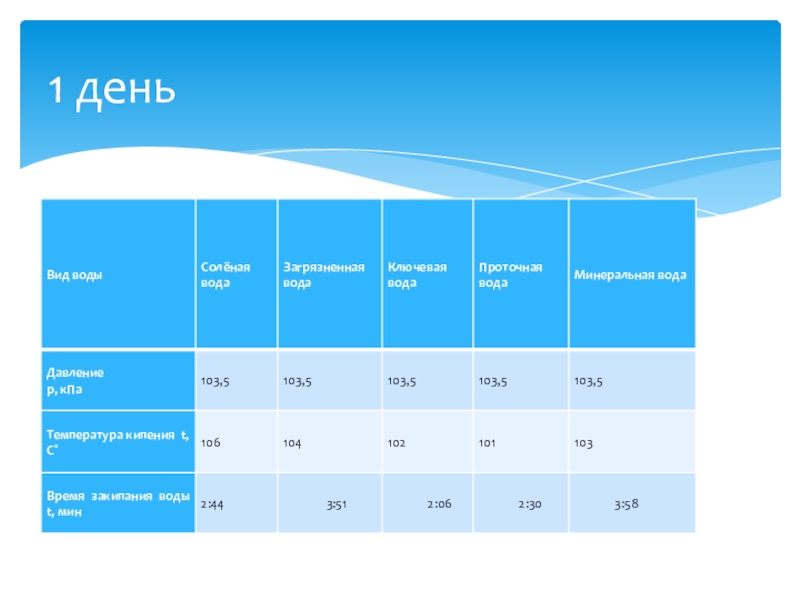
Слайд 20Опыт 1. «Кипение воды»
Цель: пронаблюдать кипение различных видов воды, при постоянной
Оборудование: барометр, секундомер, спиртовка, пробирки, держатель для пробирок, термометр, различные виды воды, демонстрационный столик.
Ход работы:
Опыт 1. «кипение воды»
Слайд 24Опыт 2. «Кристаллизация воды»
Цель: пронаблюдать отвердевание различных видов воды, при постоянной
Оборудование: пластиковые стаканчики, термометр уличный, часы, различные виды воды.
Ход работы: опыт проводился при температуре окружающей среды -11°С и одинаковом атмосферном давлении равном 100,7кПа.
Кристаллизация воды
Слайд 26Термометр - прибор для измерения температуры воздуха, почвы, воды и так
жидкостные;
механические;
электрические;
оптические;
газовые;
инфракрасные.
Жидкостные термометры основаны на принципе изменения объёма жидкости, которая залита в термометр (обычно это спирт или ртуть), при изменении температуры окружающей среды.
Механические термометры действуют по тому же принципу, что и электронные, но в качестве датчика обычно используется металлическая спираль или лента из биметалла.
Принцип работы электрических термометров основан на изменении сопротивления проводника при изменении температуры окружающей среды.
Оптические термометры позволяют регистрировать температуру благодаря изменению уровня светимости, спектра и иных параметров при изменении температуры.
Инфракрасный термометр позволяет измерять температуру без непосредственного контакта с человеком. В некоторых странах уже давно имеется тенденция отказа от ртутных термометров в пользу инфракрасных не только в медицинских учреждениях, но и на бытовом уровне.
Термометр
Слайд 27 До изобретения такого обыденного и простого для нашей повседневной
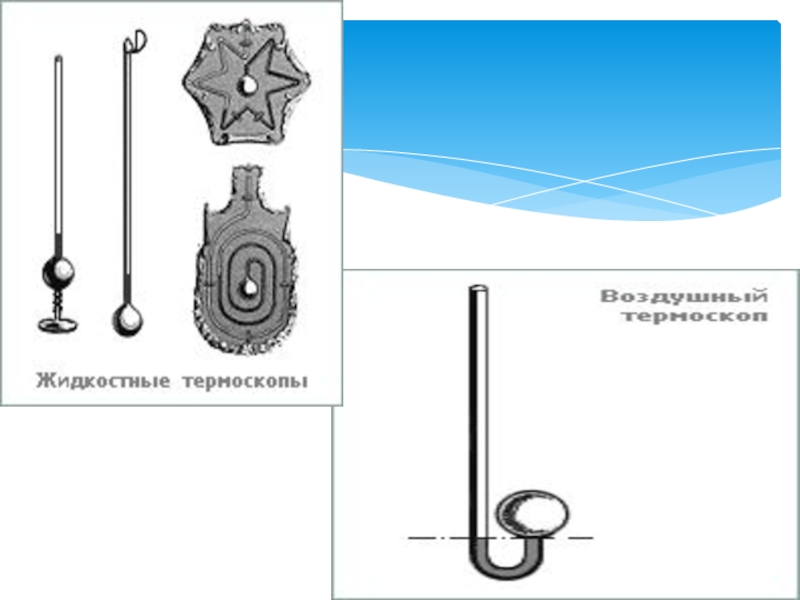
История термодинамики началась, когда в 1592 году Галилео Галилей создал первый прибор для наблюдений за изменениями температуры, назвав его термоскопом. Термоскоп представлял собой небольшой стеклянный шарик с припаянной стеклянной трубкой. Шарик нагревали, а конец трубки опускали в воду. Когда шарик охлаждался, давление в нем уменьшалось, и вода в трубке под действием атмосферного давления поднималась на определенную высоту вверх. При потеплении уровень воды в трубки опускался вниз. Недостатком прибора было то, что по нему можно было судить только об относительной степени нагрева или охлаждения тела, так как шкалы у него еще не было.
Позднее флорентийские ученые усовершенствовали термоскоп Галилея, добавив к нему шкалу из бусин и откачав из шарика воздух.
В 17 веке воздушный термоскоп был преобразован в спиртовой флорентийским ученым Торричелли. Прибор был перевернут шариком вниз, сосуд с водой удалили, а в трубку налили спирт. Действие прибора основывалось на расширении спирта при нагревании, - теперь показания не зависели от атмосферного давления. Это был один из первых жидкостных термометров.
На тот момент показания приборов еще не согласовывались друг с другом, поскольку никакой конкретной системы при градуировке шкал не
1. История появления термометра
Слайд 28учитывалось. В 1694 году Карло Ренальдини предложил принять в качестве двух
Такова основная история возникновения термометра. Сегодня существует множество устройств, применяемых в промышленности, в быту, в научных исследованиях – термометры расширения и лабораторное оборудование, термоэлектрические и термометры сопротивления, а также пирометрические термометры, позволяющие измерять температуру бесконтактным способом.
Слайд 30 В мире существует и используется несколько температурных шкал. Давайте
В 1714 году Д. Г. Фаренгейт изготовил ртутный термометр. На шкале он обозначил три фиксированные точки: нижняя, 32 °F - температура замерзания солевого раствора, 96 ° - температура тела человека, верхняя 212 ° F - температура кипения воды. Термометром Фаренгейта пользовались в англоязычных странах вплоть до 70-х годов 20 века, а в США пользуются и до сих пор.
Еще одна шкала была предложена французским ученым Реомюром в 1730 году. Он делал опыты со спиртовым термометром и пришел к выводу, что шкала может быть построена в соответствии с тепловым расширением спирта. Установив, что применяемый им спирт, смешанный с водой в пропорции 5:1, расширяется в отношении 1000:1080 при изменении температуры от точки замерзания до точки кипения воды, ученый предложил использовать шкалу от 0 до 80 градусов. Приняв за 0 ° температуру таяния льда, а за 80 ° температуру кипения воды при нормальном атмосферном давлении.
В 1742 году шведский ученый Андрес Цельсий предложил шкалу для ртутного термометра, в которой промежуток между крайними точками был разделен на 100 градусов. При этом сначала температура кипения воды была обозначена как 0 °, а температура таяния льда как 100 °. Однако в таком виде шкала оказалась не очень удобной, и позднее астрономом М. Штремером и ботаником К. Линнеем было принято решение поменять крайние точки местами.
М. В. Ломоносовым был предложен жидкостный термометр, имеющий шкалу со 150 делениями от точки плавления льда до точки кипения воды. И. Г. Ламберту принадлежит создание воздушного термометра со шкалой 375 °, где за один градус принималась одна тысячная часть расширения объема воздуха. Были также попытки создать термометр на основе расширения твердых тел. Так в 1747 голландец П. Мушенбруг использовал расширение железного бруска для измерения температуры плавления ряда металлов.
К концу 18 века количество различных температурных шкал значительно увеличилось. По данным «Пилометрии» Ламберта на тот момент их насчитывалось 19.
Температурные шкалы, о которых шла речь выше, отличает то, что точка отсчета для них была выбрана произвольно. В начале 19 века английским ученым лордом Кельвином была предложена абсолютная термодинамическая шкала. Одновременно Кельвин обосновал понятие абсолютного нуля, обозначив им температуру, при которой прекращается тепловое движение молекул. По Цельсию это -273,15 °С.
На рисунке 2 представлены три температурные шкалы и сравнение этих шкал.
2. Температурные шкалы
Слайд 31На сегодняшний день используются термометры со шкалой Цельсия, Фаренгейта (в США),
Слайд 321.«Я познаю мир: Детская энциклопедия: Химия» : Л. А. Савина; М.:
2.«Я познаю мир: Детская энциклопедия: Физика» : А. А. Леонович; М.: АСТ, 2001г.
3.«Физика и Астрономия 8кл.»: А. А. Пинский, В. Г. Разумовский; М.: Просвещение, 1997г.
4.«Физика 7кл.»: А. В, Перышкин, М.: Дрофа, 2003г.
http://www.gc-bars.ru/articles/5.htm
http://inetzar.ucoz.ru/load/fizike/16
Литература: