- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по предмету Естествознание, раздел Биология
Содержание
- 1. Презентация по предмету Естествознание, раздел Биология
- 2. Ферменты, или энзимы, — это органические катализаторы
- 3. Размер молекул. Понятно, что, будучи по своей
- 4. Селективность. Каждый фермент ускоряет только одну какую-либо
- 5. Эффективность. Большинство ферментов обладает очень высокой эффективностью.
- 6. Зависимость от температуры. Многие ферменты обладают наибольшей
- 7. Многие ферменты для проявления активности нуждаются в
- 8. В 1961 г. специальной комиссией Международного биохимического
- 9. Значение ферментов невозможно переоценить. Только в человеческом
- 10. СПАСИБО ЗА ВНИМАНИЕ
Ферменты, или энзимы, — это органические катализаторы белковой природы, которые ускоряют реакции, необходимые для функционирования живых организмов.Так как реакции обмена веществ, протекающие в организмах, можно разделить на два типа процессов: синтез(анаболические) распад (катаболические) то соответственно можно
Слайд 2Ферменты, или энзимы, — это органические катализаторы белковой природы, которые ускоряют
реакции, необходимые для функционирования живых организмов.Так как реакции обмена веществ, протекающие в организмах, можно разделить на два типа процессов:
синтез(анаболические)
распад (катаболические)
то соответственно можно выделить и два типа ферментов. Примером анаболического фермента может служить глутаминсинтетаза. Примером катаболического фермента может служить мальтаза.
Сейчас химикам известно более 2000 ферментов. Все они обладают рядом специфических свойств, отличающих их от неорганических катализаторов.
синтез(анаболические)
распад (катаболические)
то соответственно можно выделить и два типа ферментов. Примером анаболического фермента может служить глутаминсинтетаза. Примером катаболического фермента может служить мальтаза.
Сейчас химикам известно более 2000 ферментов. Все они обладают рядом специфических свойств, отличающих их от неорганических катализаторов.
Слайд 3Размер молекул.
Понятно, что, будучи по своей природе белками, ферменты должны
иметь большие значения молекулярной массы. Действительно, она может колебаться в пределах от 105 до 107, а это значит, что по своему размеру молекулы ферментов попадают в разряд коллоидных частиц. Это не позволяет отнести их ни к гомогенным, ни к гетерогенным катализаторам. Остается отнести их к особому классу катализаторов.
Слайд 4Селективность.
Каждый фермент ускоряет только одну какую-либо реакцию или группу однотипных
реакций. Эту их особенность называют селективностью (избирательностью) действия. Она позволяет организму быстро и точно выполнить четкую программу синтеза нужных ему соединений на основе молекул пищевых веществ или продуктов их превращения. Располагая богатым набором ферментов, клетка разлагает молекулы белков, жиров и углеводов до небольших фрагментов-мономеров (аминокислот, глицерина и жирных кислот, моносахаридов соответственно) и из них заново строит белковые и иные молекулы, которые будут точно соответствовать потребностям данного организма. Недаром великий русский физиолог, нобелевский лауреат И. П. Павлов назвал ферменты носителями жизни.
Слайд 5Эффективность.
Большинство ферментов обладает очень высокой эффективностью. Скорость некоторых ферментативных реакций
может быть в 1015 раз больше скорости реакций, протекающих в их отсутствие. Такая высокая эффективность ферментов объясняется тем, что их молекулы в процессе «работы» очень быстро восстанавливаются (регенерируют). Типичная молекула фермента может регенерировать миллионы раз за минуту, например, широко используемый в сыроделии фермент реннин способен вызывать коагуляцию (свертывание) белков молока в количествах, в миллионы раз превышающих его собственную массу. Этот фермент вырабатывается слизистой оболочкой особого отдела желудка жвачных животных — сычуга.
Слайд 6Зависимость от температуры.
Многие ферменты обладают наибольшей эффективностью при температуре человеческого
тела, т. е. приблизительно при 37 °С. Человек погибает при более низких и более высоких температурах не столько из-за того, что его убила болезнь, а в первую очередь из-за того, что перестают действовать ферменты, а следовательно, прекращаются обменные процессы, которые и определяют сам процесс жизни. Неорганические катализаторы сохраняют активность в более широком интервале температур. Вспомните, например, синтез аммиака, который проводят при температуре 450—500 °С (катализатор — железо).
Слайд 7Многие ферменты для проявления активности нуждаются в веществах небелковой природы —
так называемых кофакторах. В роли последних могут выступать ионы металлов (цинка, марганца, кальция и др.) или молекулы органических соединений; в последнем случае их называют коферментажи. Иногда для действия фермента бывает необходимо присутствие как ионов металла, так и коферментов.
В некоторых случаях кофермент очень прочно соединен с белком, например у каталазы, где кофермент представляет собой комплексное соединение железа с белком — гемоглобин.
В других ферментах коферменты представляют собой вещества, близкие к витаминам, которые являются предшественниками коферментов. Например, из витамина Вх (тиамина) в клетках образуется тиаминпирофосфат — кофермент важного фермента, входящего в группу декарбоксилаз; из витамина В12 образуются коферменты, необходимые для усвоения жирных кислот с нечетным числом атомов углерода.
В некоторых случаях кофермент очень прочно соединен с белком, например у каталазы, где кофермент представляет собой комплексное соединение железа с белком — гемоглобин.
В других ферментах коферменты представляют собой вещества, близкие к витаминам, которые являются предшественниками коферментов. Например, из витамина Вх (тиамина) в клетках образуется тиаминпирофосфат — кофермент важного фермента, входящего в группу декарбоксилаз; из витамина В12 образуются коферменты, необходимые для усвоения жирных кислот с нечетным числом атомов углерода.
Слайд 8В 1961 г. специальной комиссией Международного биохимического союза была предложена систематическая
номенклатура ферментов. Согласно этой номенклатуре ферменты были поделены на шесть групп в соответствии с общим типом реакции, которую они катализируют. Каждый фермент при этом получил систематическое название, точно описывающее катализируемую им реакцию. Однако, поскольку многие из этих систематических названий оказались очень длинными и сложными, каждому ферменту было также присвоено и тривиальное, рабочее название, предназначенное для повседневного употребления. В большинстве случаев оно состоит из названия вещества, на которое действует фермент, указания на тип катализируемой реакции и окончания -аза (табл. 13).
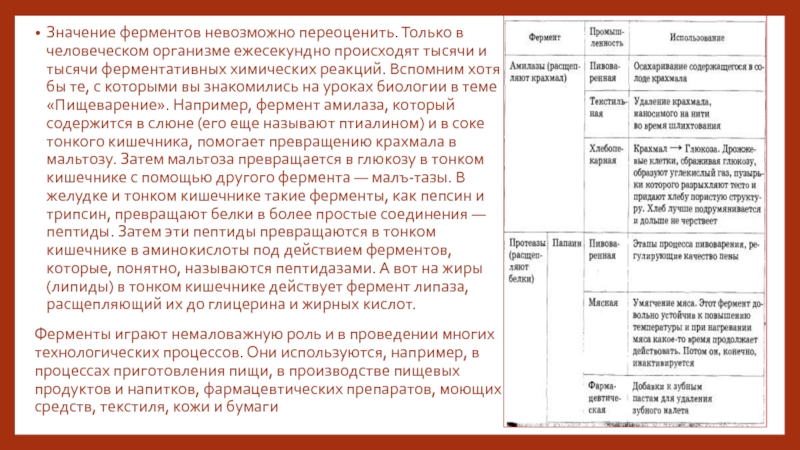
Слайд 9Значение ферментов невозможно переоценить. Только в человеческом организме ежесекундно происходят тысячи
и тысячи ферментативных химических реакций. Вспомним хотя бы те, с которыми вы знакомились на уроках биологии в теме «Пищеварение». Например, фермент амилаза, который содержится в слюне (его еще называют птиалином) и в соке тонкого кишечника, помогает превращению крахмала в мальтозу. Затем мальтоза превращается в глюкозу в тонком кишечнике с помощью другого фермента — малъ-тазы. В желудке и тонком кишечнике такие ферменты, как пепсин и трипсин, превращают белки в более простые соединения — пептиды. Затем эти пептиды превращаются в тонком кишечнике в аминокислоты под действием ферментов, которые, понятно, называются пептидазами. А вот на жиры (липиды) в тонком кишечнике действует фермент липаза, расщепляющий их до глицерина и жирных кислот.
Ферменты играют немаловажную роль и в проведении многих технологических процессов. Они используются, например, в процессах приготовления пищи, в производстве пищевых продуктов и напитков, фармацевтических препаратов, моющих средств, текстиля, кожи и бумаги
Ферменты играют немаловажную роль и в проведении многих технологических процессов. Они используются, например, в процессах приготовления пищи, в производстве пищевых продуктов и напитков, фармацевтических препаратов, моющих средств, текстиля, кожи и бумаги