- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме Химический состав клетки
Содержание
- 1. Презентация по теме Химический состав клетки
- 2. Все организмы имеют одинаковый химический состав и содержат большое количество химических элементов.
- 3. Д.И. Менделеев1834–1907 гг. В состав клеток входят 70 химических элементов из периодической системы Д.И. Менделеева.
- 4. Живые организмы зародились в водах Мирового океана.
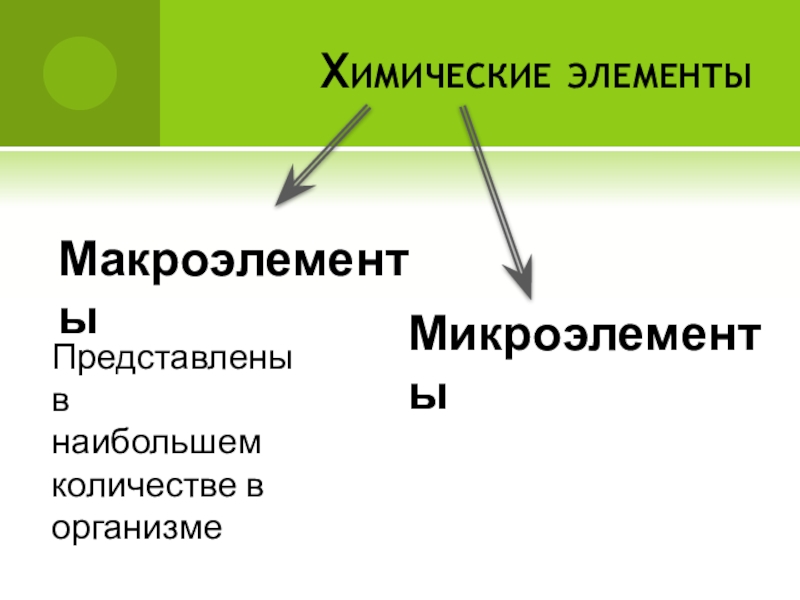
- 5. Химические элементыМакроэлементыМикроэлементыПредставлены в наибольшем количестве в организме
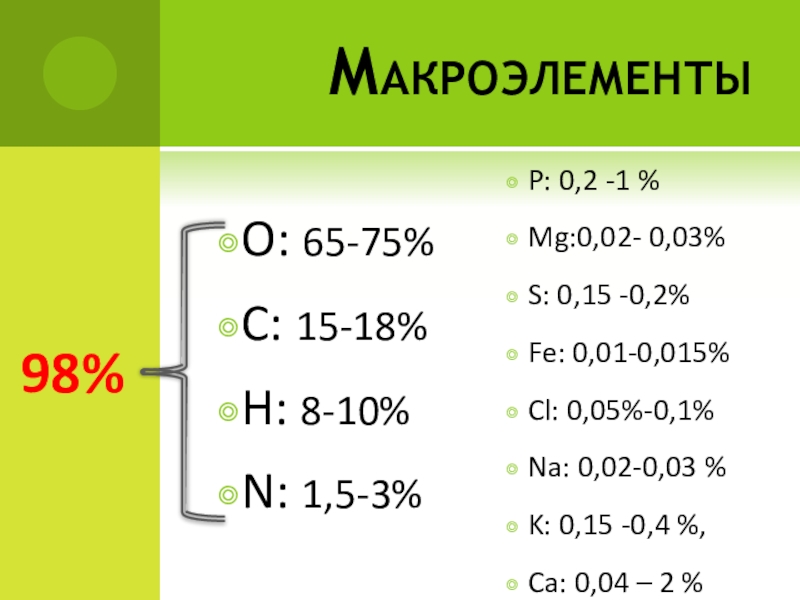
- 6. МакроэлементыO: 65-75%C: 15-18% H: 8-10%N: 1,5-3%P: 0,2
- 7. Атомы углерода, соединяясь между собой, образуют разнообразные соединения в живой природе.алмазграфитфуллерен
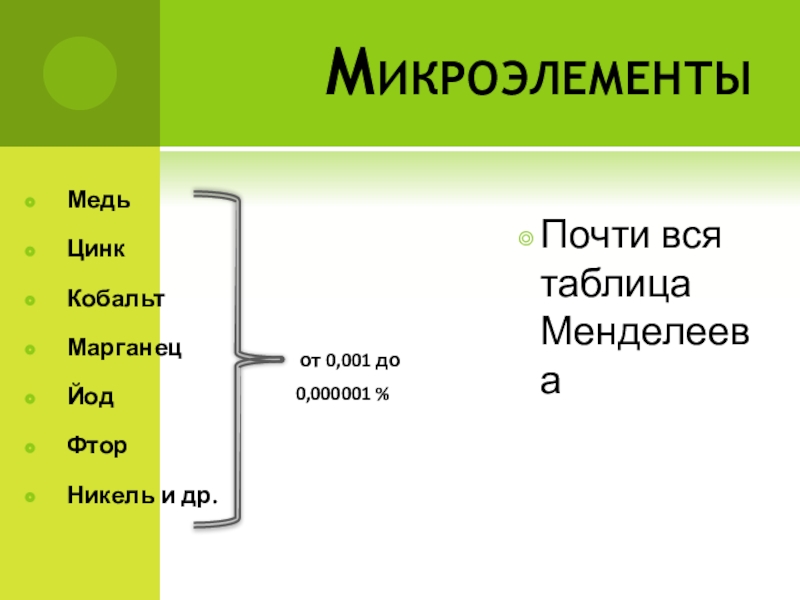
- 8. МикроэлементыПочти вся таблица МенделееваМедьЦинкКобальтМарганецЙодФторНикель и др. от 0,001 до 0,000001 %
- 9. Микроэлементы
- 10. Гомеостаз – постоянство химического состава организма
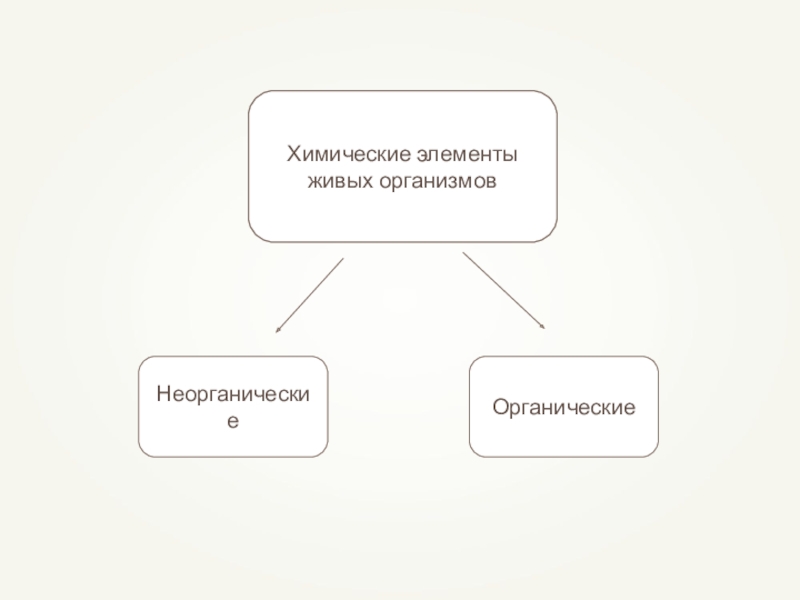
- 11. Химические элементы живых организмов
- 12. Неорганические веществаВода Минеральные соли
- 13. Слайд 13
- 14. Вода В молодом организме человека и животного
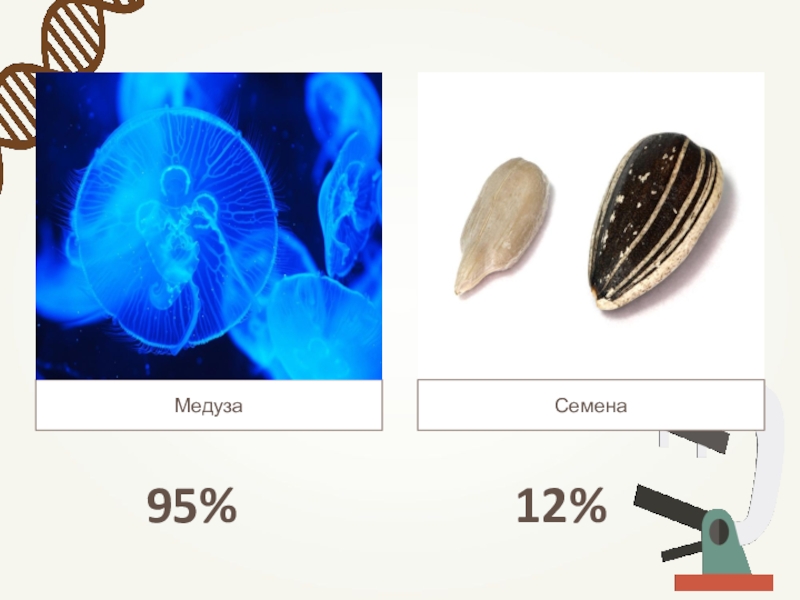
- 15. МедузаСемена95%12%
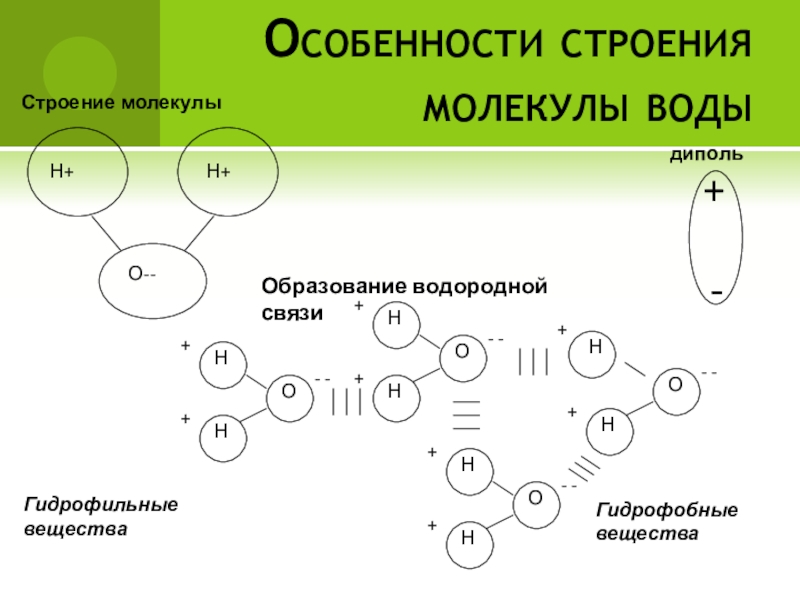
- 16. Особенности строения молекулы водыГидрофильные веществаГидрофобные вещества
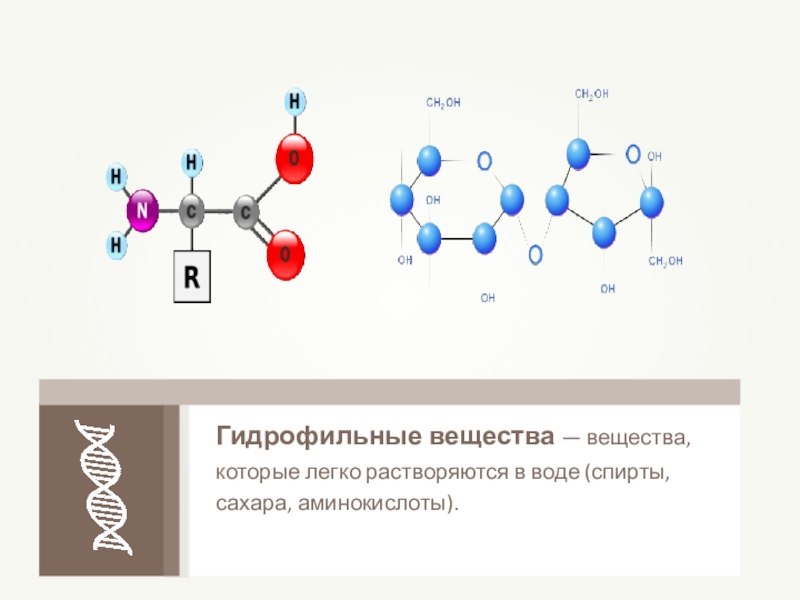
- 17. Гидрофильные вещества — вещества, которые легко растворяются в воде (спирты, сахара, аминокислоты).
- 18. Свойства и значение воды.
- 19. Термостабильность или терморегуляциюкруговорот воды в природе Высокая теплоемкость и теплопроводность
- 20. Практическая полная несжимаемостьблагодаря силам межмолекулярного сцепления поддерживается форма организмов (тургорное давление, гидростатический скелет, амниотическая жидкость).
- 21. Подвижность молекулвследствие слабости водородных связей возможно проявление осмоса
- 22. Вязкость благодаря наличию водородных связей вода обладает смазывающими свойствами (синовиальная жидкость в суставах, плевральная жидкость).
- 23. Полярность молекул:самый распространенный в природе растворитель,среда протекания многих химических реакций в организме,образует гидратационную оболочку вокруг макромолекул
- 24. Поверхностное натяжениеводные растворы являются средством передвижения веществ в организме, которое определяется силами межмолекулярного сцепления.
- 25. Расширение при замерзанииЛед легче воды, он образуется
- 26. Антуан де Сент-Экзюпери1900–1944 гг. «Вода, у тебя
- 27. Функции водыУниверсальный растворительВыполняет функцию терморегуляции в живых
- 28. Минеральные солив диссоциированном состоянии в виде катионов:
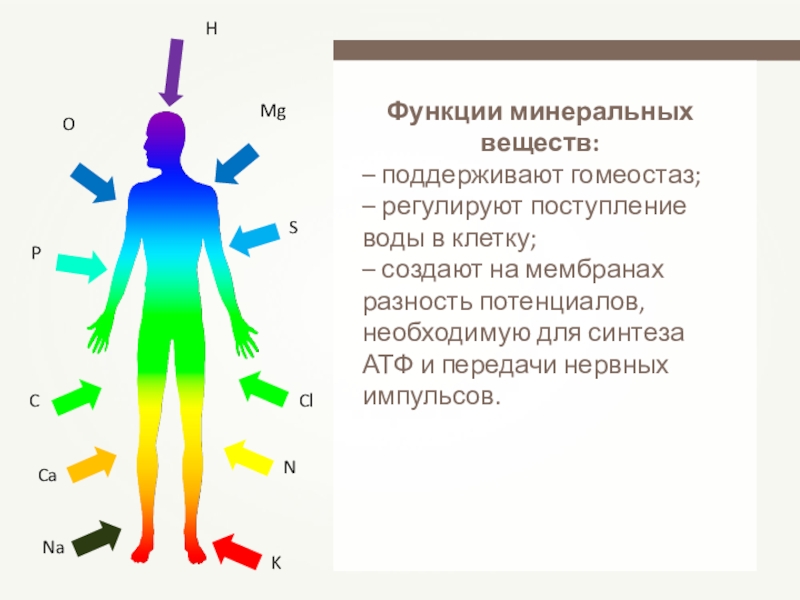
- 29. Функции минеральных веществ: – поддерживают гомеостаз;– регулируют поступление
- 30. Функции минеральных солей
- 31. В связанном с органическими веществами состоянии
- 32. Фридрих Энгельс1820–1895 гг. Классическое определение Ф. Энгельса
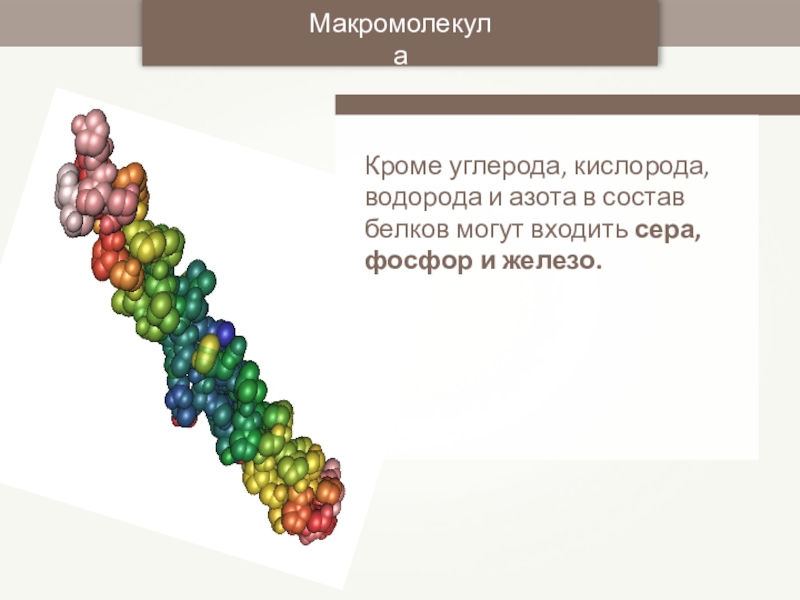
- 33. МакромолекулаКроме углерода, кислорода, водорода и азота в состав белков могут входить сера, фосфор и железо.
- 34. Органические соединения.Углеводы - 0,2 -2,0 % сух.
- 35. Углеводы (сахариды)органические вещества, состоящие из атомов углерода,
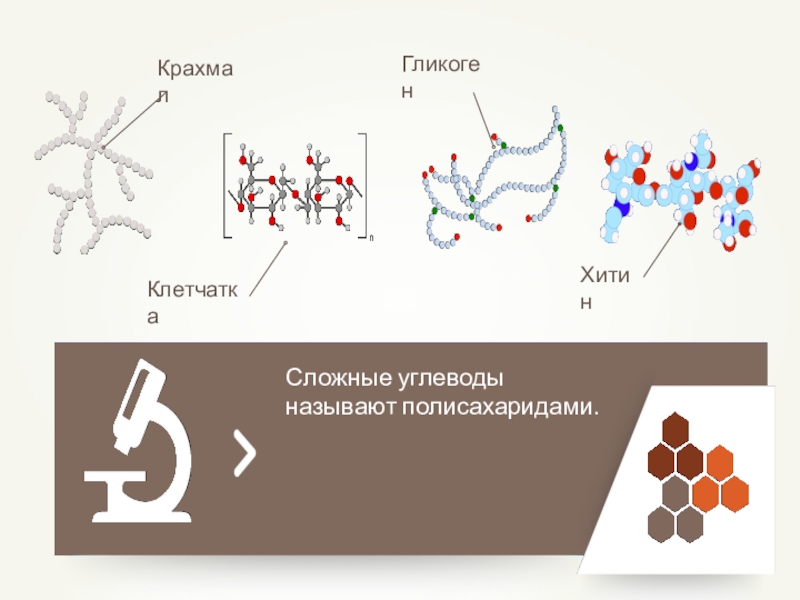
- 36. Пентозы (С5Н10О5)Гексозы (С6Н12О6) СахарозаЛактозаКрахмалГликогенЦеллюлозаХИТИН
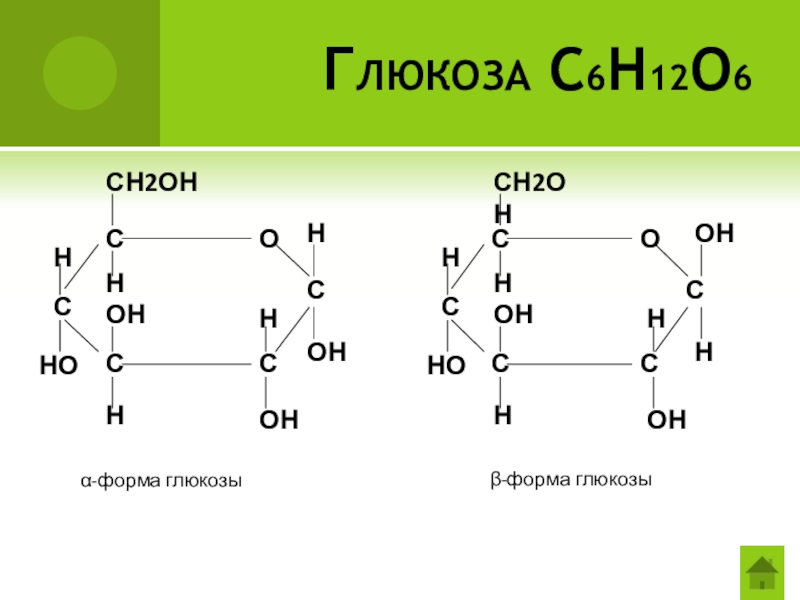
- 37. Глюкоза С6Н12О6 α-форма глюкозыβ-форма глюкозы
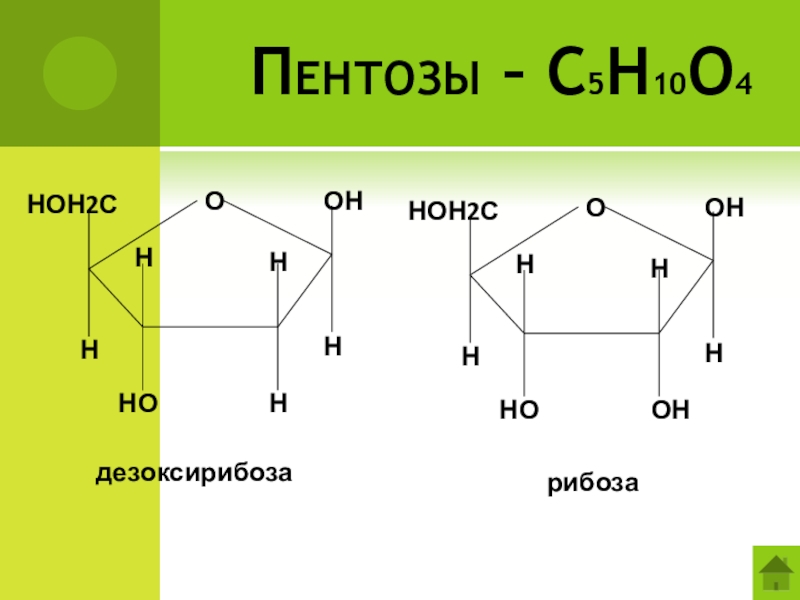
- 38. Пентозы – С5Н10О4
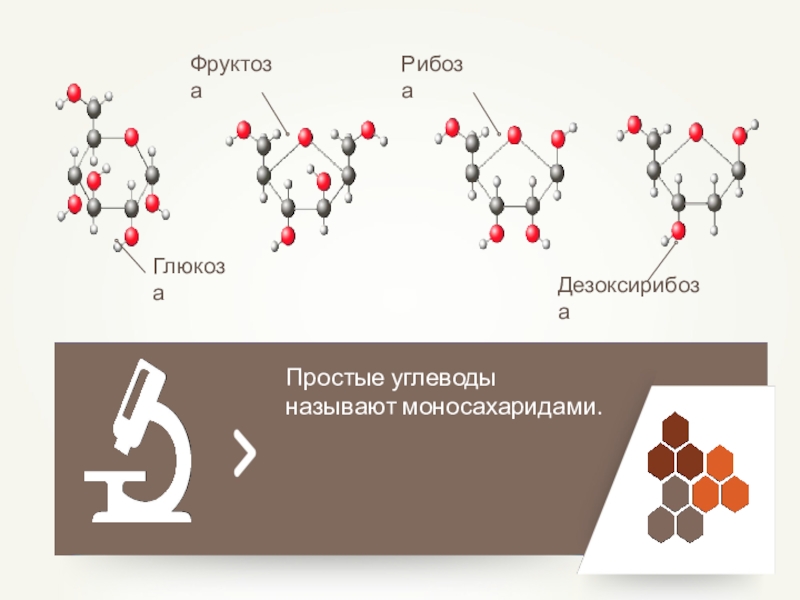
- 39. Простые углеводы называют моносахаридами.
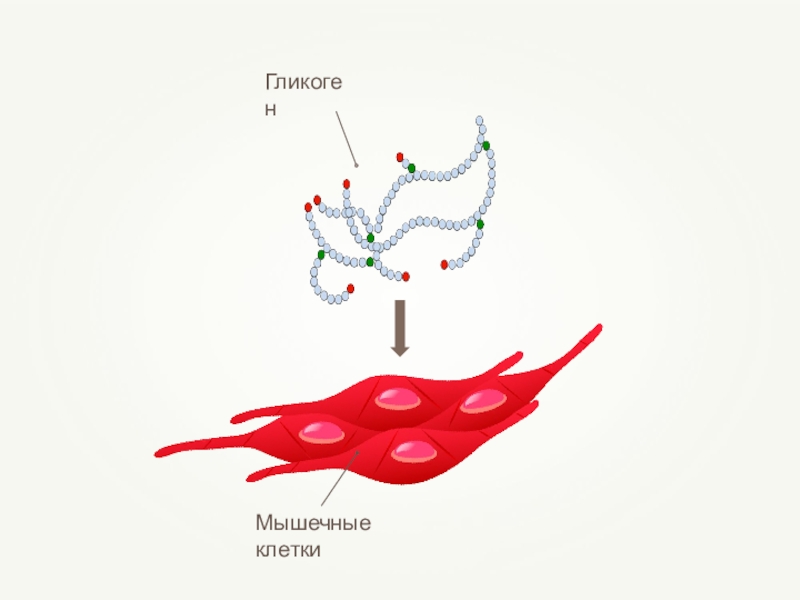
- 40. Гликоген (С6Н10О5)n
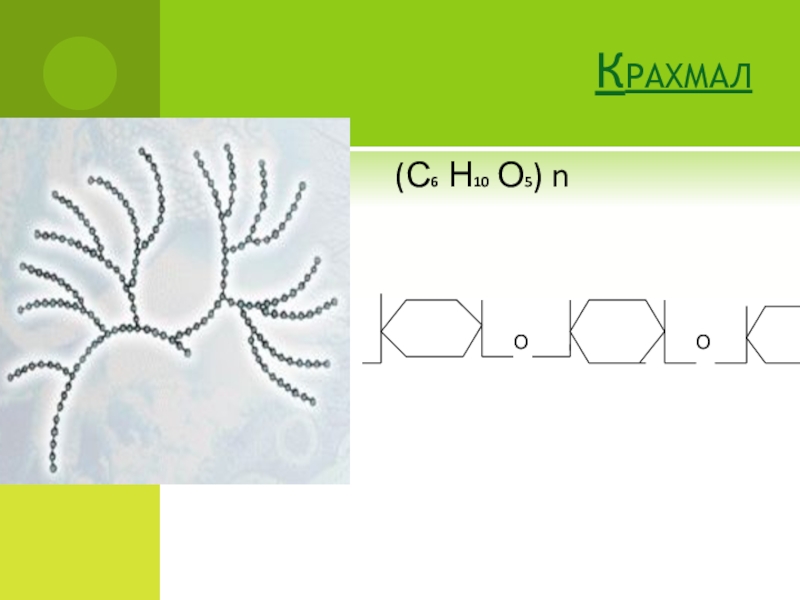
- 41. КрахмалО(С6 Н10 О5) nО
- 42. Сложные углеводы называют полисахаридами.
- 43. Картофель
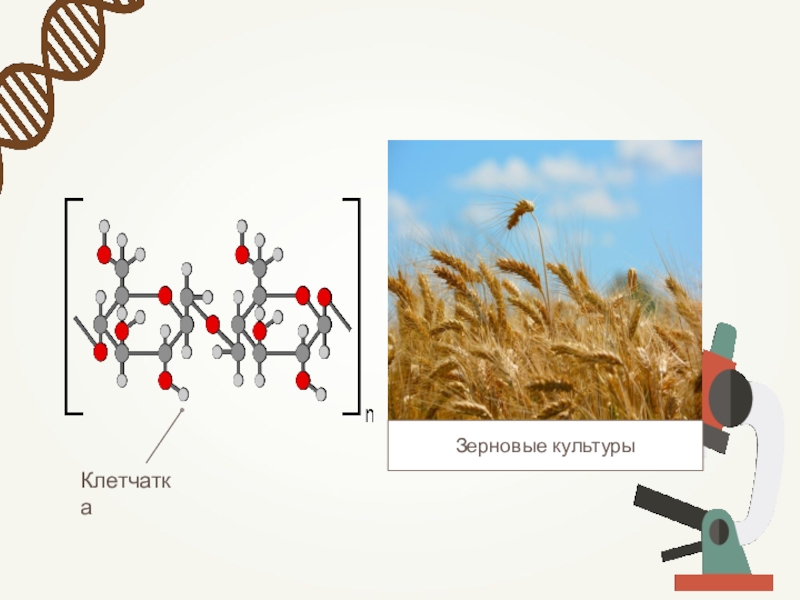
- 44. Зерновые культуры
- 45. Слайд 45
- 46. Слайд 46
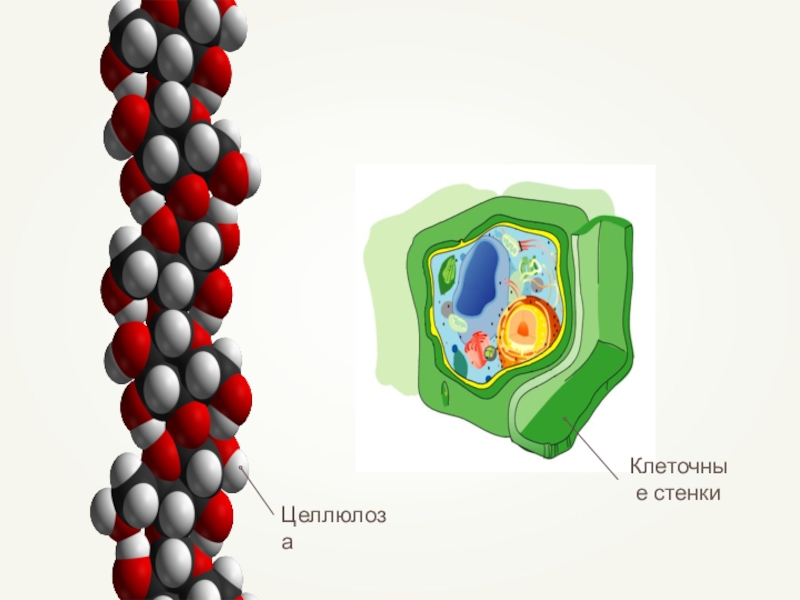
- 47. Функции углеводовЭнергетическая. Окисление 1г. = 17,6кДж.Структурная. Целлюлоза
- 48. Липиды (Жиры)Липиды - это вещества, в состав которых входят части молекул глицерина и трех жирных кислот
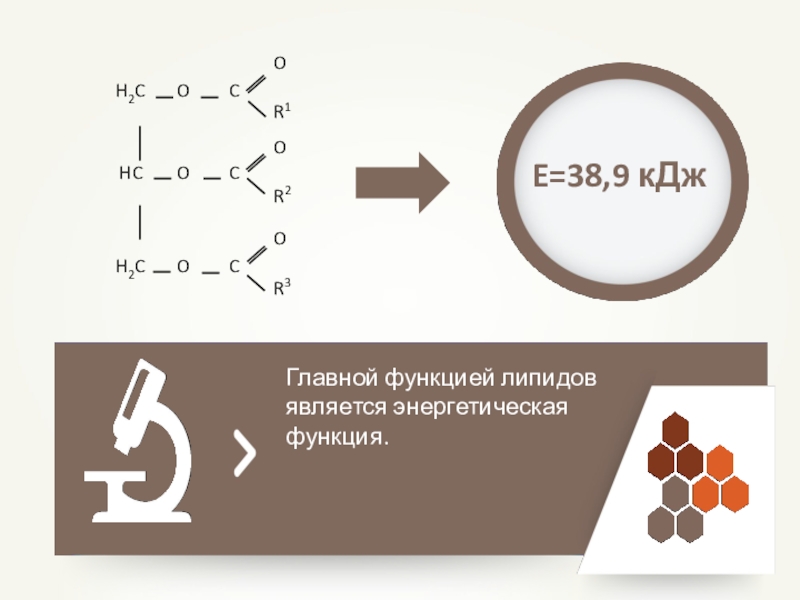
- 49. Главной функцией липидов является энергетическая функция.E=38,9 кДж
- 50. ЛипидыТвердыеЖивотного происхожденияЖидкиеРастите льного происхождения
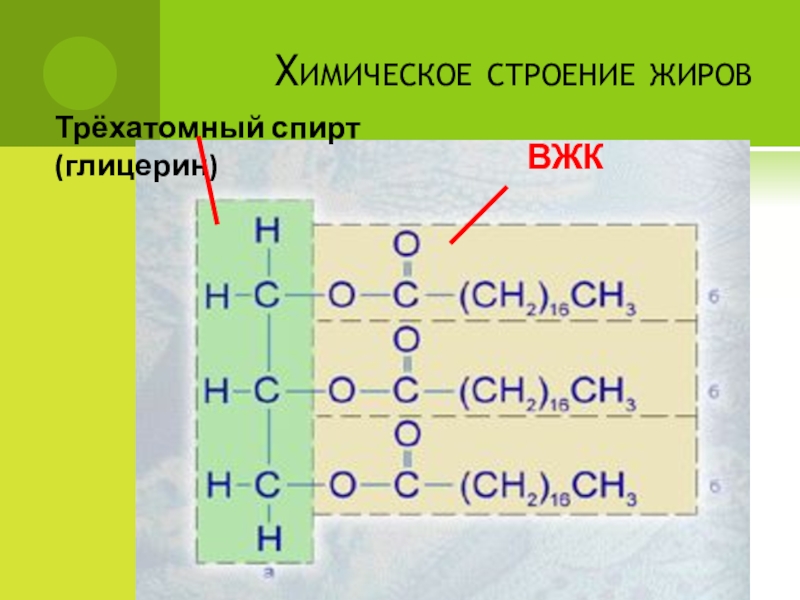
- 51. Химическое строение жировТрёхатомный спирт (глицерин)ВЖК
- 52. Функции жиров Энергетическая. 1г. даёт 38,9 кДжРезервная -
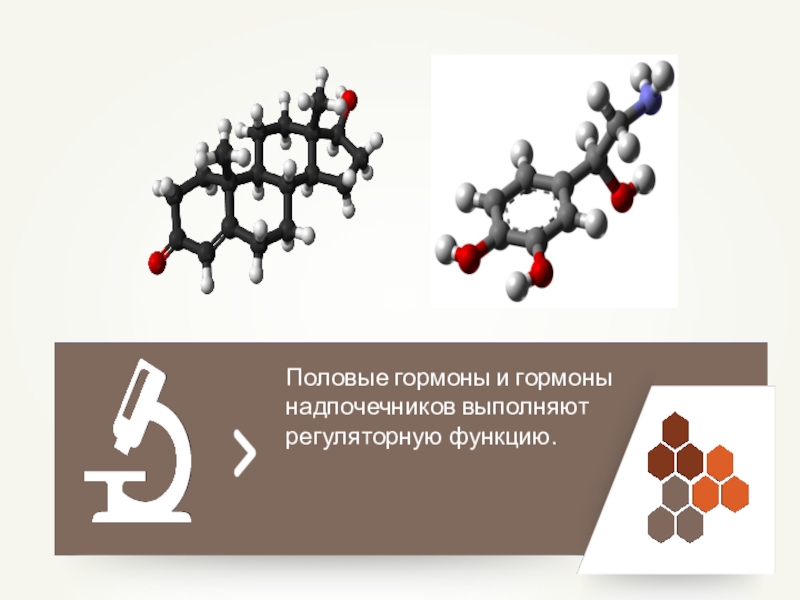
- 53. Половые гормоны и гормоны надпочечников выполняют регуляторную функцию.
- 54. Благодаря плохой теплопроводности жир выполняет функцию теплоизолятора.
- 55. При окислении 100 г жира в организме этих животных образуется примерно 105 г воды.
- 56. Белки́ (протеи́ны, полипепти́ды) — Азотсодержащие орг. соединения,состоящие
- 57. Макромолекулой называют гигантскую молекулу, построенную из многих повторяющихся единиц – мономеров
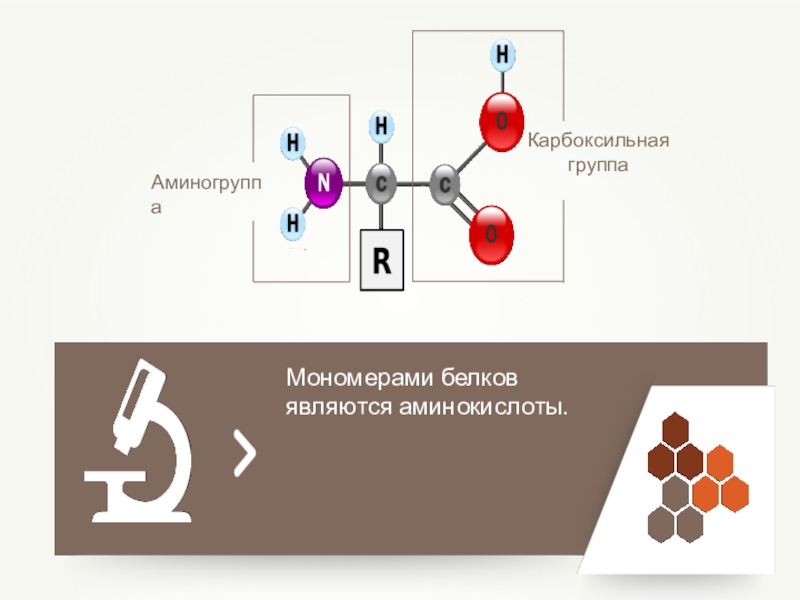
- 58. Мономерами белков являются аминокислоты.АминогруппаКарбоксильная группа
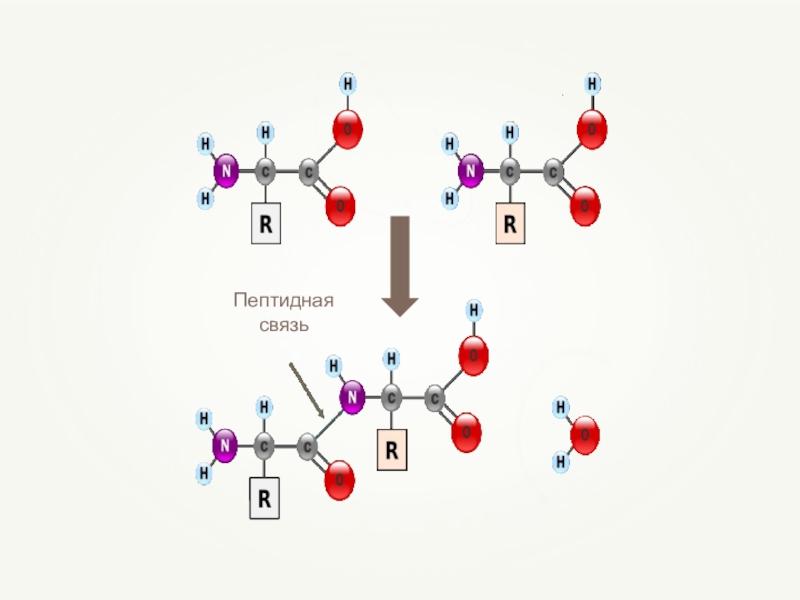
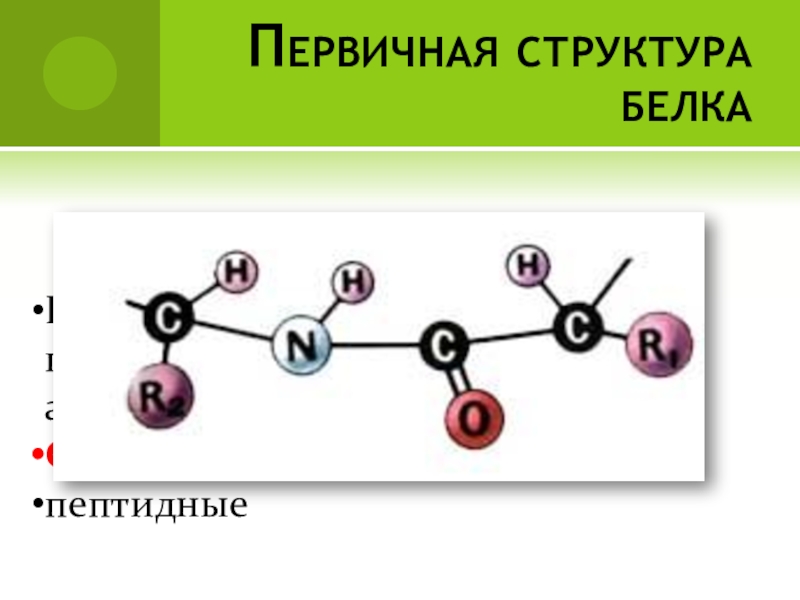
- 59. Пептидная связь
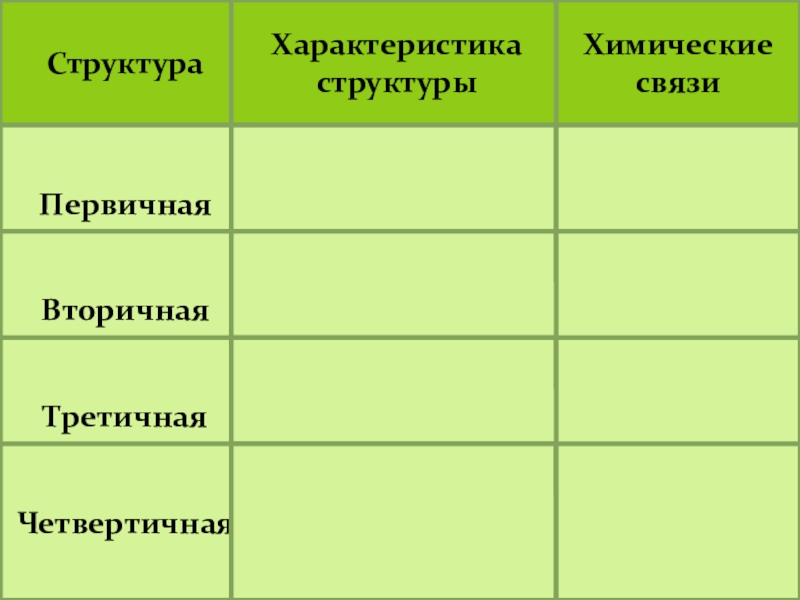
- 60. Структура Характеристика структурыХимические связиПервичная Вторичная Третичная Четвертичная
- 61. Слайд 61
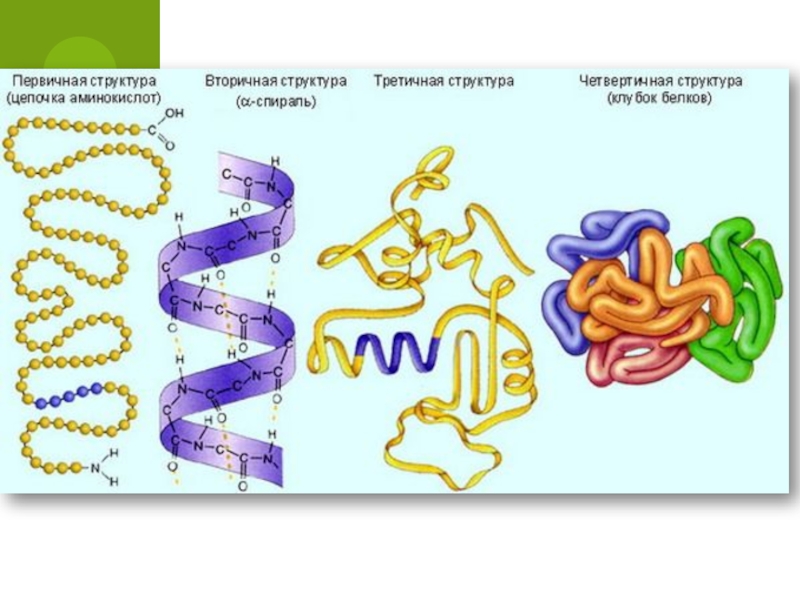
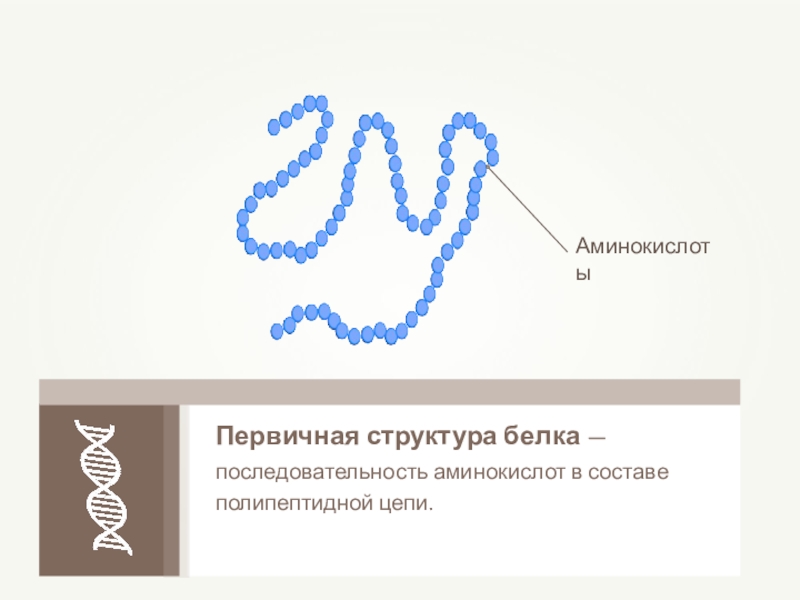
- 62. Первичная структура белка — последовательность аминокислот в составе полипептидной цепи.
- 63. Первичная структура белкаПолипептидная цепь из последовательно соединенных аминокислотных остатковСвязи:пептидные
- 64. Вторичная структура белка — более сложная структура, имеет вид спирали.
- 65. Вторичная структура белкаПолипептидная нить закручена в спиральα-спираль
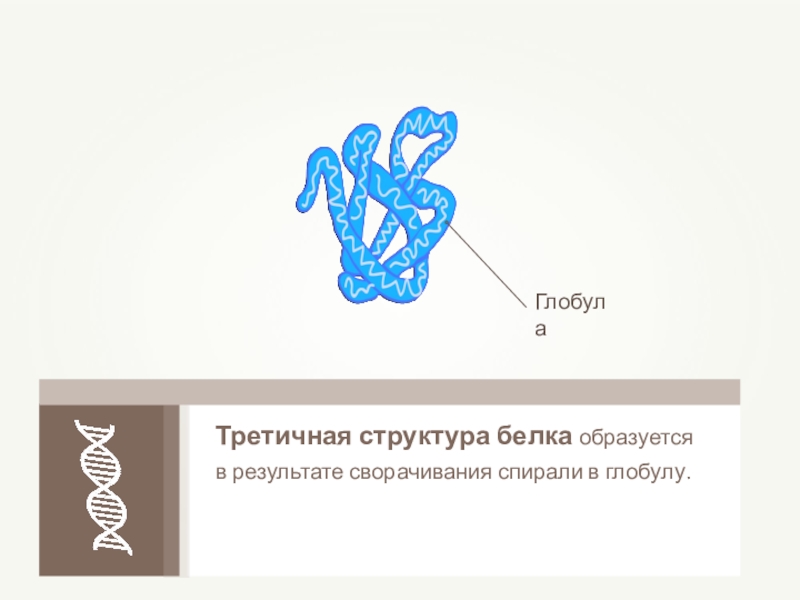
- 66. Третичная структура белка образуется в результате сворачивания спирали в глобулу.
- 67. Третичная структура белкаНить аминокислот свёртывается и образует
- 68. Четвертичная структура белка возникает в результате соединения нескольких макромолекул с третичной структурой в сложный комплекс.
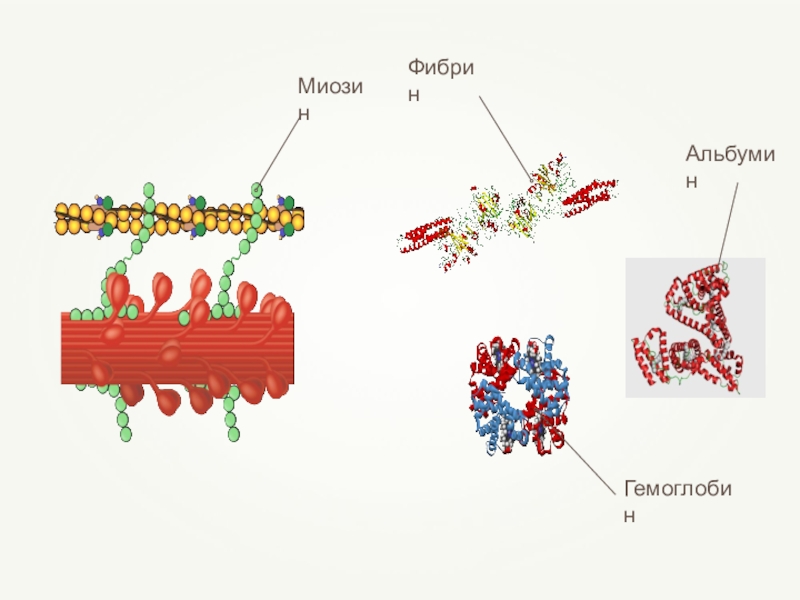
- 69. Четвертичная структура белкаCостоят из нескольких макромолекул белков третичной структур, свёрнутых в клубок вместеСвязи:ИонныеВодородныеГидрофобные связи
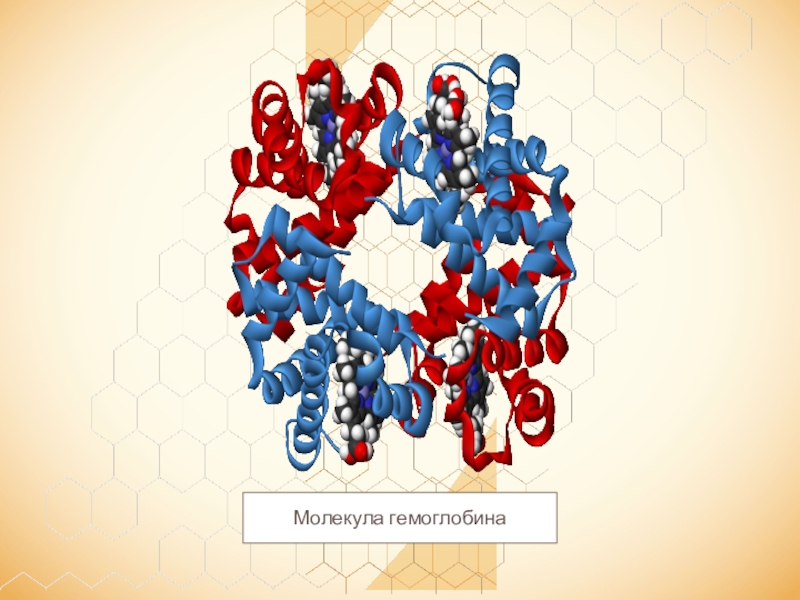
- 70. Молекула гемоглобина
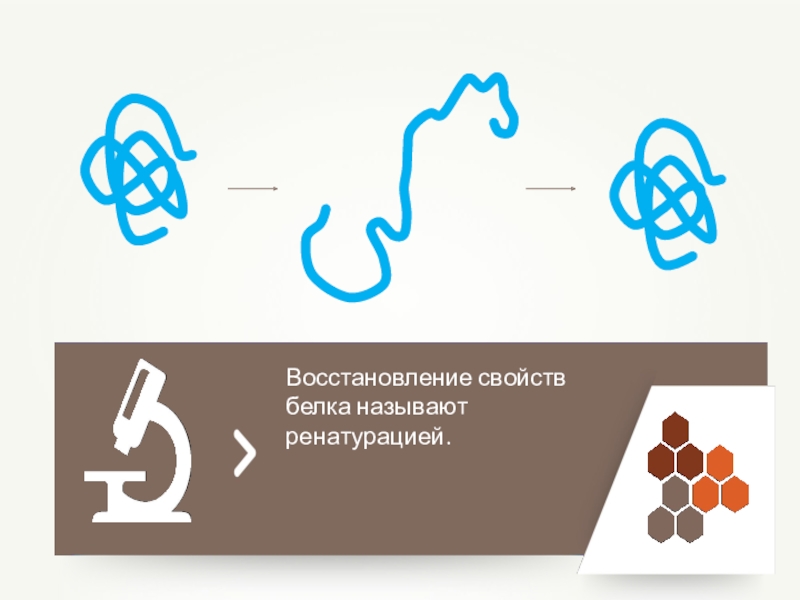
- 71. — потеря белковыми веществами их естественных
- 72. Полное восстановление структуры белкаРенатурация белков
- 73. Восстановление свойств белка называют ренатурацией.
- 74. Слайд 74
- 75. Слайд 75
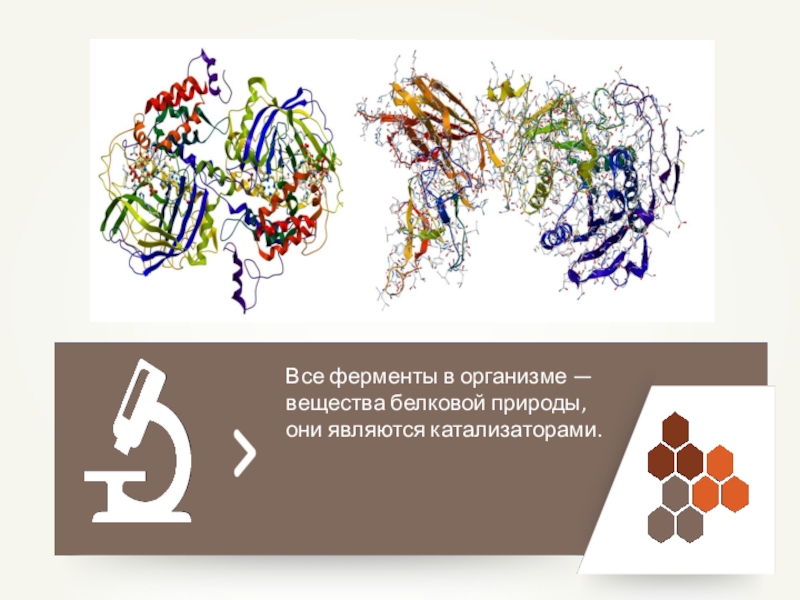
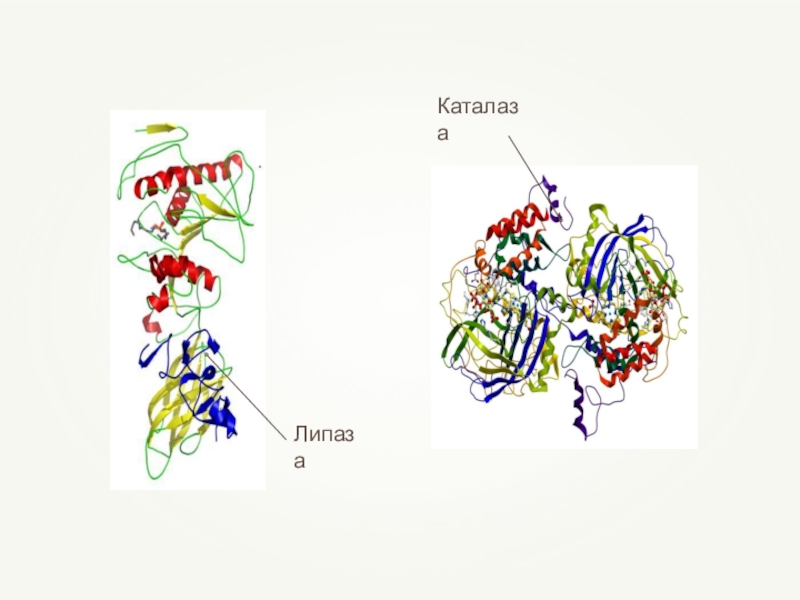
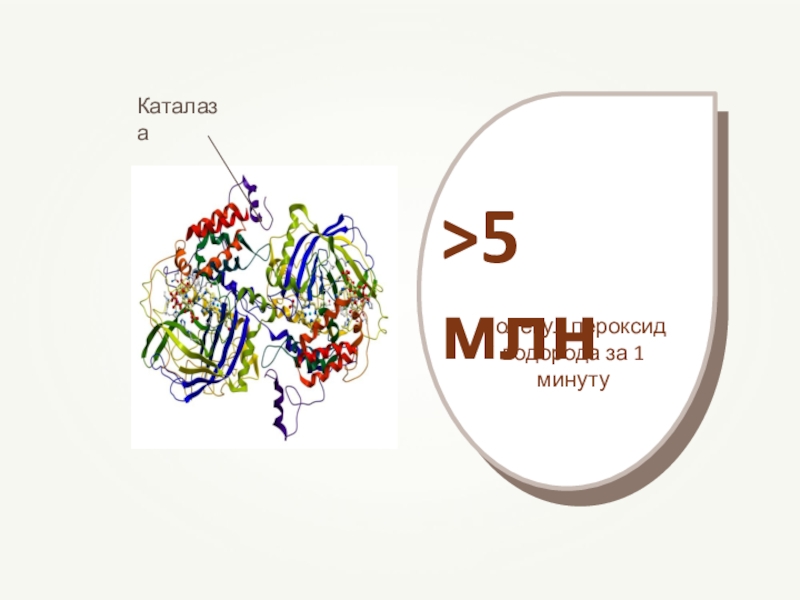
- 76. Все ферменты в организме — вещества белковой природы, они являются катализаторами.
- 77. Слайд 77
- 78. Слайд 78
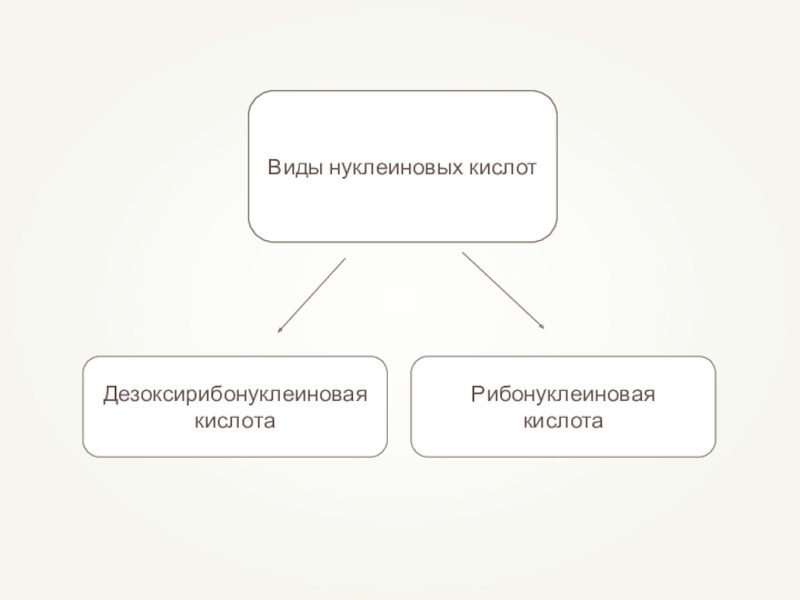
- 79. Нуклеиновые кислоты (от лат. nucleus — ядро)
- 80. Виды нуклеиновых кислот
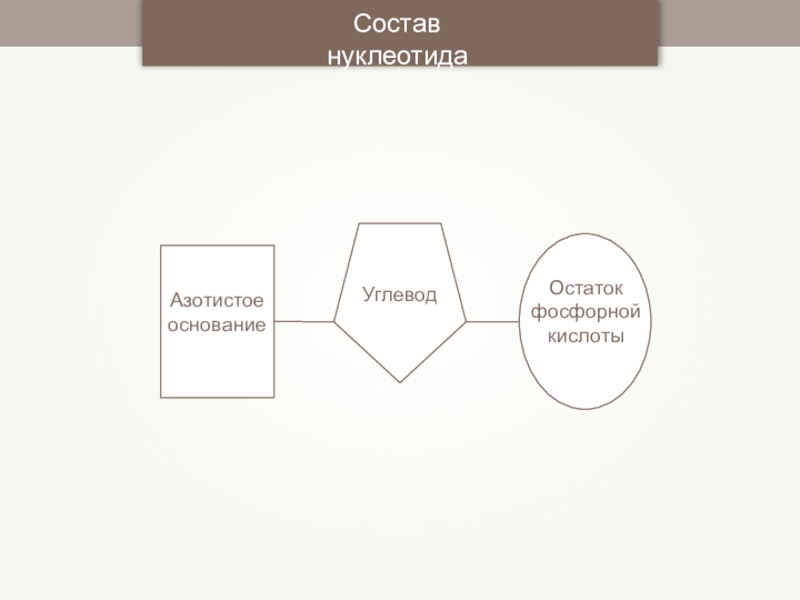
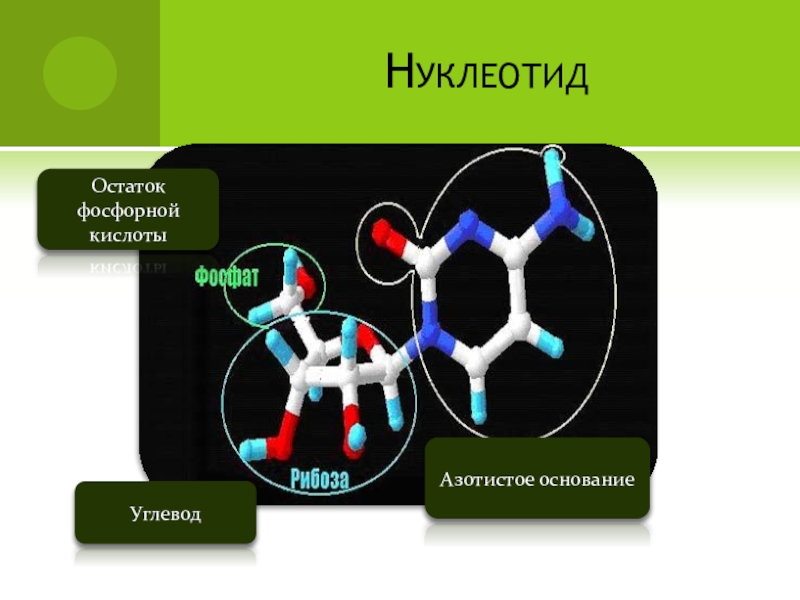
- 81. Азотистое основаниеУглеводОстаток фосфорной кислотыСостав нуклеотида
- 82. НуклеотидОстаток фосфорной кислотыУглевод Азотистое основание
- 83. Функции нуклеиновых кислотХранение (носители) генетической информацииУчастие в реализации генетической информации (синтез белка)Передача генетической информации
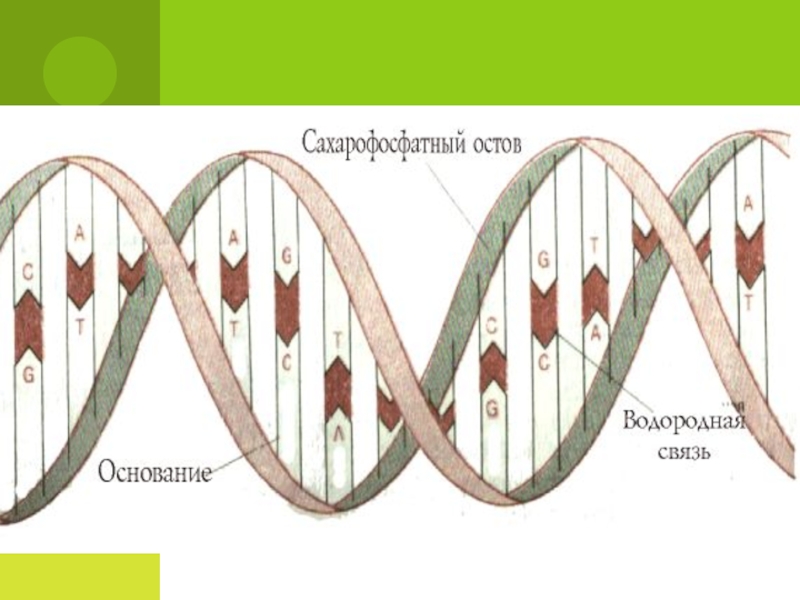
- 84. Структуру молекулы ДНК раскрыли в 1953 г. Джеймс Уотсон, Фрэнсис Крик и Морис Уилкинс.
- 85. Модель ДНК1953г. – создание модели ДНК
- 86. Слайд 86
- 87. КомплиментарностьКомплиментарность - пространственная взаимодополняемость молекул или их
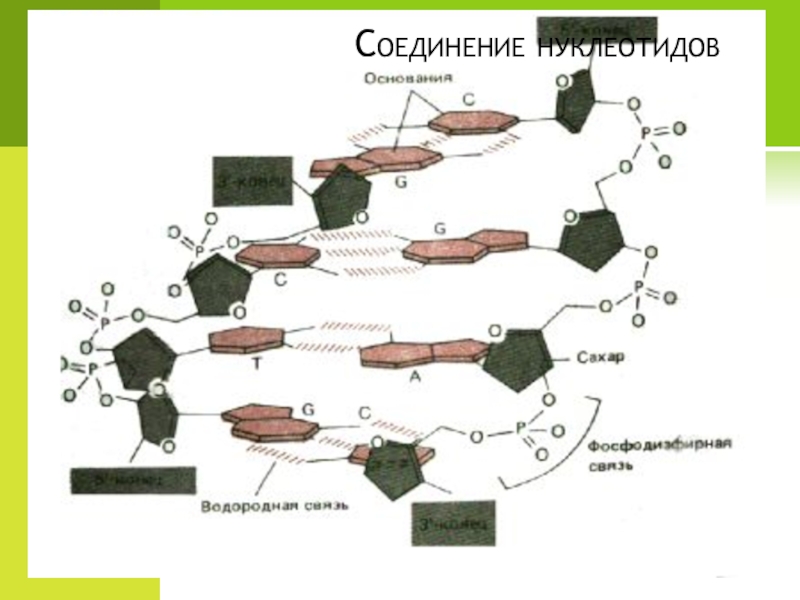
- 88. Соединение нуклеотидов
- 89. Виды РНКТранспортные РНК (т-РНК) - это самые
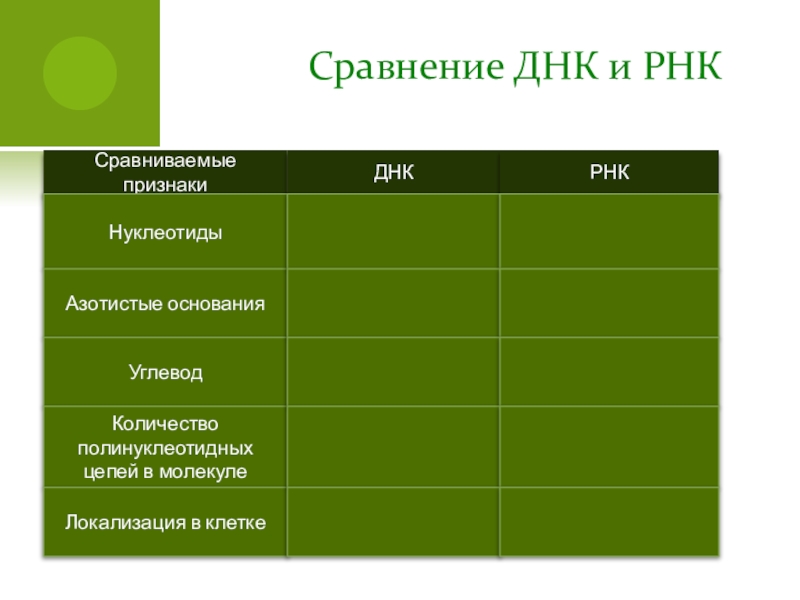
- 90. Сравнение ДНК и РНКСравниваемые признакиДНКРНКНуклеотиды Азотистые основанияУглевод
Слайд 2Все организмы имеют одинаковый химический состав и содержат большое количество химических
Слайд 3Д.И. Менделеев
1834–1907 гг.
В состав клеток входят
70 химических элементов
из
Д.И. Менделеева.
Слайд 5Химические элементы
Макроэлементы
Микроэлементы
Представлены в
наибольшем
количестве в
организме
Слайд 6Макроэлементы
O: 65-75%
C: 15-18%
H: 8-10%
N: 1,5-3%
P: 0,2 -1 %
Mg:0,02-
S: 0,15 -0,2%
Fe: 0,01-0,015%
Cl: 0,05%-0,1%
Na: 0,02-0,03 %
K: 0,15 -0,4 %,
Ca: 0,04 – 2 %
98%
Слайд 7Атомы углерода, соединяясь между собой, образуют разнообразные соединения
в живой природе.
алмаз
графит
фуллерен
Слайд 8Микроэлементы
Почти вся таблица Менделеева
Медь
Цинк
Кобальт
Марганец
Йод
Фтор
Никель и др.
от 0,001 до
0,000001 %
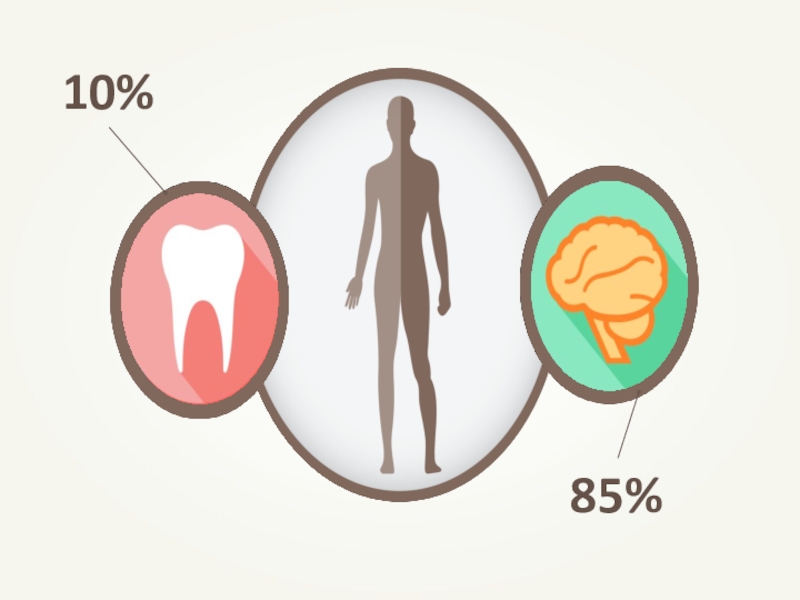
Слайд 14Вода
В молодом организме человека и животного – 80 % от
В клетках старого организма – 60 %;
В головном мозге – 85%;
В клетках эмали зубов –10 -15 %.
При потере 20% воды у человека наступает смерть
Слайд 17Гидрофильные вещества — вещества, которые легко растворяются в воде (спирты, сахара,
Слайд 19Термостабильность или терморегуляцию
круговорот воды в природе
Высокая теплоемкость и
Слайд 20Практическая полная несжимаемость
благодаря силам межмолекулярного сцепления поддерживается форма организмов (тургорное давление,
Слайд 22
Вязкость
благодаря наличию водородных связей вода обладает смазывающими свойствами (синовиальная жидкость в
Слайд 23Полярность молекул:
самый распространенный в природе растворитель,
среда протекания многих химических реакций в
образует гидратационную оболочку вокруг макромолекул
Слайд 24Поверхностное натяжение
водные растворы являются средством передвижения веществ в организме, которое определяется
Слайд 25Расширение при замерзании
Лед легче воды, он образуется на поверхности водоемов и
Слайд 26Антуан де Сент-Экзюпери
1900–1944 гг.
«Вода, у тебя нет ни вкуса,
ни
Антуан де Сент-Экзюпери
Слайд 27Функции воды
Универсальный растворитель
Выполняет функцию терморегуляции в живых организмах
Обеспечивает гидролиз, окисление высокомолекулярных
Является осморегулятором
Обеспечивает перенос и выделение определённых веществ из клетки в клетку
Слайд 28Минеральные соли
в диссоциированном состоянии в виде катионов: К+, Na+, Ca++, Mg++
в
в связанном с органическими веществами состоянии обеспечивают многие функции
Слайд 29Функции минеральных веществ:
– поддерживают гомеостаз;
– регулируют поступление воды в клетку;
– создают
H
O
P
C
Ca
Na
K
N
Cl
S
Mg
Слайд 30Функции минеральных солей
Кислотно –щелочное равновесие(буферность) в организме
Осмотическое давление, поступление воды в клетку.
Слайд 31В связанном с органическими веществами состоянии
Железо участвует в построении молекулы гемоглобина;
Магний входит в состав хлорофилла;
Медь входит в состав многих окислительных ферментов;
Йод содержится в составе молекул тироксина;
Натрий и калий обеспечивают электрический заряд на мембранах нервных волокон;
Кобальт входит в состав витамина В12 и т.д.
Слайд 32Фридрих Энгельс
1820–1895 гг.
Классическое определение
Ф. Энгельса «Жизнь есть способ существования
Слайд 33Макромолекула
Кроме углерода, кислорода, водорода и азота в состав белков могут входить
Слайд 34Органические соединения.
Углеводы - 0,2 -2,0 % сух. вещ. кл.
Белки - 10
Жиры – 1 -5 % сух. вещ. кл.
Нуклеиновые кислоты – 1-2 %
АТФ
Ферменты.
Алкалоиды
Низкомолекулярные органические вещества ( НМВ) - 0,1 -0,5 %
Слайд 35Углеводы (сахариды)
органические вещества, состоящие из атомов углерода, водорода и кислорода (водород
С n( н2о)m
Слайд 47Функции углеводов
Энергетическая. Окисление 1г. = 17,6кДж.
Структурная. Целлюлоза образует стенки растительных клеток,
Запасающая. Гликоген резервный полисахарид у человека, грибов. Крахмал – у растений.
Защитная. Моносахара входят в состав витаминов, нуклеиновых кислот, ферментов.
Метаболическая. Глюкоза, крахмал, гликоген участвуют в процессах метаболизма клетки.
Слайд 48Липиды (Жиры)
Липиды - это вещества, в состав которых входят части молекул
Слайд 52Функции жиров
Энергетическая. 1г. даёт 38,9 кДж
Резервная - источник метаболической воды (1г
Строительная
Регуляторная
Защитная
Слайд 56Белки́ (протеи́ны, полипепти́ды) — Азотсодержащие орг. соединения,
состоящие из аминокислот, соединённых
с
сложную структурную организацию.
Белки –мономерами которых являются аминокислоты.
Белки
Слайд 57Макромолекулой называют гигантскую молекулу, построенную из многих повторяющихся единиц – мономеров
Слайд 60Структура
Характеристика структуры
Химические связи
Первичная
Вторичная
Третичная
Четвертичная
Слайд 63Первичная структура белка
Полипептидная цепь из последовательно соединенных аминокислотных остатков
Связи:
пептидные
Слайд 65Вторичная структура белка
Полипептидная нить закручена в спираль
α-спираль – из одной полипептидной
β –спираль – из нескольких полипептидных цепе
Связи:
водородные
Слайд 67Третичная структура белка
Нить аминокислот свёртывается и образует клубок или фибриллу, специфичную
Связи:
водородные
Дисульфидные
гидрофобное взаимодействие
Слайд 68Четвертичная структура белка возникает
в результате соединения нескольких макромолекул
с третичной
Слайд 69Четвертичная структура белка
Cостоят из нескольких макромолекул белков третичной структур, свёрнутых в
Связи:
Ионные
Водородные
Гидрофобные связи
Слайд 71 — потеря белковыми веществами их естественных свойств (растворимости, гидрофильности и
Денатурация белков
Слайд 79Нуклеиновые кислоты
(от лат. nucleus — ядро) — высокомолекулярные органические соединения,
Слайд 83Функции нуклеиновых кислот
Хранение (носители) генетической информации
Участие в реализации генетической информации (синтез
Передача генетической информации
Слайд 87Комплиментарность
Комплиментарность - пространственная взаимодополняемость молекул или их частей, приводящая к образованию
Комплиментарные структуры подходят друг к другу как «ключ с замком»
(А+Т)+(Г+Ц)=100%
Слайд 89Виды РНК
Транспортные РНК (т-РНК) - это самые маленькие по размерам РНК.
Информационные РНК (и-РНК) - они в 10 раз больше тРНК. Их функция состоит в переносе информации о структуре белка от ДНК к месту синтеза белка
Рибосомные РНК (р-РНК) - Структурная (формирование рибосом), участие в синтезе белковой (полипептидной) цепи.
Слайд 90Сравнение ДНК и РНК
Сравниваемые признаки
ДНК
РНК
Нуклеотиды
Азотистые основания
Углевод
Количество полинуклеотидных цепей в
Локализация в клетке