- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по обмену веществ
Содержание
- 1. Презентация по обмену веществ
- 2. Основные причины, приводящие к различным заболеваниямГенетические, метаболические:
- 3. Множество патологических состояний обусловлено невозможностью организма регулировать
- 4. Нарушение процессов обмена веществ при недостатке коферментов
- 5. Рибофлавин (В2) Необходим для образования флавинадениндинуклеотида и
- 6. Пантотеновая кислота (В3) служит предшественником коэнзима А(КоА),
- 7. Пиридоксин (В6)Коферментная форма – пиридоксальфосфат Биотин (Н) Биотин служит простетической группой ферментов, осуществляющих реакции карбоксилирования: ацетил-КоА-карбоксилазы;пропионил-КоА-карбоксилазы;пируваткарбоксилазы.
- 8. Цианкобаламин (В12)Коферментные формы:метилкоба-ламин; дезоксиаденозилкобаламин.Синтезируется микрофлорой кишечника.Недостаточность цианкобаламина
- 9. Ретинол (А)Ретиналь, ретинол и их эфиры регулируют
- 10. Токоферолы (Е)Основной функцией токоферолов является регуляция свободнорадикальных
- 11. Слайд 11
- 12. Соединения, которые отвечают основным свойствам витаминов, но
- 13. К антивитаминам относят вещества, которые затрудняют использование
- 14. Нарушения гормонального статуса и рецепцииГормоны - вещества,
- 15. Гормоны передней доли гипофизаТиреотропный гормон (ТТГ) –
- 16. Соматотропный гормон (СТГ) – полипептид, включающий 191
- 17. Пролактин – основное физиологическое действие – инициирование
- 18. Адренокортикотропный гормон (АКТГ) – одноцепочечный полипептид, состоящий
- 19. Гормоны задней доли гипофизаОкситоцин участвует в регуляции
- 20. Гипофункция коры надпочечников получила название болезнь Аддисона.
- 21. Гормоны щитовидной железыпричины тиреотоксикозов: болезнь Грейвса–Базедова(токсический зоб);избыточный
- 22. Гормон паращитовидных желез – паратгормонУчаствует в обеспечении
- 23. Половые железыГинекомастия – рост молочных желез у
- 24. Гормоны желудочного тракта и поджелудочной железыОсновным эндокринным
- 25. Спасибо за внимание
- 26. Белки́ (протеи́ны, полипепти́ды)— высокомолекулярные органическиеазотсодержащие полимерные соединения,
- 27. α-аминокислоты - производные карбоновых кислот, у которых
- 28. Классификация аминокислотПо радикалуНеполярные: аланин, валин, изолейцин, лейцин,
- 29. Слайд 29
- 30. Протеины(от греч. protos – первый, важнейший) –
- 31. Слайд 31
- 32. Сложные белки:- Липопротеиды: Хиломиконы, ЛПОНП (липопротеиды очень
- 33. Слайд 33
- 34. Слайд 34
- 35. Первичная структураПредставляет собой вытянутую
- 36. Вторичная структураПолипептидная цепь,
- 37. Третичная структураПредставляет собой свёрнутую
- 38. .
- 39. Слайд 39
- 40. Слайд 40
- 41. Ферменты, или энзимы, - это белки, выполняющие
- 42. Реакции трансаминирования - это реакции переноса α-аминогруппы
- 43. 2. Обзевреживание аммиака и цикл мочевинообразования.Аммиак, образовавшийся
- 44. Общие пути биосинтеза аминокислот.В организме человека возможен
- 45. Сахарный диабет — это группа метаболических (обменных)
- 46. СД 1 типа — хроническое заболевание, вызванное
Слайд 2Основные причины, приводящие к различным заболеваниям
Генетические, метаболические: поломки в наследственном материале,
Экологические: действие ксенобиотиков, физических факторов, болезнетворных микроорганизмов
Регуляторные: изменение порогов чувствительности рецепторов, эндокринные нарушения, нарушения иммунитета
Слайд 3Множество патологических состояний обусловлено невозможностью организма регулировать метаболическую активность клеток, а
Наибольшее значение для регуляции имеют возможность и скорость образования:
коферментов;
первичных и вторичных сигнальных молекул;
состояние рецепторного аппарата клеток.
Слайд 4Нарушение процессов обмена веществ при недостатке коферментов и других биологически активных
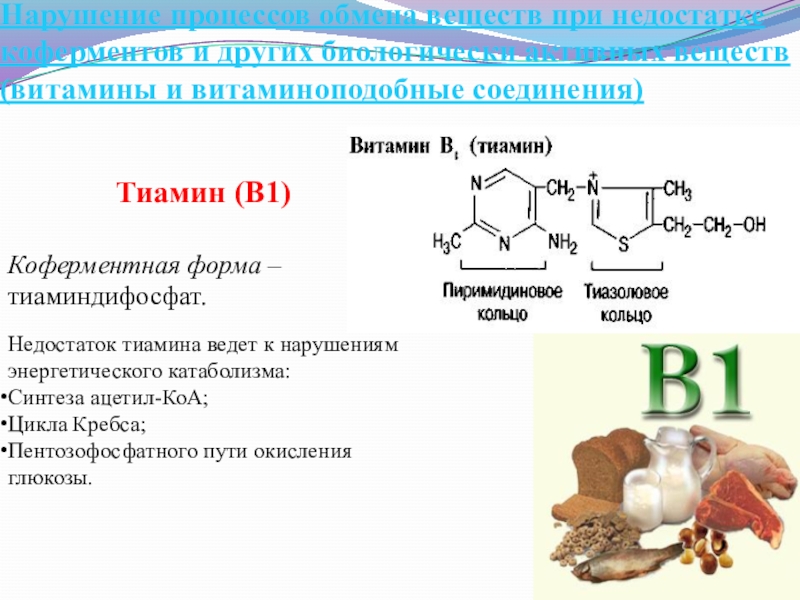
Тиамин (В1)
Коферментная форма – тиаминдифосфат.
Недостаток тиамина ведет к нарушениям энергетического катаболизма:
Синтеза ацетил-КоА;
Цикла Кребса;
Пентозофосфатного пути окисления глюкозы.
Слайд 5Рибофлавин (В2)
Необходим для образования флавинадениндинуклеотида и флавинмононуклеотида, являющихся коферментами флавинзависимых
Основные коферментные функции:
Транспорт электронов и протонов от НАД-зависимых дегидрогеназ на убихинон в дыхательной цепи ферментов;
Участие в цикле Кребса;
Окисление жирных кислот.
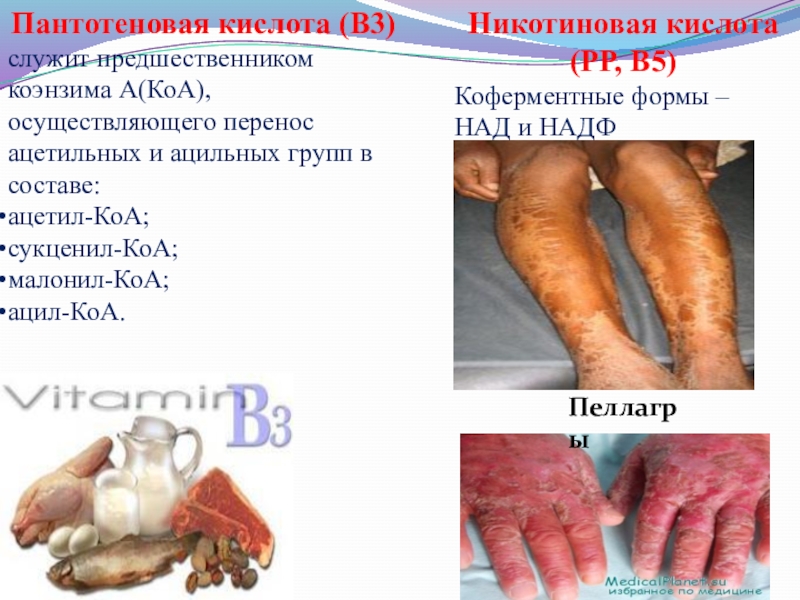
Слайд 6Пантотеновая кислота (В3)
служит предшественником коэнзима А(КоА), осуществляющего перенос ацетильных и
ацетил-КоА;
сукценил-КоА;
малонил-КоА;
ацил-КоА.
Никотиновая кислота (РР, В5)
Коферментные формы – НАД и НАДФ
Пеллагры
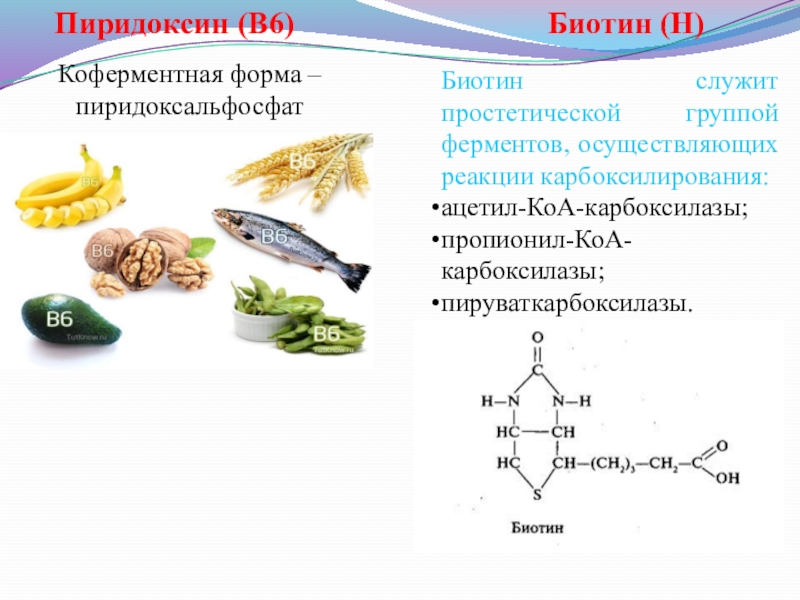
Слайд 7Пиридоксин (В6)
Коферментная форма – пиридоксальфосфат
Биотин (Н)
Биотин служит простетической группой
ацетил-КоА-карбоксилазы;
пропионил-КоА-карбоксилазы;
пируваткарбоксилазы.
Слайд 8Цианкобаламин (В12)
Коферментные формы:
метилкоба-ламин; дезоксиаденозилкобаламин.
Синтезируется микрофлорой кишечника.
Недостаточность цианкобаламина возникает при строго вегетарианском
Аскорбиновая кислота (С)
Основной функцией является участие в окислительно- восстановительных реакциях в качестве донора электронов
Участвует в обмене железа: в кишечнике обеспечивает восстановление трехвалентного железа в двухвалентное, что является обязательным условием всасывания железа, высвобождает железо из комплекса с трансферрином, что ускоряет его поступление в ткани.
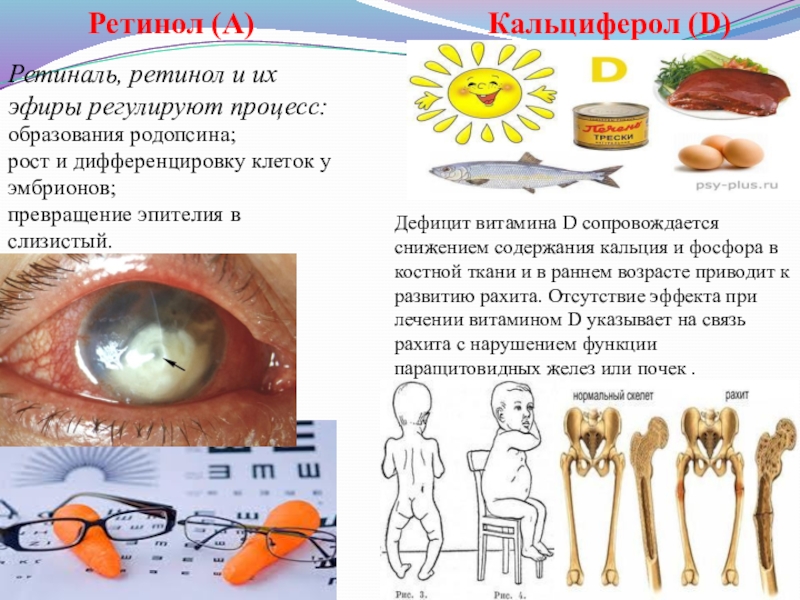
Слайд 9Ретинол (А)
Ретиналь, ретинол и их эфиры регулируют процесс:
образования родопсина;
рост и дифференцировку
превращение эпителия в слизистый.
Кальциферол (D)
Дефицит витамина D сопровождается снижением содержания кальция и фосфора в костной ткани и в раннем возрасте приводит к развитию рахита. Отсутствие эффекта при лечении витамином D указывает на связь рахита с нарушением функции паращитовидных желез или почек .
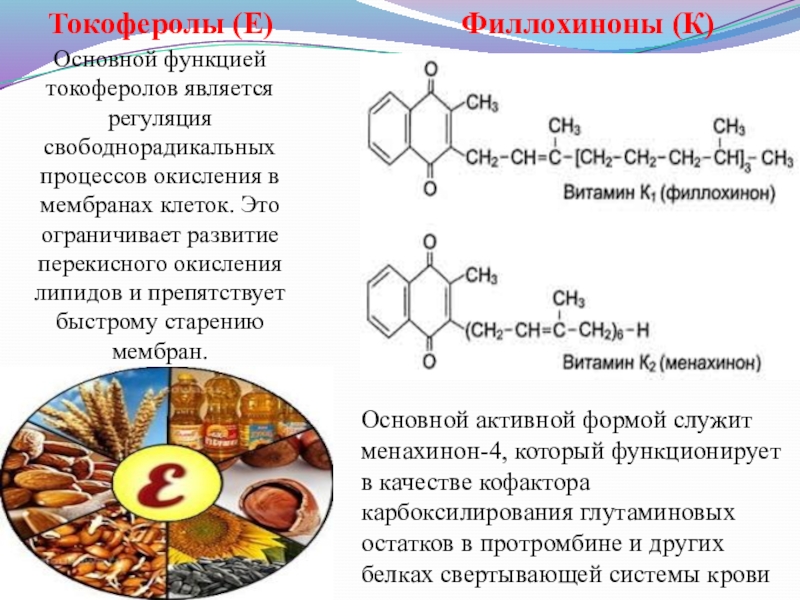
Слайд 10Токоферолы (Е)
Основной функцией токоферолов является регуляция свободнорадикальных процессов окисления в мембранах
Филлохиноны (К)
Основной активной формой служит менахинон-4, который функционирует в качестве кофактора карбоксилирования глутаминовых остатков в протромбине и других белках свертывающей системы крови
Слайд 12Соединения, которые отвечают основным свойствам витаминов, но их дефицит не вызывает
Холин – биологическая роль заключается в участии в синтезе фосфатидов и ацетилхолина.
Оротовая кислота – необходима для образования уридинфосфата и синтеза РНК и гликогена.
Пангамовая кислота – активирует окислительно- востановительные реакции, способствует производству макроэргических соединений, обезвреживанию токсинов, повышает устойчивость к гипоксии.
Убихинон (Q) – может возникать повышение потребности в уби- хиноне при мышечной дистрофии, некоторых заболеваниях миокарда и анемиях.
Эссенциальные жирные кислоты (F) – используются в основном для образования фосфолипидов биомембран и для производства биологически активных соединений: простагландинов, простациклинов, тромбоксанов и лейкотриенов
Слайд 13К антивитаминам относят вещества, которые затрудняют использование витаминов клеткой путем их
Согласно действию, антивитамины можно разделить на две группы:
неспецифические препятствующие проникновению в клетку витаминов, разрушающие (аскорбиназа, тиаминаза), связывающие витамины в неактивные формы и препятствующие всасыванию (авидин)
специфические
(сходные по химической природе, структуре и конкурирующие с витамином: Гидроокситиамин, Дихлоррибофлавин, Гомопантотеновая кислота )
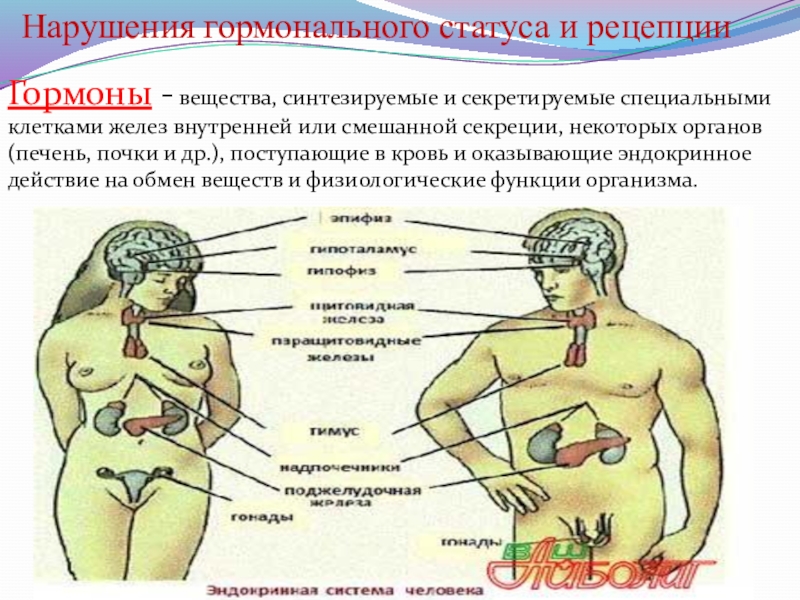
Слайд 14Нарушения гормонального статуса и рецепции
Гормоны - вещества, синтезируемые и секретируемые специальными
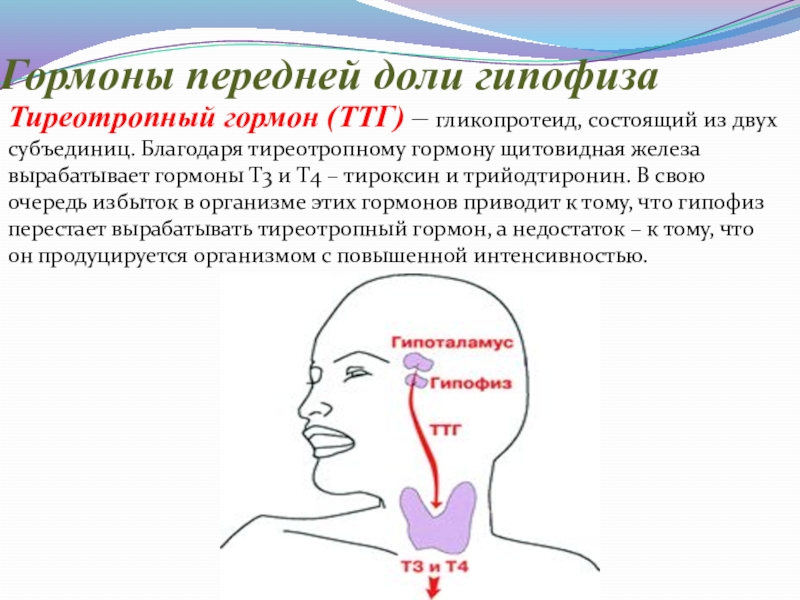
Слайд 15Гормоны передней доли гипофиза
Тиреотропный гормон (ТТГ) – гликопротеид, состоящий из двух
Слайд 16Соматотропный гормон (СТГ) – полипептид, включающий 191 аминокислотный остаток. При избыточном
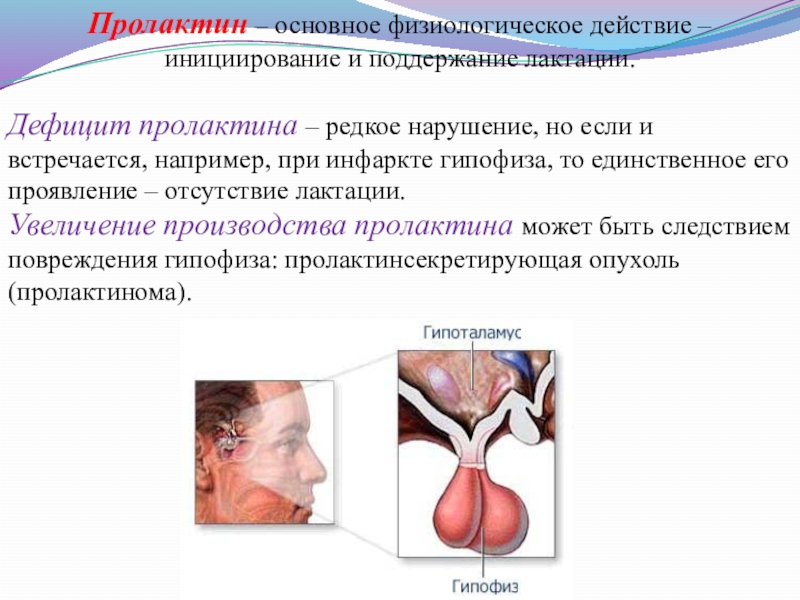
Слайд 17Пролактин – основное физиологическое действие – инициирование и поддержание лактации.
Дефицит
Увеличение производства пролактина может быть следствием повреждения гипофиза: пролактинсекретирующая опухоль (пролактинома).
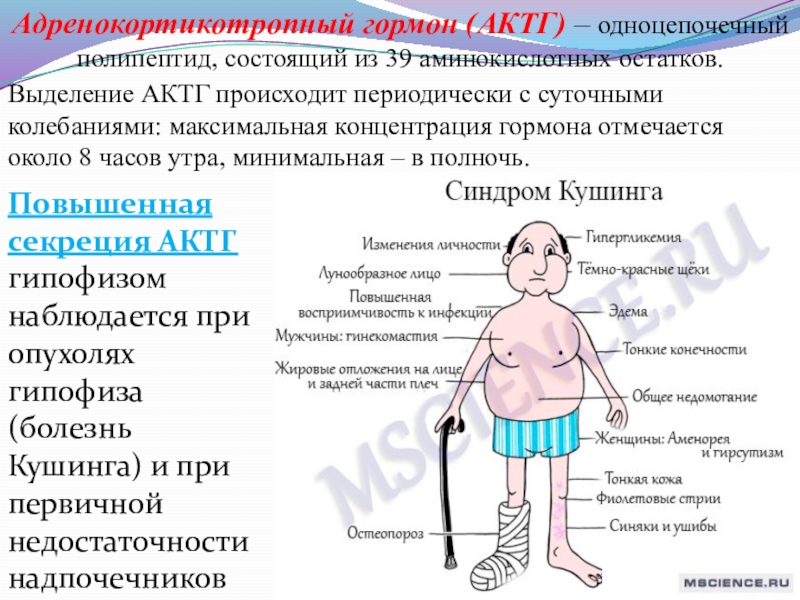
Слайд 18Адренокортикотропный гормон (АКТГ) – одноцепочечный полипептид, состоящий из 39 аминокислотных остатков.
Выделение
Повышенная секреция АКТГ гипофизом наблюдается при опухолях гипофиза (болезнь Кушинга) и при первичной недостаточности надпочечников (болезнь Аддисона).
Слайд 19Гормоны задней доли гипофиза
Окситоцин
участвует в регуляции сократимости матки и продукции
Вазопрессин
При снижении секреции вазопрессина наблюдается развитие несахарного диабета – нерегулируемая экскреция воды из организма и как следствие обезвоживание организма.
Слайд 20Гипофункция коры надпочечников получила название болезнь Аддисона. Клинически недостаточность коры проявляется
Гормоны надпочечников
надпочечники состоят из двух функционально и структурно различных частей: коры и мозгового слоя.
Заболевания коры надпочечников
Гиперфункция коры надпочечников
Синдром Конна - избыточная секреция альдостерона (минералокортикоидный гормон). Основное клиническое проявление –повышенное выведение калия почками и задержка натрия.
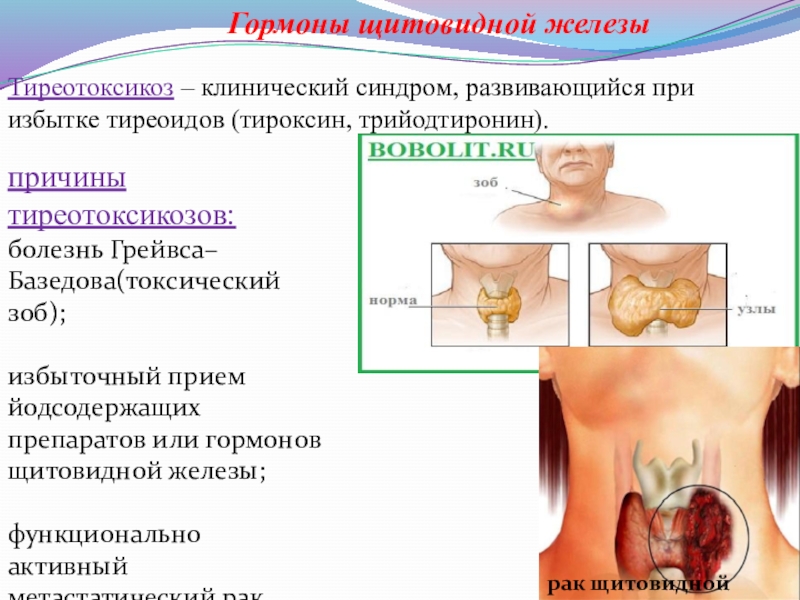
Слайд 21Гормоны щитовидной железы
причины тиреотоксикозов:
болезнь Грейвса–Базедова(токсический зоб);
избыточный прием йодсодержащих препаратов или
функционально активный метастатический рак щитовидной железы;
Тиреотоксикоз – клинический синдром, развивающийся при избытке тиреоидов (тироксин, трийодтиронин).
рак щитовидной железы
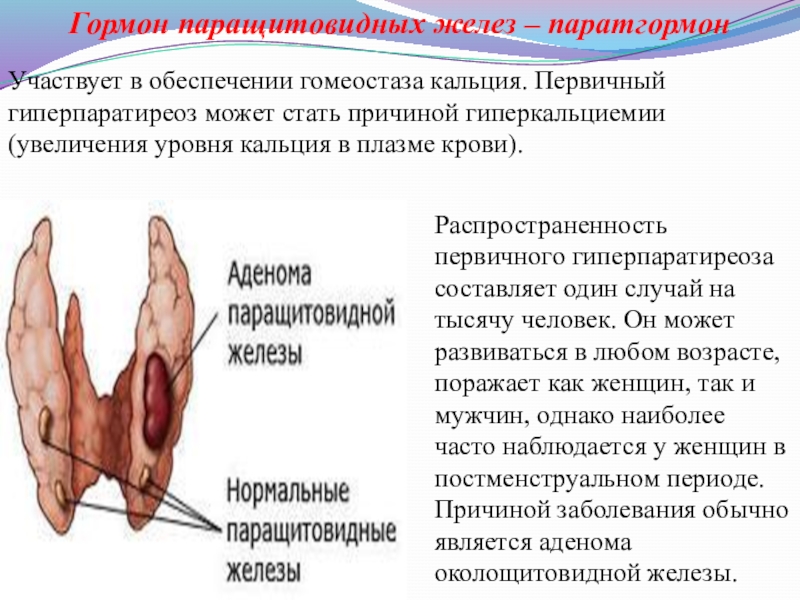
Слайд 22Гормон паращитовидных желез – паратгормон
Участвует в обеспечении гомеостаза кальция. Первичный гиперпаратиреоз
Распространенность первичного гиперпаратиреоза составляет один случай на тысячу человек. Он может развиваться в любом возрасте, поражает как женщин, так и мужчин, однако наиболее часто наблюдается у женщин в постменструальном периоде. Причиной заболевания обычно является аденома околощитовидной железы.
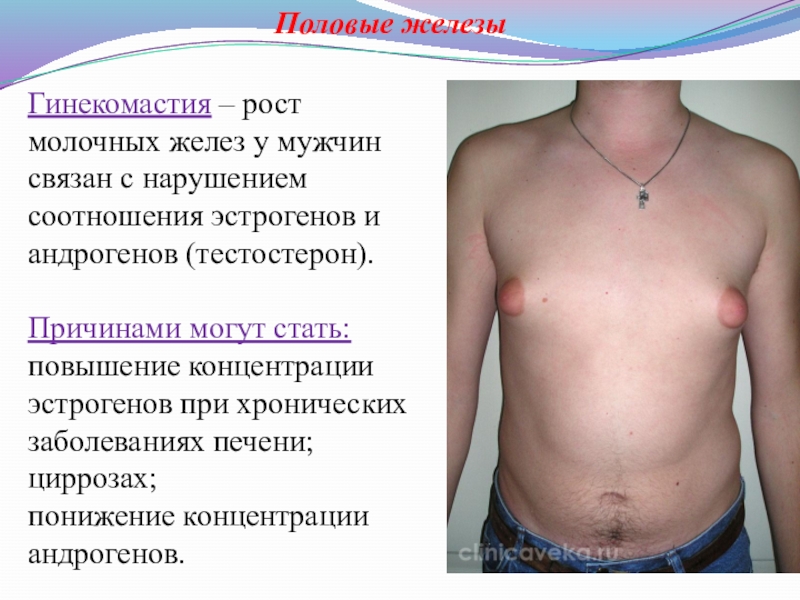
Слайд 23Половые железы
Гинекомастия – рост молочных желез у мужчин связан с нарушением
Причинами могут стать: повышение концентрации эстрогенов при хронических заболеваниях печени; циррозах;
понижение концентрации андрогенов.
Слайд 24Гормоны желудочного тракта и поджелудочной железы
Основным эндокринным заболеванием, связанным с нарушением
Слайд 26Белки́ (протеи́ны, полипепти́ды)— высокомолекулярные органические
азотсодержащие полимерные соединения, состоящие из альфа-аминокислот, соединѐнных
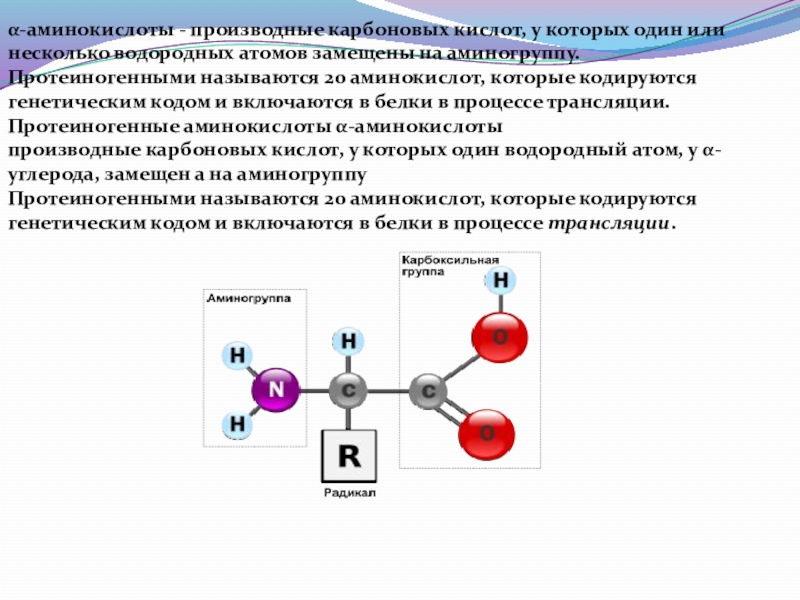
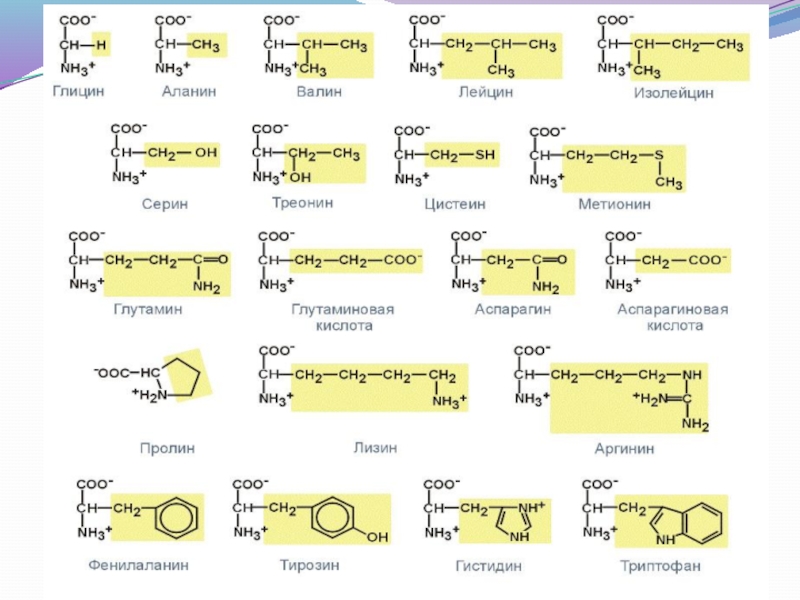
Слайд 27α-аминокислоты - производные карбоновых кислот, у которых один или
несколько водородных атомов
Протеиногенными называются 20 аминокислот, которые кодируются
генетическим кодом и включаются в белки в процессе трансляции.
Протеиногенные аминокислоты α-аминокислоты
производные карбоновых кислот, у которых один водородный атом, у α-
углерода, замещен а на аминогруппу
Протеиногенными называются 20 аминокислот, которые кодируются
генетическим кодом и включаются в белки в процессе трансляции.
Слайд 28Классификация аминокислот
По радикалу
Неполярные: аланин, валин, изолейцин, лейцин, пролин, метионин, фенилаланин, триптофан
Полярные
Полярные заряженные отрицательно при pH=7: аспарагиновая кислота,
глутаминовая кислота
Полярные заряженные положительно при pH=7: лизин, аргинин, гистидин
По функциональным группам
Алифатические
Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
Оксимоноаминокарбоновые: серин, треонин
Моноаминодикарбоновые: аспарагиновая кислота, глутаминовая кислота
Амиды моноаминодикарбоновых: аспарагин, глутамин
Диаминомонокарбоновые: лизин, аргинин
Серосодержащие: цистеин, метионин
Ароматические: фенилаланин, тирозин, триптофан, гистидин
Гетероциклические: триптофан, гистидин, пролин
Иминокислоты: пролин
Слайд 30Протеины(от греч. protos – первый, важнейший) – точно отражает первостепенное биологическое
Простые белки:
- Протамины
- Сальмин (в молоках семги, макрели), клупеин (в молоках сельди), скомбрин (в
молоках скумбрии).
- Гистоны
Н1 Н2А Н2В Н3 и Н4
Н1, Н2А, Н2В, Н3 и Н4 – классы.
- Альбумины:
Сывороточный альбумин (в крови), овальбумин, авидин (в яйце)
- Глобулины:
Лактоглобулин (в молоке), миозин (в волокнах мышц), тиреоглобулин (в
щитовидной железе), нейроглобулин, нейростромин (в нервной ткани),
глицинин, эдестин, легумин
(растительные), гамма-глобулин (в плазме крови)
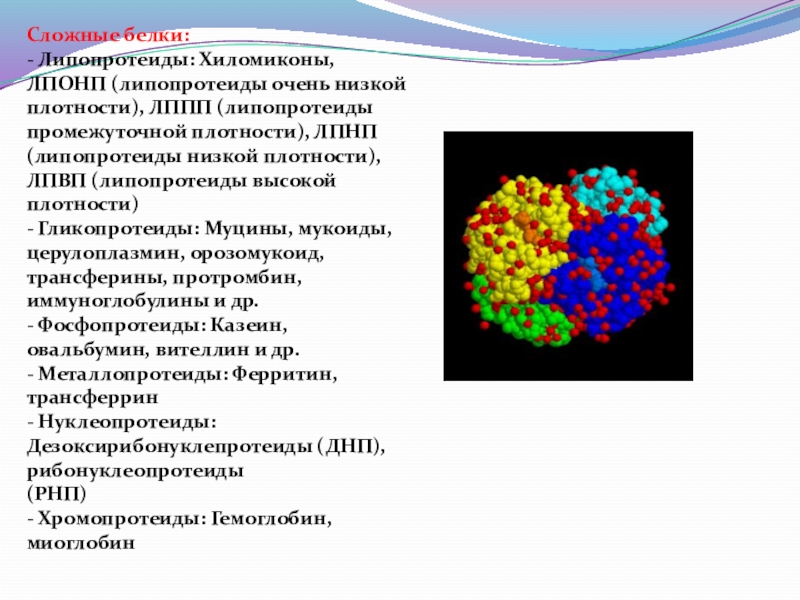
Слайд 32Сложные белки:
- Липопротеиды: Хиломиконы, ЛПОНП (липопротеиды очень низкой
плотности), ЛППП (липопротеиды промежуточной
(липопротеиды низкой плотности), ЛПВП (липопротеиды высокой плотности)
- Гликопротеиды: Муцины, мукоиды, церулоплазмин, орозомукоид,
трансферины, протромбин, иммуноглобулины и др.
- Фосфопротеиды: Казеин, овальбумин, вителлин и др.
- Металлопротеиды: Ферритин, трансферрин
- Нуклеопротеиды: Дезоксирибонуклепротеиды (ДНП), рибонуклеопротеиды
(РНП)
- Хромопротеиды: Гемоглобин, миоглобин
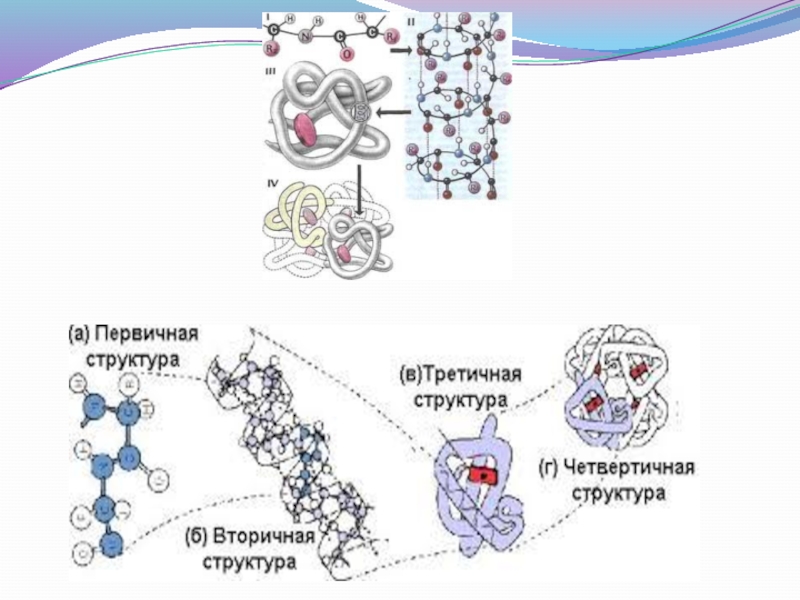
Слайд 35 Первичная структура
Представляет собой вытянутую нить; определяется
3 факторами:
природой
количеством АК
последовательностью АК.
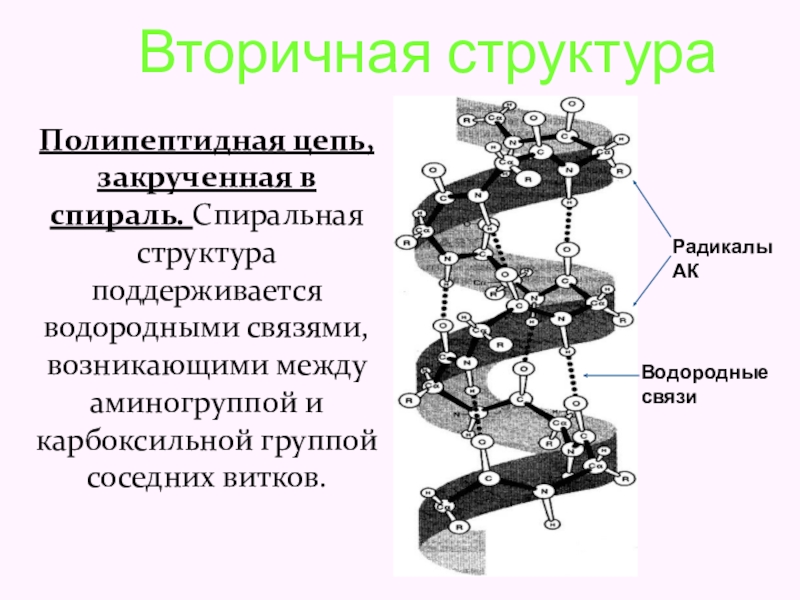
Слайд 36 Вторичная структура
Полипептидная цепь, закрученная в спираль. Спиральная
Радикалы АК
Водородные связи
Слайд 37 Третичная структура
Представляет собой свёрнутую в клубок спираль.
Клубок
Слайд 38.
Четвертичная структура
Несколько полипептидных цепей, образующих
Имеют лишь
некоторые белки.
Например, гемоглобин.
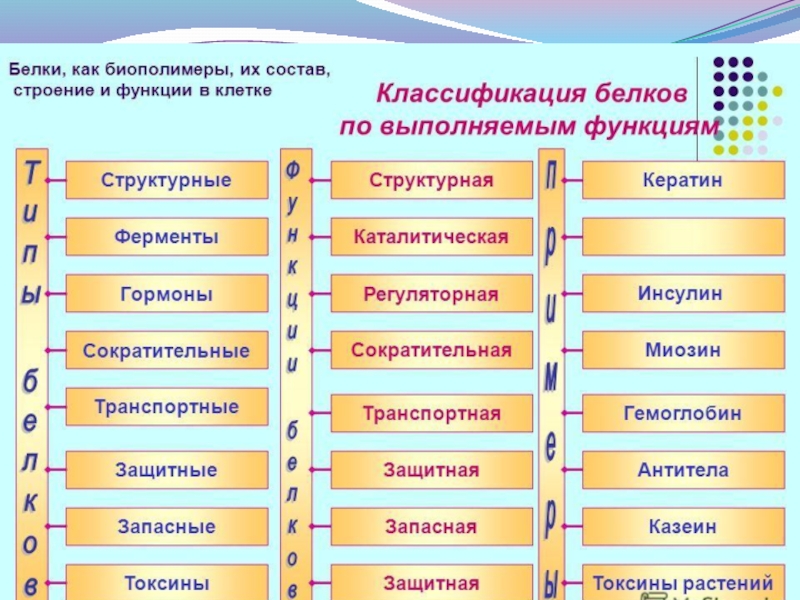
Слайд 41Ферменты, или энзимы, - это белки, выполняющие функции биологических катализаторов.
Белковая часть
Кофакторами могут быть ионы металлов или органические соединения, которые обычно называют коферментами. Если связь между ферментом и коферментом прочная, ковалентная, то небелковую часть фермента называют простетической группой. Классы ферментов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы (синтетазы).
Слайд 42Реакции трансаминирования - это реакции переноса α-аминогруппы с аминокислоты на α-кетокислоту,
Биологическая роль трансаминирования: это заключительный этап синтеза заменимых аминокислот из соответствующих α-кетокислот и это первая стадия
дезаминирования большинства аминокислот. Дезаминирование аминокислот -
это реакция отщепления α-аминогруппы от аминокислоты, в результате
которой образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака.
Виды дезаминирования аминокислот:
восстановительное, окислительное, гидролитическое, внутримолекулярное.
Непрямое дезаминирование (трансдезаминирование) - основной способ дезаминирования большинства аминокислот.
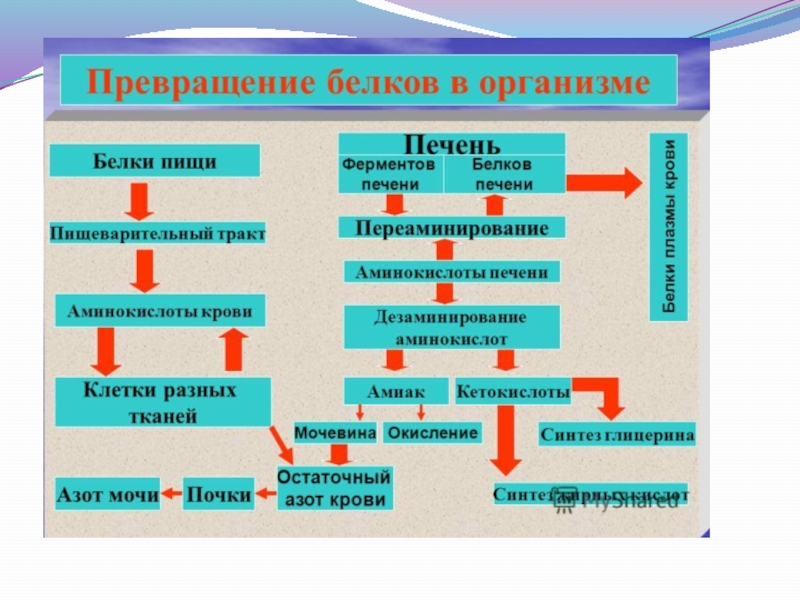
Слайд 432. Обзевреживание аммиака и цикл мочевинообразования.
Аммиак, образовавшийся в реакциях дезминирования аминокислот
синтез глутамина под действием глутаминсинтетазы;
синтез аспарагина под действием аспарагинсинтетазы;
восстановительное аминированиеα-кетоглутарата;
превращение в нетоксичное соединение – мочевину, основной конечный продукт азотистого обмена. Синтез
мочевины представляет собой циклический процесс, состоящий из нескольких стадий, ключевым соединением которого , замыкающим цикл, является орнитин. Поэтому циклносит название «орнитиновый цикл»Биологическая роль орнитинового цикла состоит в следующем: превращение азота аминокислот носит название «орнитиновый цикл».
Слайд 44Общие пути биосинтеза аминокислот.
В организме человека возможен синтез заменимых аминокислот, к
относятся: аланин, аргинин, аспартат, гистидин, глицин, глутамат, глутамин,
пролин, серин, тирозин, цистеин. Недостаток в пище любой из этих
аминокислот не будет сопровождаться еѐ дефицитом в организме. Основными
путями образования заменимых аминокислот являются: 1)трансаминирование α-кетокислот, 2) восстановительное аминированиеα-кетокислот, 3) синтез с участием незаменимых аминокислот. При трансаминировании источниками
атомов углерода в этих реакциях служат метаболиты гликолиза и цикла Кребса,
источниками атомов азота – другие аминокислоты, чаще всего – глутамат. При
Восстановительное дезаминировании источником атома азота аминогруппы
является молекула аммиака, источником углерода - α-кетокислоты, чаще всего - α-кетоглутарат.
Слайд 45Сахарный диабет — это группа метаболических (обменных) заболеваний, характеризующихся гипергликемией, которая
Выделяют 4 клинических типа сахарного диабета: сахарный диабет 1 типа, сахарный диабет 2 типа, другие типы (при генетических дефектах, эндокринопатиях, инфекциях, болезнях поджелудочной железы и др.) и гестационный диабет (диабет беременных). Новая классификация пока не является общепринятой и носит рекомендательный характер. Вместе с тем необходимость пересмотра старой классификации обусловлена прежде всего появлением новых данных о гетерогенности сахарного диабета, а это, в свою очередь, требует разработки особых дифференцированных подходов к диагностике и лечению заболевания.
Слайд 46СД 1 типа — хроническое заболевание, вызванное абсолютным дефицитом инсулина, возникающим
СД 2 типа — хроническое заболевание, вызванное относительным дефицитом инсулина (снижена чувствительность рецепторов инсулинзависимых тканей к инсулину) и проявляющееся хронической гипергликемией с развитием характерных осложнений. На долю СД 2 типа приходится 80% всех случаев сахарного диабета. Частота встречаемости — 300:100 000 населения. Преобладающий возраст, как правило, старше 40 лет. Чаще диагностируется у женщин. Факторы риска — генетические и ожирение.