- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
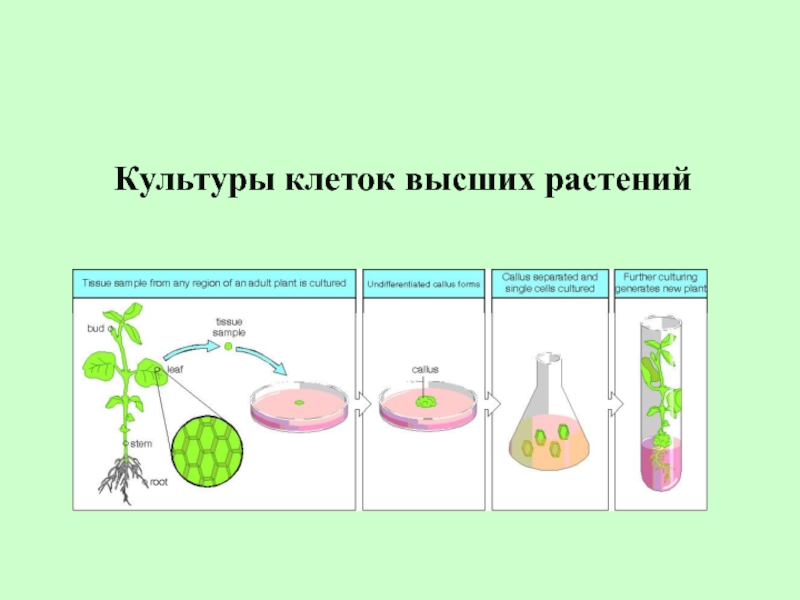
Презентация, доклад по биологии на тему Культуры клеток высших растений
Содержание
- 1. Презентация по биологии на тему Культуры клеток высших растений
- 2. 1. Культура клеток высших растений.2. История развития
- 3. Среди новых подходов наиболее перспективным является применение
- 4. 1. Культуры клеток высших растений имеют две
- 5. Все это позволяет считать, что культуры клеток
- 6. 2. Культивируемые клетки высших растений могут рассматриваться
- 7. Слайд 7
- 8. Направления создания новых технологий на основе культивируемых
- 9. культивируемые в суспензии клетки могут применятся как
- 10. 2. Ускоренное клональное микроразмножение растений, позволяющее из
- 11. 5. Антерные культуры – культуры пыльников и
- 12. 7. Криоконсервация и другие методы сохранения генофонда.8.
- 13. 2. История развития методаСамые ранние работы по
- 14. Опыт Юлиуса Сакса (нем. Julius Sachs) показал,
- 15. Первым исследователем, занявшимся установлением минимального размера экспланта,
- 16. Еще в 1878-1892гг. нем. физиолог Х.Фёхтинг провел
- 17. Основы экспериментальной эмбриологии растений были заложены исследованиями
- 18. Г. Габерланд (1902) научился культивировать отдельные клетки
- 19. Исходное предположение автора, что содержащие хлорофилл клетки
- 20. Ряд ученых, в том числе и его
- 21. Толчком к возобновлению работ послужили исследования Гаррисона,
- 22. Французский ученый Мольяр уже в 1921 культивировал
- 23. Строение проростков фасоли
- 24. В 1922 г. один из учеников Рехингера
- 25. Практически одновременно и независимо от Коттэ, американский
- 26. Не всегда эти исследования были успешны. Под
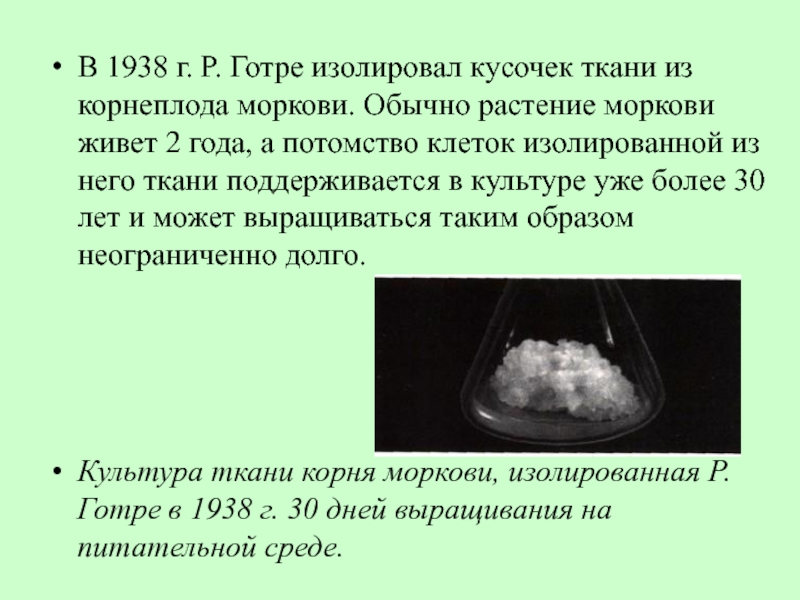
- 27. В 1938 г. Р. Готре изолировал кусочек
- 28. Такую же способность наблюдал Ф. Уайт для
- 29. В ней он выделял несколько периодов в
- 30. 5. Период 1940 - 1960 гг. значительно
- 31. Американский ученый Ф. Стюард, работая с культурой
- 32. 6. В 1960 - 1975 гг. положено
- 33. В лабораториях Р. Г. Бутенко, Ю. Ю.
- 34. 7. Начиная с 1976 г., разрабатывались методы
- 35. Основные термины культуры клетокТотипотентность (от лат. totus
- 36. Тотипотентностью обладают оплодотворенные яйцеклетка растений и яйцо
- 37. В экспериментальных условиях in vitro при выращивании
- 38. Дедифференциация – переход специализированных, неделящихся клеток к
- 39. Инокулят - часть суспензионной (каллусной) культуры, используемая
- 40. Протопласт - растительная клетка, лишенная клеточной стенки
- 41. Эксплант - фрагмент ткани или органа, инкубируемый
- 42. В настоящее время известно большое число различных
- 43. Слайд 43
- 44. 3. Морфо-физиологическая характеристика каллусных тканейВыделяют два типа
- 45. Нормальные клетки в культуре могут существовать в
- 46. КаллусВ природе на стволе эритрины в пробиркеhttp://users.ugent.be/~pdebergh/inv/inv4_p01.htm
- 47. Процессу образования каллуса предшествует дедифференцировка тканей экспланта.
- 48. Таким образом, после деления перед каждой дочерней
- 49. компетенцияDifferentiation of xylem, phloem and parenchyma cells (Raven Evert and Eichhorn 1992)http://users.ugent.be/~pdebergh/tot/tot3__01.htm
- 50. Компетенция — способность клетки воспринимать индуцирующее воздействие
- 51. Каллус - аморфная масса тонкостенных паренхимных клеток,
- 52. Каллус может иметь желтый, белый, зеленый или красный цвет (антоцианин).
- 53. Типы каллусной ткани1. рыхлая 2. средней плотности,
- 54. Типы каллуса Gloriosa Высокодекоративные растения для культуры в теплых помещениях.
- 55. В цикле выращивания каллусной ткани клетки выделяют
- 56. Дифференциация каллуса у Lampranthus и Erythrina каллус образует
- 57. Кривая роста биомассыПассирование (субкультивирование) - первичный каллус
- 58. Причины генетической гетерогенности каллусной тканиГетерогенность экспланта(исходного материала)Длительное пассирование клеточных культурВлияние клеток, входящих в состав питательных сред.
- 59. Процессы дифференцировки в каллусной ткани: морфогенез и
- 60. Морфогенез - возникновение организованныхструктур из неорганизованной массы
- 61. МорфогенезГеммогенез – образование побегов.Ризогенез – образование корней.Морфогенная
- 62. Органогенез каллуса гипоксисаНебольшая область делящихся клеток (meristemoids)
- 63. 4. Суспензионные культурыСуспензионные культуры - отдельные клетки
- 64. (a) Cells in a near-saturated suspension culture
- 65. Признаком "хорошей" линии служит способность клеток к
- 66. Культура протопластов Arabidopsis thaliana и отдельные клетки
- 67. Получение суспензионной культурыКлеточную суспензию получают, помещая рыхлую
- 68. Для инициализации суспензионной культуры необходимо 2 -
- 69. Слайд 69
- 70. Оценка роста суспензионных культур клеток 1. Объем
- 71. Фильтр для измерения сырой /сухой массы клеток суспензииГемоцитомер для подсчета числа клеток
- 72. 3. Сырая и сухая масса Суспензия клеток
- 73. 4. Содержание белкаДля определения белка клетки собирают
- 74. 6. Жизнеспособность клеток Оценивают, изучая движение цитоплазмы
- 75. По полученным данным строят ростовые кривые, которые
- 76. Слайд 76
- 77. Различают два вида систем культивирования: открытую и
- 78. Открытые (проточные) культуры характеризуются поступлением свежей питательной
- 79. Роллеры для пробирок STUARTОрбитальный шейкер ЛАБ-ПУ-01
- 80. Платформа-шейкернастольная качалка CERTOMAT
- 81. Ферментер Biostat DBIOSTAT D-DCU– это производственно-масштабируемые пилотные
- 82. Особенности культивирования растительных клетокЧем крупнее становится клетка,
- 83. Мягкое перемешивание и аэрацию обеспечивает пневматический способ
- 84. Сравнивали рост и образование метаболитов клетками в
- 85. Отличительная особенность суспензионных культур клеток растений —
- 86. Время генерации (интервал времени между двумя последовательными
- 87. Суспензионные культуры используют для промышленного получения вторичных
- 88. В настоящее время в разных странах около
- 89. Основные понятия темыэксплант, пассирование, детерминация, дифференцировка, топипотентность, каллус, органогенез, геммогенез, ризогенезсуспензионная культура, адгезия
Слайд 21. Культура клеток высших растений.
2. История развития метода.
3. Морфофизиологическая характеристика
4. Суспензионные культуры растительных клеток. Методы изучения роста клеточных структур.
Лекция 2. Культуры клеток высших растений
Слайд 3Среди новых подходов наиболее перспективным является применение клеточной инженерии (синоним: клеточная
Клеточная инженерия основана на использовании принципиально нового метода – метода изолированной культуры клеток эукариотических организмов (растений, животных). Выращивание изолированных клеток и тканей на искусственных питательных средах (in vitro) в стерильных условиях получило название метода культуры изолированных тканей.
Слайд 41. Культуры клеток высших растений имеют две сферы применения:
1. Изучение
Слайд 5
Все это позволяет считать, что культуры клеток являются новой экспериментально созданной
Слайд 6
2. Культивируемые клетки высших растений могут рассматриваться как типичные микрообъекты, достаточно
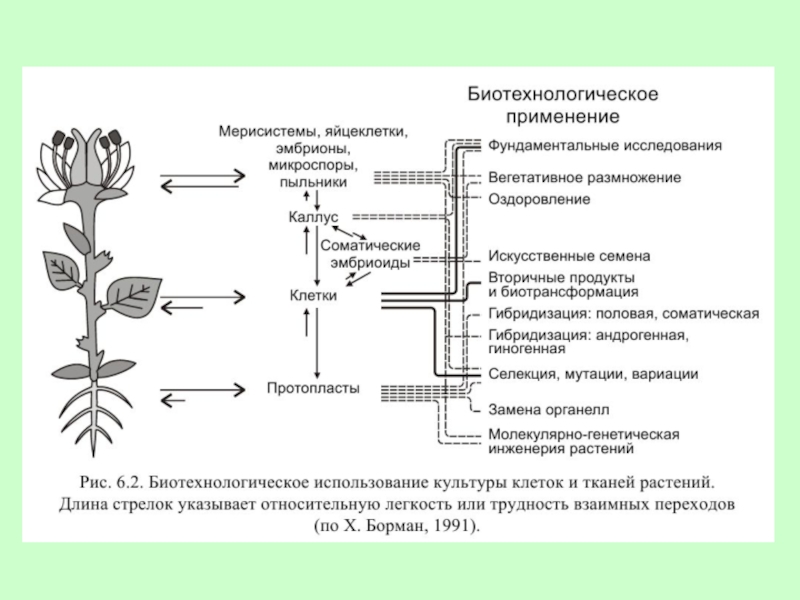
Слайд 8Направления создания новых технологий на основе культивируемых тканей и клеток растений:
Получение
традиционных продуктов вторичного метаболизма (токсинов, гербицидов, регуляторов роста, алкалоидов, стероидов, терпеноидов, имеющих медицинское применение);
синтез новых необычных соединений, что возможно благодаря исходной неоднородности клеточной популяции, генетической изменчивости культивируемых клеток и селективному отбору клеточных линий со стойкими модификациями, а в некоторых случаях и направленному мутагенезу;
Слайд 9культивируемые в суспензии клетки могут применятся как мультиферментные системы, способные к
Слайд 102. Ускоренное клональное микроразмножение растений, позволяющее из одного экспланта получать от
3. Получение безвирусных растений.
4. Эмбриокультура и оплодотворение in vitro часто применяются для преодоления постгамной несовместимости или щуплости зародыша, для получения растений после отдаленной гибридизации. При этом оплодотворенная яйцеклетка вырезается из завязи с небольшой частью ткани перикарпа и помещается на питательную среду. В таких культурах можно также наблюдать стадии развития зародыша.
Слайд 115. Антерные культуры – культуры пыльников и пыльцы используются для получения
6. Клеточный мутагенез и селекция. Тканевые культуры могут производить регенеранты, фенотипически и генотипически отличающиеся от исходного материала в результате сомаклонального варьирования. При этом в некоторых случаях можно обойтись без мутагенной обработки.
Слайд 127. Криоконсервация и другие методы сохранения генофонда.
8. Иммобилизация растительных клеток.
9. Соматическая
10. Конструирование клеток путем введения различных клеточных органелл.
11. Генетическая трансформация на хромосомном и генном уровнях.
12. Изучение системы «хозяин – паразит» с использованием вирусов, бактерий, грибов и насекомых.
Слайд 132. История развития метода
Самые ранние работы по изолированию культур принадлежат Блоцишевскому
Слайд 14
Опыт Юлиуса Сакса (нем. Julius Sachs) показал, что такое воззрение несправедливо.
Юлиус Сакс, 1832-1897
Слайд 15Первым исследователем, занявшимся установлением минимального размера экспланта, был австр. ботаник Карл
Он выращивал тонкие срезы корня свеклы и одуванчика и сегменты стебля тополя на песке с применением водопроводной воды, без стерильных условий. Эти исследования показали, что каллус образуется при толщине среза не менее 1,5 мм.
Слайд 16Еще в 1878-1892гг. нем. физиолог Х.Фёхтинг провел ряд экспериментов, доказывающих тотипотентность
Полярность - различие между противоположными полюсами организма, органа, клетки. Апикальная и базальная часть растения.
Слайд 17Основы экспериментальной эмбриологии растений были заложены исследованиями Моссарта (1902), который наблюдал
В связи с этим было высказано предположение, что пыльцевая трубка не только обеспечивает передвижение спермиев к яйцеклетке, но и переносит в завязь ауксины, стимулирующие ее рост.
Слайд 18Г. Габерланд (1902) научился культивировать отдельные клетки в течение некоторого времени.
Габерландт, Хаберландт Готлиб (1854-1945)
Слайд 19Исходное предположение автора, что содержащие хлорофилл клетки полностью обеспечивают себя питательными
Габерланд также выдвинул гипотезу о тотипотентности любой живой клетки растения, которая впоследствии была подтверждена экспериментально.
Слайд 20
Ряд ученых, в том числе и его ученики, последовали его примеру
Слайд 21Толчком к возобновлению работ послужили исследования Гаррисона, проведенные в 1904 -
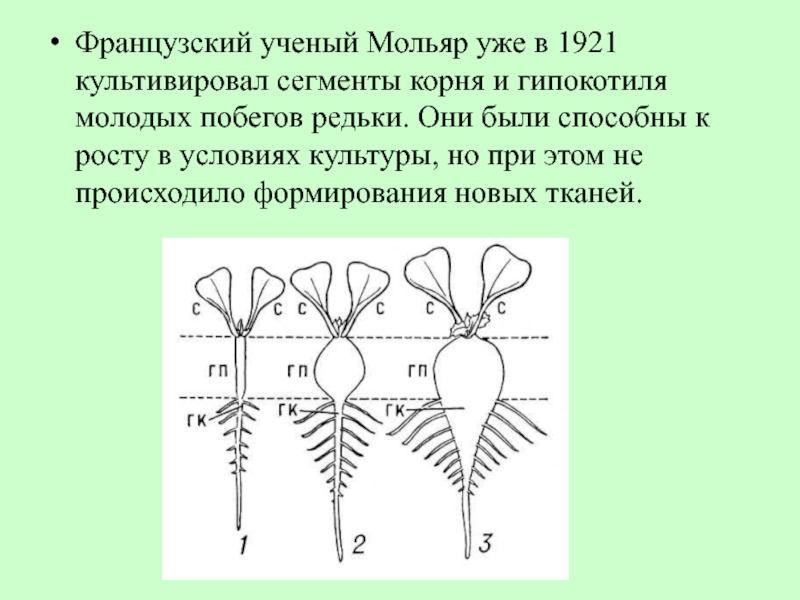
Слайд 22Французский ученый Мольяр уже в 1921 культивировал сегменты корня и гипокотиля
Слайд 24В 1922 г. один из учеников Рехингера , немецкий ученый В.
вычленение апикальной меристемы под бинокуляром
Слайд 25Практически одновременно и независимо от Коттэ, американский исследователь
apex in corn (Zea mays)
http://www.sbs.utexas.edu/mauseth/weblab/webchap6apmer/6.8-4a.htm
Слайд 26Не всегда эти исследования были успешны. Под влиянием работ Карреля и
Начало длительным и удачным исследованиям по культивированию клеток и тканей растений положили работы американского исследователя Филиппа Уайта и француза Роже Готре. Они показали, что изолированные органы и ткани могут расти в культуре неограниченно долгое время, если их пересаживать на свежую питательную среду.
Слайд 27В 1938 г. Р. Готре изолировал кусочек ткани из корнеплода моркови.
Культура ткани корня моркови, изолированная Р.Готре в 1938 г. 30 дней выращивания на питательной среде.
Слайд 28Такую же способность наблюдал Ф. Уайт для клеток опухолевого происхождения. Результаты
Philip R. White (1901-1968)
Слайд 29В ней он выделял несколько периодов в истории развития метода культуры
1. 1834 -1900 гг. - создание и разработка клеточной теории.
2. 1900 –1922 гг. - сформулирована идея культуры тканей.
3. 1922 – 34 гг. - безуспешные поиски методов, обеспечивающих длительное культивирование тканей.
4. 1934 - 39 гг. - детальная разработка техники культуры растительных тканей.
Слайд 305. Период 1940 - 1960 гг. значительно расширил список видов, выращиваемых
Слайд 31Американский ученый Ф. Стюард, работая с культурой изолированной флоэмы моркови, получил
Показано значение кинетина для пролиферации клеток in vitro и индукции стеблевого морфогенеза. Изучением этих вопросов занимались такие ученые, как Р. Хеллер, И. Нич, Ф. Скуг, Ф. Стевард, Р. Г. Бутенко. В это же время разработаны методы получения и выращивания клеточных суспензий, а также культивирования отдельной клетки, деление которой индуцируется с помощью ткани-няньки.
Слайд 326. В 1960 - 1975 гг. положено начало методу получения изолированных
Такебе с сотрудниками были определены условия культивирования изолированных протопластов, при которых они образуют клеточные стенки, делятся и дают начало клеточным линиям, способным к морфогенезу. Были разработаны методы гибридизации соматических клеток путем слияния протопластов и введения в них вирусных РНК, клеточных органелл, бактерий.
Слайд 33В лабораториях Р. Г. Бутенко, Ю. Ю. Глебы проводились исследования поведения
Расчеренкованные по линиям
растения-регенеранты
http://www.meristema.info/naprav.html
Слайд 347. Начиная с 1976 г., разрабатывались методы электрослияния протопластов и селекции
Слайд 35Основные термины культуры клеток
Тотипотентность (от лат. totus - весь, целый и
Слайд 36Тотипотентностью обладают оплодотворенные яйцеклетка растений и яйцо животных организмов. Что касается
У растений в природных условиях тотипотентность могут проявлять и специализированные клетки. Вегетативное размножение.
Тотипотентность у растений реализуется при заживлении ран; на раневой поверхности растений в результате неорганизованной пролиферации клеток происходит развитие каллуса (лат. callus – мозоль, толстая кожа).
Каллус способствует заживлению ран. Однако многие однодомные растений утратили способности к образованию каллуса и вегетативному размножению.
Слайд 37В экспериментальных условиях in vitro при выращивании фрагментов тканей, органов (эксплантов)
Реализация супрессированной in vivo тотипотентность легче всего осуществляется как при культивировании меристематических клеток, изолированных из кончиков корней и почек и использования сложных по составу культуральных сред, так и при культивировании каллуса.
Эти подходы были удачно реализованы в 30-е годы в работах американского исследователя Филиппа Уайта и французского исследователя Роже Готре, которых принято считать родоначальниками современных методов культивирования изолированных органов и тканей растений.
Слайд 38
Дедифференциация – переход специализированных, неделящихся клеток к образованию недифференцированных делящихся каллусных
Дифференцировка - состояние специализации клеток, отличающее их от других.
Слайд 39Инокулят - часть суспензионной (каллусной) культуры, используемая для пересадки в свежую
Меристема – образовательные ткани с активно делящимися недиференцированными клетками.
Органогенез – процесс возникновения в неорганизованной растущей массе каллусных клеток зачатков органов (корней, листовых зачатков и побегов).
Слайд 40Протопласт - растительная клетка, лишенная клеточной стенки с помощью ферментативного разрушения
Субкультивирование – перенос трансплантатов (инокулята) в другой культуральный сосуд на свежую питательную среду.
Суспензионная культура - выращивание отдельных клеток или небольших групп их во взвешенном состоянии в жидкой среде при использовании аппаратуры, обеспечивающей их аэрацию и перемешивание.
Слайд 41
Эксплант - фрагмент ткани или органа, инкубируемый самостоятельно или используемый для
in vitro - выращивание живого материала «в стекле», на искусственных питательных средах, в асептических условиях.
in vivo – выращивание живого материала в естественных условиях.
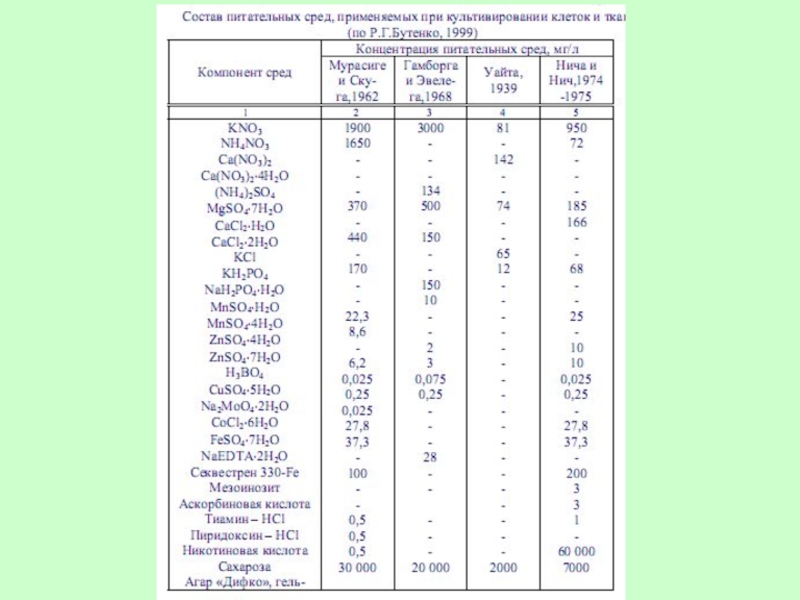
Слайд 42В настоящее время известно большое число различных по составу питательных сред
Среда Тошио Мурасиге и Фольке Скуга – универсальная. Она пригодна для образования и роста каллусов, индукции морфогенеза у большинства двудольных растений.
Среда Гамборга и Эвелега подходит для культивирования клеток и тканей бобовых растений и злаков.
Среда Уайта обеспечивает укоренение побегов и нормальный рост стебля после регенерации,
среда Нича и Нич пригодна для индукции андрогенеза в культуре пыльников.
Слайд 443. Морфо-физиологическая характеристика каллусных тканей
Выделяют два типа культивируемых растительных клеток: нормальные
Опухолевые клетки морфологически мало отличаются от каллусных. Физиологическим различием является гормононезависимость опухолевых клеток. Эти клетки лишены способности дать начало нормально организованным структурам (корни, побеги) в процессе органогенеза. Иногда они образуют тератомы (уродливые органоподобные структуры), дальнейшее развитие которых невозможно.
Слайд 45Нормальные клетки в культуре могут существовать в двух видах: в виде
Поверхностное культивирование осуществляют на полужидкой агаризованной среде, среде с добавлением других желирующих полимеров, на дисках из полиуретана, на мостиках из фильтровальной бумаги, полупогруженных в жидкую питательную среду. Можно также использовать комочки ваты, пропитанные питательной средой, которые сверху покрываются кусочком фильтровальной бумаги.
Слайд 46Каллус
В природе на стволе эритрины
http://users.ugent.be/~pdebergh/inv/inv4_p01.htm
Слайд 47
Процессу образования каллуса предшествует дедифференцировка тканей экспланта. При дедифференцировке ткани теряют
Если эксплант, используемый для получения каллуса, является фрагментом органа, то имеет в своем составе эпидермальные клетки, клетки камбия, сосудистой системы, сердцевинной и первичной коровой паренхимы. Преимущественно пролиферируют клетки камбия, коры, сердцевинной паренхимы.
Слайд 48Таким образом, после деления перед каждой дочерней клеткой открывается одна из
1) Клетка может оставаться эмбриональной и вновь вступить в клеточный цикл с последующим митозом,
2) либо может оказаться как бы «вне цикла» (Go), перестав делиться,
3) или, приобретя компетенцию, постепенно детерминироваться и вступить на путь дифференцировки (специализации).
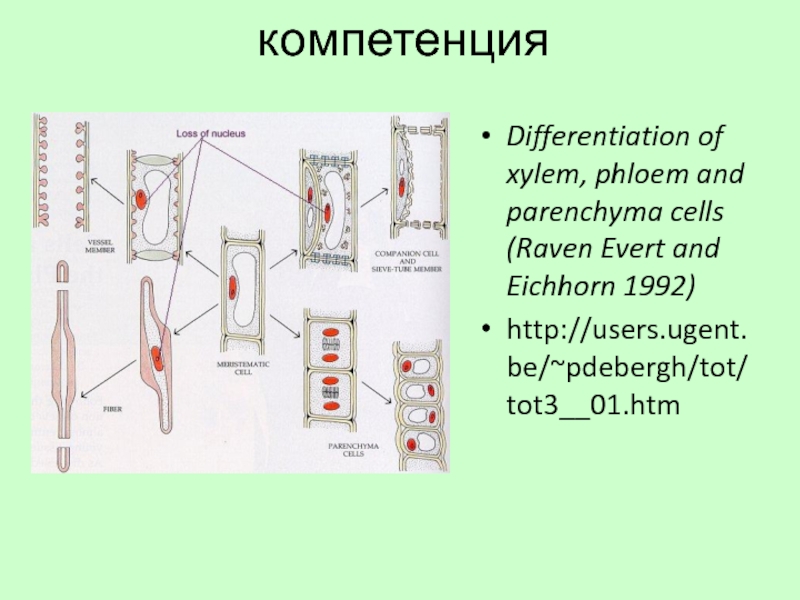
Слайд 49компетенция
Differentiation of xylem, phloem and parenchyma cells (Raven Evert and Eichhorn
http://users.ugent.be/~pdebergh/tot/tot3__01.htm
Слайд 50Компетенция — способность клетки воспринимать индуцирующее воздействие и специфически реагировать на
Детерминация — приобретение клеткой состояния готовности к реализации определенных наследственных свойств. Детерминация приводит к развитию по определенному пути с одновременным ограничением возможности развития в других направлениях. Детерминированная определенным образом клетка приобретает узкую специализацию, то есть дифференцируется и превращается в клетку какой-либо ткани.
Слайд 51Каллус - аморфная масса тонкостенных паренхимных клеток, не имеющую строго определенной
Каллус на питательной среде
Слайд 53Типы каллусной ткани
1. рыхлая
2. средней плотности, с хорошо выраженными меристематическими
3. плотная, с зонами редуцированного камбия и сосудов.
применение
для изучения физиологических процессов
для получения суспензионных культур
для регенерации растений
Слайд 55В цикле выращивания каллусной ткани клетки выделяют стадии
1 – деление
2 –
3 – дифференцировка (образование сосудов, ситовидных трубок, суберинизация клеток, образование секреторных клеток и трихом)
4 – деградация
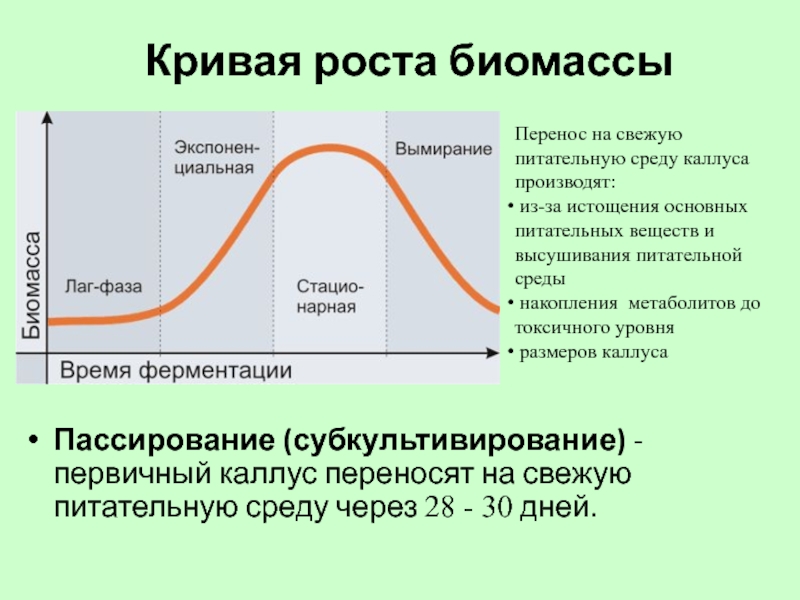
Слайд 57Кривая роста биомассы
Пассирование (субкультивирование) - первичный каллус переносят на свежую питательную
Перенос на свежую питательную среду каллуса производят:
из-за истощения основных питательных веществ и высушивания питательной среды
накопления метаболитов до токсичного уровня
размеров каллуса
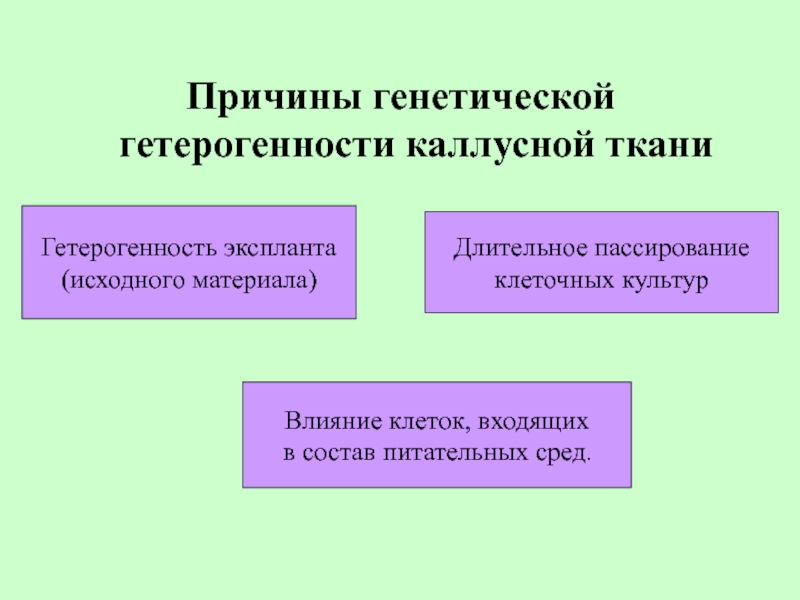
Слайд 58Причины генетической гетерогенности каллусной ткани
Гетерогенность экспланта
(исходного материала)
Длительное пассирование
клеточных культур
Влияние клеток,
в состав питательных сред.
Слайд 59Процессы дифференцировки в каллусной ткани: морфогенез и регенерация
Из гормональных факторов в
Слайд 60Морфогенез - возникновение организованных
структур из неорганизованной массы клеток.
1) органогенез 2) соматический
эмбриогенез
прямой и непрямой
Морфогенный каллус
пшеницы
Слайд 61Морфогенез
Геммогенез – образование побегов.
Ризогенез – образование корней.
Морфогенная способность клона зависит от
Например, флоэмная ткань корня моркови дает начало корням, а ксилемная - формирует эмбриоиды.
Слайд 62Органогенез каллуса гипоксиса
Небольшая область делящихся клеток (meristemoids) или сосудистый узелок могут
Образование побегов (caulogenesis) (a) и корней (b & с) из каллуса Hypoxis
Слайд 634. Суспензионные культуры
Суспензионные культуры - отдельные клетки или группы клеток, выращиваемые
Представляют собой относительно гомогенную популяцию клеток, которую легко подвергнуть воздействию химических веществ.
Суспензионные культуры широко используются в качестве модельных систем для изучения путей вторичного метаболизма, индукции ферментов и экспрессии генов, деградации чужеродных соединений, цитологических исследований и др.
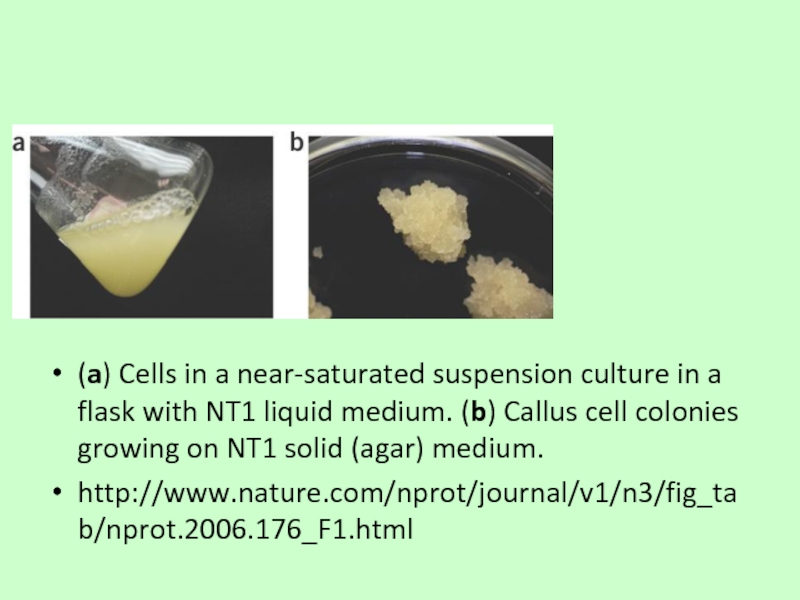
Слайд 64
(a) Cells in a near-saturated suspension culture in a flask with
http://www.nature.com/nprot/journal/v1/n3/fig_tab/nprot.2006.176_F1.html
Слайд 65Признаком "хорошей" линии служит способность клеток к перестройке метаболизма и высокая
Морфологические характеристики такой линии:
- высокая степень дезагрегации (5-10 клеток в группе);
- морфологическая выравненность клеток (небольшие размеры, сферическая или овальная форма, плотная цитоплазма);
- отсутствие трахеидоподобных элементов.
http://www.biotechnet.ch
Слайд 66Культура протопластов Arabidopsis thaliana и отдельные клетки
Arabidopsis thaliana (резушка Таля) -
http://coedb.wel.iwate-u.ac.jp/coe/gene/background.html
Слайд 67Получение суспензионной культуры
Клеточную суспензию получают, помещая рыхлую каллусную ткань в колбу
При первом переносе на свежую среду удаляют крупные кусочки исходного каллуса и крупные агрегаты, фильтруя через 1 - 2 слоя марли, нейлоновые сита, шприц с соответствующим отверстием.
Слайд 68Для инициализации суспензионной культуры необходимо 2 - 3 г свежей массы
Слайд 70Оценка роста суспензионных культур клеток
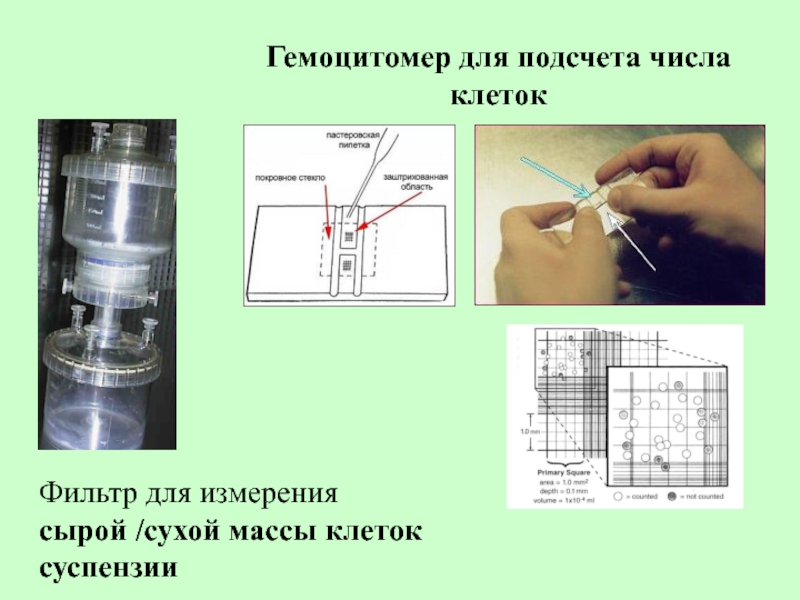
1. Объем осажденных клеток (ООК)
Переносят небольшой
2. Число клеток. Подсчитывается в камере Фукса-Розенталя.
Слайд 71Фильтр для измерения
сырой /сухой массы клеток суспензии
Гемоцитомер для подсчета числа
Слайд 723. Сырая и сухая масса
Суспензия клеток фильтруется через смоченный и
Сухая масса – определяется аналогично, но взвешивается сухой фильтр, а клетки сушат вместе с фильтром в термостате при 60оС до постоянной массы.
Слайд 734. Содержание белка
Для определения белка клетки собирают на фильтре из стекловолокна,
5. Проводимость среды
Определяют с помощью кондуктометра. Как правило, она обратно пропорциональна свежей массе клеток.
Слайд 746. Жизнеспособность клеток
Оценивают, изучая движение цитоплазмы под микроскопом, а также
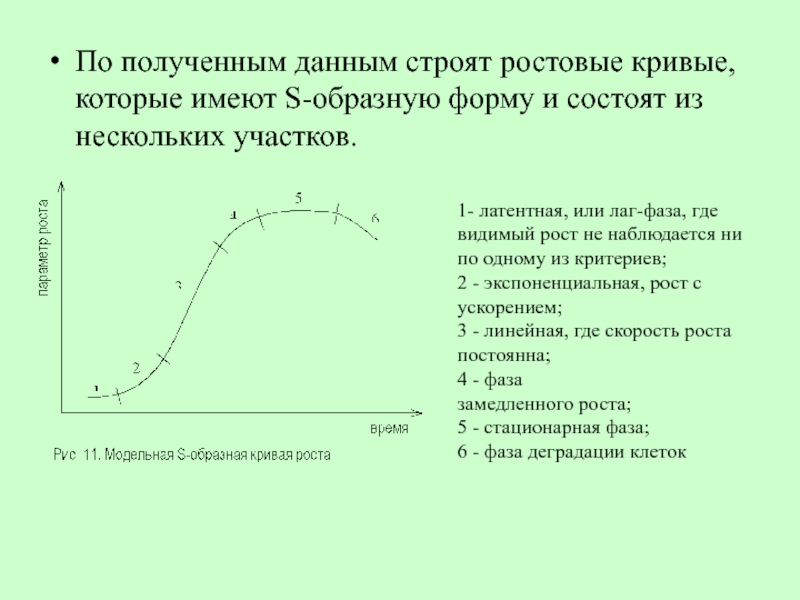
Слайд 75По полученным данным строят ростовые кривые, которые имеют S-образную форму и
1- латентная, или лаг-фаза, где видимый рост не наблюдается ни по одному из критериев;
2 - экспоненциальная, рост с ускорением;
3 - линейная, где скорость роста постоянна;
4 - фаза
замедленного роста;
5 - стационарная фаза;
6 - фаза деградации клеток
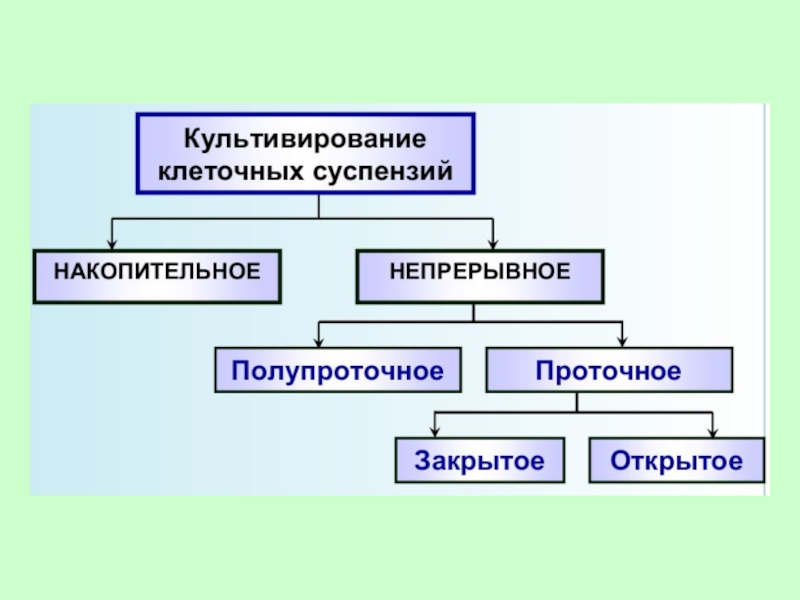
Слайд 77Различают два вида систем культивирования: открытую и закрытую.
Для закрытой системы характерен
Слайд 78
Открытые (проточные) культуры характеризуются поступлением свежей питательной среды, при котором отбирается
Наиболее изучено и распространено закрытое глубинное культивирование. Для аэрации и перешивания используют различную аппаратуру: роллеры, качалки, магнитные мешалки и т.д.
Слайд 81Ферментер Biostat D
BIOSTAT D-DCU– это производственно-масштабируемые пилотные ферментационные установки с культивационным
http://www.bbifermenter.ru/cms/index.php?id=40
Слайд 82Особенности культивирования растительных клеток
Чем крупнее становится клетка, тем больше возрастает опасность
Для культуры клеток женьшеня отрицательное влияние механического стресса при выращивании в ферментере с турбинными мешалками сказывалось на жизнеспособности клеток уже при скоростях мешалок свыше 100—350 об/мин, это отрицательно влияло на синтезе ими антрахинонов.
Слайд 83Мягкое перемешивание и аэрацию обеспечивает пневматический способ перемешивания потоком сжатого стерильного
От концентрации кислорода в среде зависят рост и вторичный метаболизм клеток. На рост клеток, могут влиять и другие газы. Например, углекислый газ может существенно влиять на длину лаг-фазы. Высокая степень аэрации может оказывать негативное действие на рост и синтез продуктов вторичного метаболизма, поскольку удаляются углекислый газ и летучие соединения.
Слайд 84
Сравнивали рост и образование метаболитов клетками в ферментерах разных типов. Клетки
Клетки барвинка розового (Catharantus roseus) также синтезировали больше индольных алкалоидов при культивировании в ферментере с продувкой воздуха, чем в биореакторах с механическим перемешиванием.
барвинок розовый
Слайд 85Отличительная особенность суспензионных культур клеток растений — высокая плотность, необходимая для
В верхней части сосуда постепенно может образовываться пена, состоящая из выделяемых клетками белков и полисахаридов. В процессе культивирования клетки слипаются и часть из них скапливается в этой пене, образуя «корку», или «безе». С увеличением биомассы клеток увеличивается и эта «корка», снижая интенсивность перемешивания, что может привести культуру к гибели.
Слайд 86Время генерации (интервал времени между двумя последовательными клеточными делениями) растительной клетки
Поддержание стерильности длительное время также является одной из технических проблем, особенно при непрерывном культивировании. Периодическое, или накопительное, культивирование — это самый простой способ выращивания клеток, являющийся пока традиционным.
Слайд 87Суспензионные культуры используют для промышленного получения вторичных метаболитов. Вещества, продуцируемые растительными
Применение суспензионных культур
Производство антоциана в суспензионной культуре
Слайд 88
В настоящее время в разных странах около ста видов растений используется
Корни женьшеня (Panax ginseng)
из суспензии
Суспензия клеток какао
(экспонециальная фаза и через 4 недели) http://www.scielo.org.co