- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по биологии на тему Биосинтез белка
Содержание
- 1. Презентация по биологии на тему Биосинтез белка
- 2. ПланНовообразование аминокислотМатричная теория биосинтеза белкаЭтапы биосинтезаПонятие о генетическом кодеРегуляция белкового синтеза
- 3. Новообразование аминокислот Новообразование аминокислот в природе возможно путем
- 4. Новообразование аминокислот Прямое аминирование непредельных кислот довольно редкая реакция характерная для бактерий и некоторых растенийАминирование фумаровой кислоты
- 5. Новообразование аминокислот Фумаровая кислота в организме образуется в
- 6. Новообразование аминокислот Другой кислотой подвергающийся активному восстановительному аминированию
- 7. Этапы биосинтезаСинтез белка протекает в 5 этаповАктивация аминокислотИнициация полипептидной цепиЭлонгацияТерминацияСворачивание (процессинг)
- 8. Активация аминокислот Этот этап протекает в цитоплазме. Каждая
- 9. Строение рибосом Рибосомы эукариот и прокариот отличаются друг
- 10. Инициация полипептидной цепи Этот этап является точкой отсчета
- 11. Инициация полипептидной цепи Имеются экспериментальные доказательства, что бактерии инициаторной аминоацил т-РНК являются формилметионин т-РНК
- 12. Инициация полипептидной цепи Инициация происходит при наличии трех
- 13. Инициация полипептидной цепи 30S субчастица с присоединенным комплексом
- 14. Инициация полипептидной цепи В результате образовалась 70S рибосома
- 15. Элонгация Этот процесс связан с большой субчастицей 50S
- 16. Элонгация Под действием фермента пептидил-трансферазы 1 аминокислота
- 17. (А)(П)Малая субчастицаБольшая субчастицаи-РНК
- 18. Терминация Завершение синтеза полипептидной цепи в 70S
- 19. (А)(П)Малая субчастицаБольшая субчастицаи-РНКУАГ
- 20. Сворачивание (процессинг) Чтобы принять биологическую форму, полипептид должен
- 21. Схема структуры белка
- 22. Понятие о генетическом коде Генетический код – это
- 23. Слайд 23
- 24. Понятие о генетическом коде Природа триплетного кода была
- 25. Понятие о генетическом коде Свойства генетического кодаТриплетность –
- 26. Регуляция синтеза белка Механизм регуляции генетического кода был
- 27. Регуляция синтеза белка Механизм индукции-репрессии обеспечивает включение в
- 28. Регуляция биосинтеза белка Раскрытие механизма регуляции генетического кода
ПланНовообразование аминокислотМатричная теория биосинтеза белкаЭтапы биосинтезаПонятие о генетическом кодеРегуляция белкового синтеза
Слайд 2План
Новообразование аминокислот
Матричная теория биосинтеза белка
Этапы биосинтеза
Понятие о генетическом коде
Регуляция белкового синтеза
Слайд 3Новообразование аминокислот
Новообразование аминокислот в природе возможно путем переаминирования с кетокислотами и
превращениями одних аминокислот в другие, но в обоих случаях их продуктом служат готовые аминокислоты, которые тем или иным способом видоизменяются, т.е. получаются путем вторичного синтеза их предшествующих аминокислот.
Первичный синтез аминокислоты осуществляется восстановительным аминированием кетокислот и прямым аминированием непредельных кислот
Первичный синтез аминокислоты осуществляется восстановительным аминированием кетокислот и прямым аминированием непредельных кислот
Слайд 4Новообразование аминокислот
Прямое аминирование непредельных кислот довольно редкая реакция характерная для бактерий
и некоторых растений
Аминирование фумаровой кислоты
Аминирование фумаровой кислоты
Слайд 5Новообразование аминокислот
Фумаровая кислота в организме образуется в результате синтеза мочевины или
в цикле Кребса.
Восстановительное аминирование для кетокислот.
Восстановительное аминирование для кетокислот.
Слайд 6Новообразование аминокислот
Другой кислотой подвергающийся активному восстановительному аминированию является ПВК
Аспаргиновая, глутаровая кислоты
и аланин называют первичными аминокислотами, а все остальные вторичные, т.к. они могут быть получены из первичных в результате биохимических реакций.
Слайд 7
Этапы биосинтеза
Синтез белка протекает в 5 этапов
Активация аминокислот
Инициация полипептидной цепи
Элонгация
Терминация
Сворачивание (процессинг)
Слайд 8Активация аминокислот
Этот этап протекает в цитоплазме. Каждая из 20 аминокислот ковалентно
присоединяется к определенной транспортной РНК используя для этого энергию АТФ. Активация аминокислот происходит под действием специфичных ферментов аминоацилт-РНКсинтетаза. Это процесс протекает в 2 стадии.
Слайд 9Строение рибосом
Рибосомы эукариот и прокариот отличаются друг от друга. Любая рибосома
состоит из 2-х частиц малой и большой. Рибосома прокариот имеет обозначение 70S она состоит из большой 50S и малой 30S. Рибосомы эукариот обозначаются 80S и состоит из большой 60S и малой 40S.
Слайд 10Инициация полипептидной цепи
Этот этап является точкой отсчета биосинтеза белка. Он требует
соблюдения ряда условий. В частности:
Наличие в системе 70S или 80S рибосом
Инициаторной аминоацил т-РНК
Инициирующих кодонов в составе матричной РНК
Белковых факторов инициации
Наличие в системе 70S или 80S рибосом
Инициаторной аминоацил т-РНК
Инициирующих кодонов в составе матричной РНК
Белковых факторов инициации
Слайд 11Инициация полипептидной цепи
Имеются экспериментальные доказательства, что бактерии инициаторной аминоацил т-РНК являются
формилметионин т-РНК
Слайд 12Инициация полипептидной цепи
Инициация происходит при наличии трех белковых факторов инициации: IF1,
IF2, IF3.
30S субчастицы рибосомы присоединяются белковый фактор IF3. Он готовит ее к присоединению комплекса состоящего из формилметионин т-РНК, IF1, IF2, ГТФ.
30S субчастицы рибосомы присоединяются белковый фактор IF3. Он готовит ее к присоединению комплекса состоящего из формилметионин т-РНК, IF1, IF2, ГТФ.
30S субчастица
IF3
Слайд 13Инициация полипептидной цепи
30S субчастица с присоединенным комплексом располагается на определенном участке
и-РНК, а белковый фактор IF3 покидает сферу реакции.
К ним приближается 50S субчастица, а белковый фактор IF1 покидает сферу реакции.
К ним приближается 50S субчастица, а белковый фактор IF1 покидает сферу реакции.
30S субчастица
IF3
IF1
Формил-
Метионин
т-РНК
IF2
ГТФ
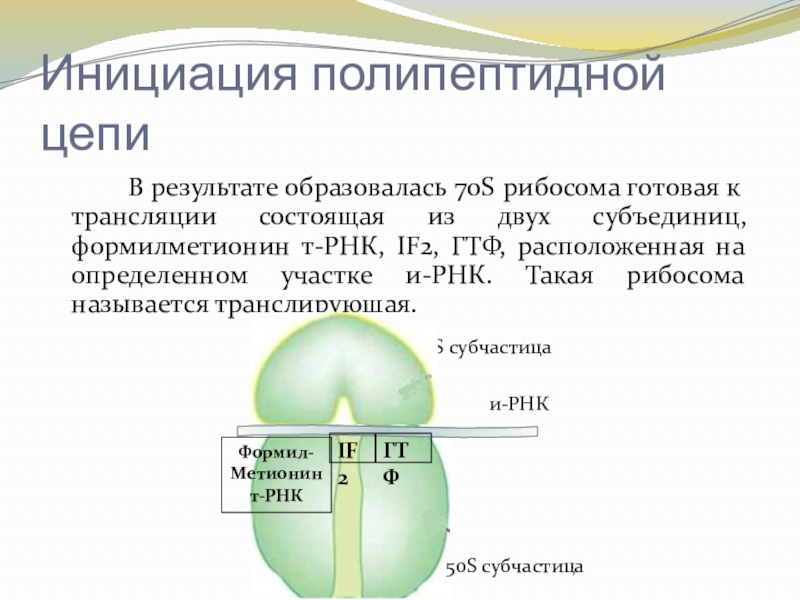
Слайд 14Инициация полипептидной цепи
В результате образовалась 70S рибосома готовая к трансляции состоящая
из двух субъединиц, формилметионин т-РНК, IF2, ГТФ, расположенная на определенном участке и-РНК. Такая рибосома называется транслирующая.
30S субчастица
Формил-
Метионин
т-РНК
IF2
ГТФ
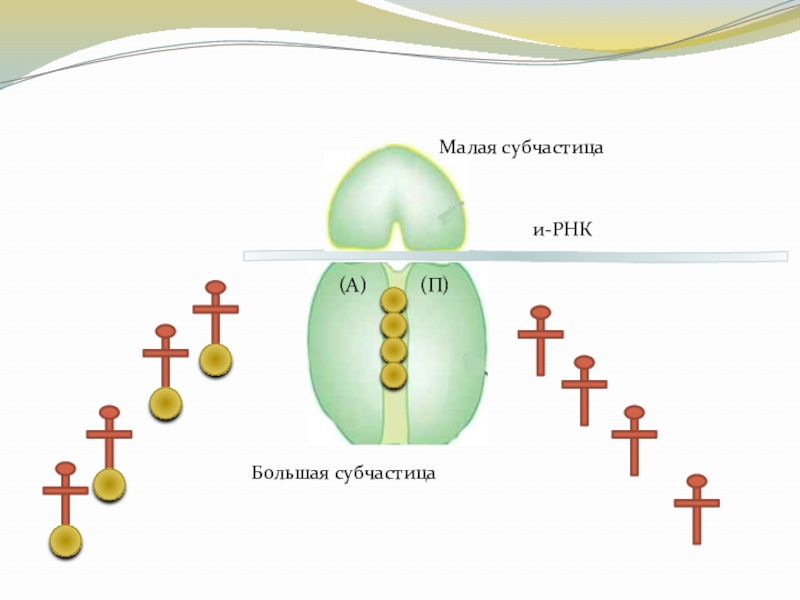
Слайд 15Элонгация
Этот процесс связан с большой субчастицей 50S рибосомы содержащей 2 центра
аминоацильный и пептидильный. В пептидильном (П) центре находится формилметионин т-РНК, а аминоацильный (А) центр свободен. К (А) подходит т-РНК с новой аминокислотой. Если кодон и-РНК соответствует антикодону т-РНК (по принципу комплеминтарности), то аминокислота остается в центре. Под действием IF2 ГТФ расщепляется и выделившейся энергии достаточно для передвижения рибосомы на 1 триплет по и-РНК
Слайд 16Элонгация
Под действием фермента пептидил-трансферазы 1 аминокислота соединяется мо 2-й аминокислотой
и образуется дипептид. А под влиянием фермента пептидилтранслоказа рибосома перемещается на 1 триплет , а образо-вавшийся дипептид снова оказывается на (П), а (А) свободен. Таким образом на стадии элонгации происходит наращивание полипептидной цепи по 1 аминокислоте в строгом соответствии с порядком триплета или кодонов в молекуле м – РНК.
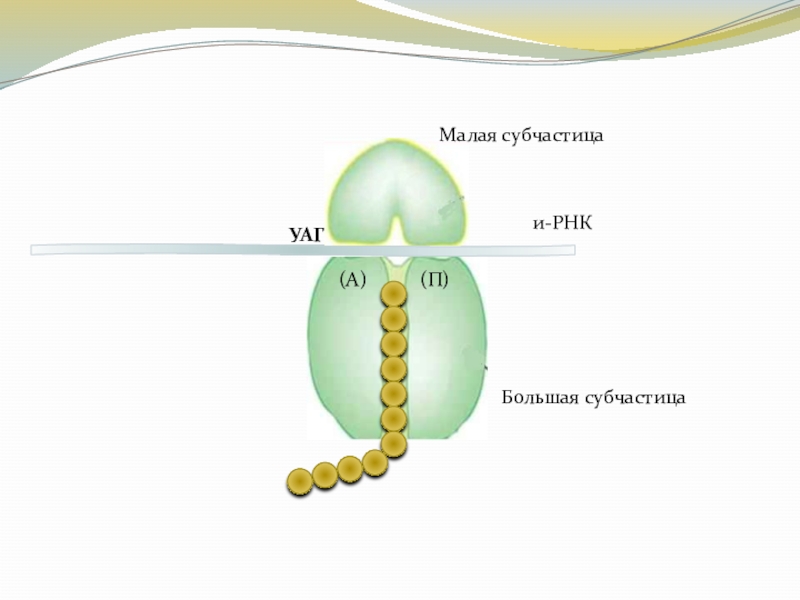
Слайд 18Терминация
Завершение синтеза полипептидной цепи в 70S рибосоме наступает тогда, когда
встречаются в и-РНК бессмысленные кодоны (стоп - кодоны): УАГ, УАА, УГА.
В результате терминации происходит отделение белковой молекулы от рибосомы. 70S рибосома распадается на 2 субчастицы, которые вновь могут быть использованы для биосинтеза.
В результате терминации происходит отделение белковой молекулы от рибосомы. 70S рибосома распадается на 2 субчастицы, которые вновь могут быть использованы для биосинтеза.
Слайд 20Сворачивание (процессинг)
Чтобы принять биологическую форму, полипептид должен свернуться, образуя определенную пространственную
конформацию.
Процессинг осуществляемый ферментами заключается в следующем:
Удаление инициирующих аминокислот
Удаление лишних аминокислотных остатков
Присоединение простетических групп
Процессинг – ковалентная модификация.
Процессинг осуществляемый ферментами заключается в следующем:
Удаление инициирующих аминокислот
Удаление лишних аминокислотных остатков
Присоединение простетических групп
Процессинг – ковалентная модификация.
Слайд 22Понятие о генетическом коде
Генетический код – это система зашифровки генетической информации
в молекуле ДНК в виде последовательности размещения нуклеотидов.
Наследственная информация в молекуле ДНК записывается 4 нуклеотидами (А,Г, Т, Ц), а в молекуле белка таких «букв» 20. получается что для кодирования аминокислоты необходимо более одного основания. Одну аминокислоту кодируют три азотистых основания.
Наследственная информация в молекуле ДНК записывается 4 нуклеотидами (А,Г, Т, Ц), а в молекуле белка таких «букв» 20. получается что для кодирования аминокислоты необходимо более одного основания. Одну аминокислоту кодируют три азотистых основания.
Слайд 24Понятие о генетическом коде
Природа триплетного кода была расшифрована в 1961 году
М. Ниренбергом. Он расшифровал УУУ. В 1962 году С. Очоа расшифровала остальные триплеты.
Слайд 25Понятие о генетическом коде
Свойства генетического кода
Триплетность – каждой аминокислоте соответствует свой
триплет
Неперекрываемость каждый из триплетов генетического кода независим друг от друга
Вырожденность – каждой аминокислоте соответствует только определенные кодоны, которые не могут используются для другой аминокислоты.
Коллиниарность – соответствие линейной последовательности кодонов матричной РНК и аминокислот в белке.
Универсальность – все свойства генетического кода характерны для живых организмов
Неперекрываемость каждый из триплетов генетического кода независим друг от друга
Вырожденность – каждой аминокислоте соответствует только определенные кодоны, которые не могут используются для другой аминокислоты.
Коллиниарность – соответствие линейной последовательности кодонов матричной РНК и аминокислот в белке.
Универсальность – все свойства генетического кода характерны для живых организмов
Слайд 26Регуляция синтеза белка
Механизм регуляции генетического кода был открыт французскими учеными Ф.
Жакобом и Ж. Моно в 1961 г. на бактериях и получил название механизма индукции-репрессии. Было установлено, что синтез соответствующих белков – ферментов – индуцируется веществом, служащим субстратом и необходимым для нормальной жизнедеятельности клетки.
Слайд 27Регуляция синтеза белка
Механизм индукции-репрессии обеспечивает включение в работу тех генов, которые
синтезируют необходимые на данном этапе жизнедеятельности клетки ферменты. Работа генов прекращается, когда деградируемый данными ферментами субстрат израсходован или когда синтезируемое данными ферментами вещество находится в избытке. У высших организмов процесс регуляции работы генов осуществляется более сложно: у животных важную роль в этом процессе играют гормоны, клеточные мембраны; у растений - условия внешней среды, в том числе и окружающие клетки.
Слайд 28Регуляция биосинтеза белка
Раскрытие механизма регуляции генетического кода показало сложное строение локализованного
в молекуле ДНК генетического аппарата. Гены, непосредственно кодирующие синтез соответствующих ферментов, называют структурными генами. Они входят в состав оперона, работу которого регулирует ген-регулятор. Как правило, структурные гены в опероне находятся в состоянии репрессии. Ген-регулятор расположен на особом участке молекулы ДНК и кодирует синтез специального белка, называемого репрессором. Работой структурных генов управляют находящиеся в опероне гены, не имеющие кодирующих функций. Их называют акцепторными генами. Система акцепторных и структурных генов образует единицу генетической регуляции, или оперон.