структура белка
4. Вторичная структура белков
5. Супервторичная структура белков
6. Третичная структура белков. Фолдинг. Шапероны
7. Четвертичная структура белков
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по биологии на тему Белки 9 класс
Содержание
- 1. Презентация по биологии на тему Белки 9 класс
- 2. Строение аминокислот
- 3. Производные аминокислотВ некоторых белках обнаружены производные аминокислот:
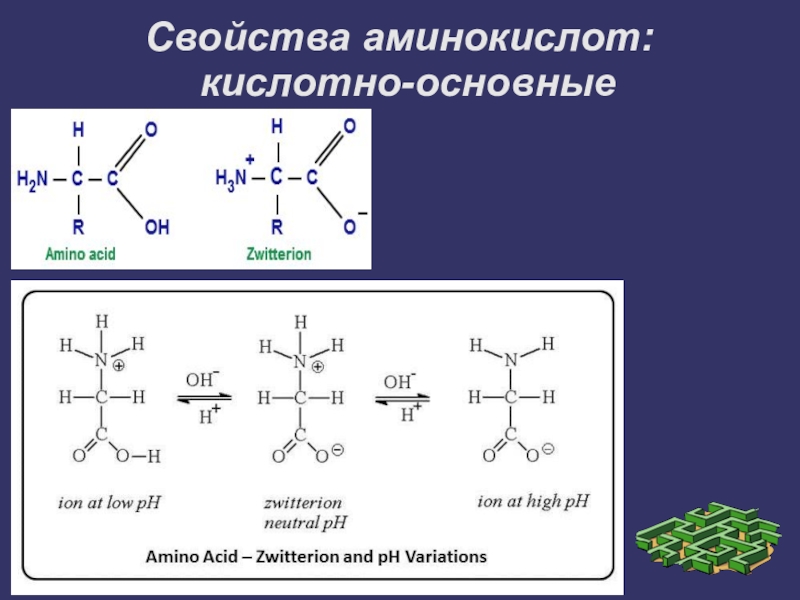
- 4. Свойства аминокислот: кислотно-основные
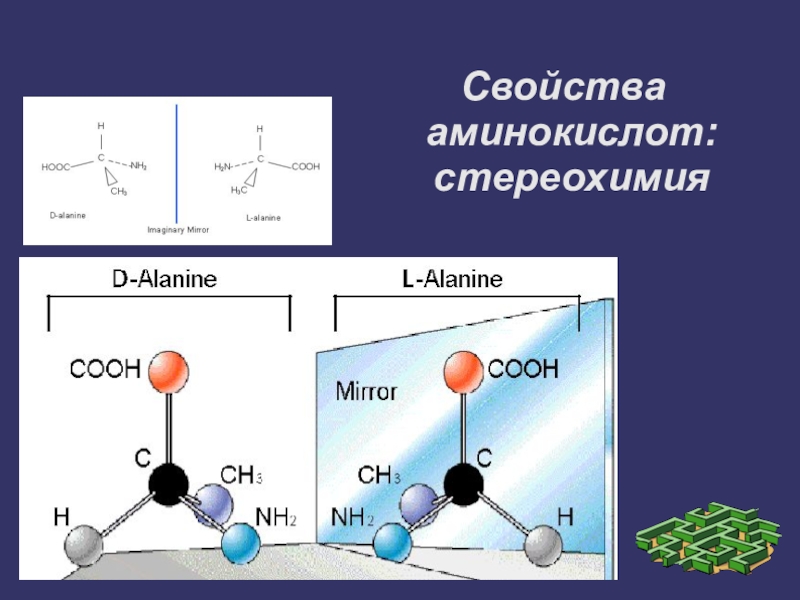
- 5. Свойства аминокислот: стереохимия
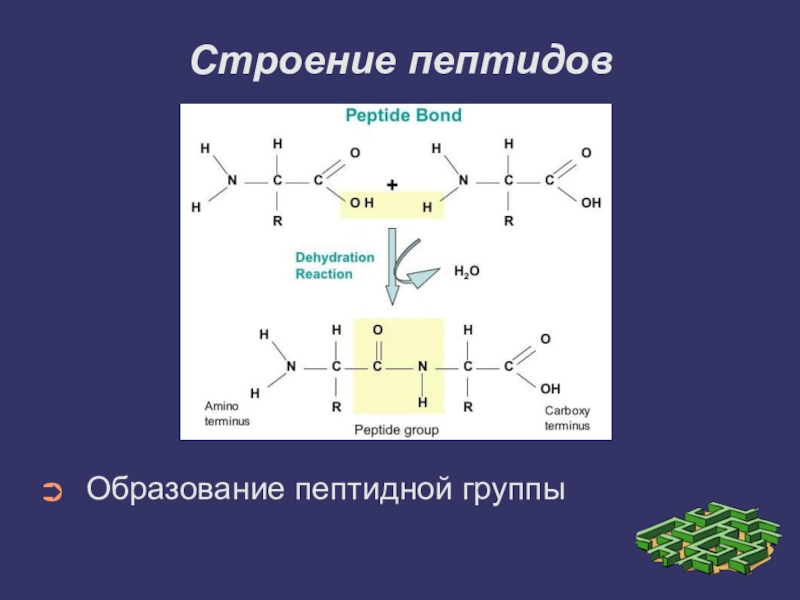
- 6. Строение пептидовОбразование пептидной группы
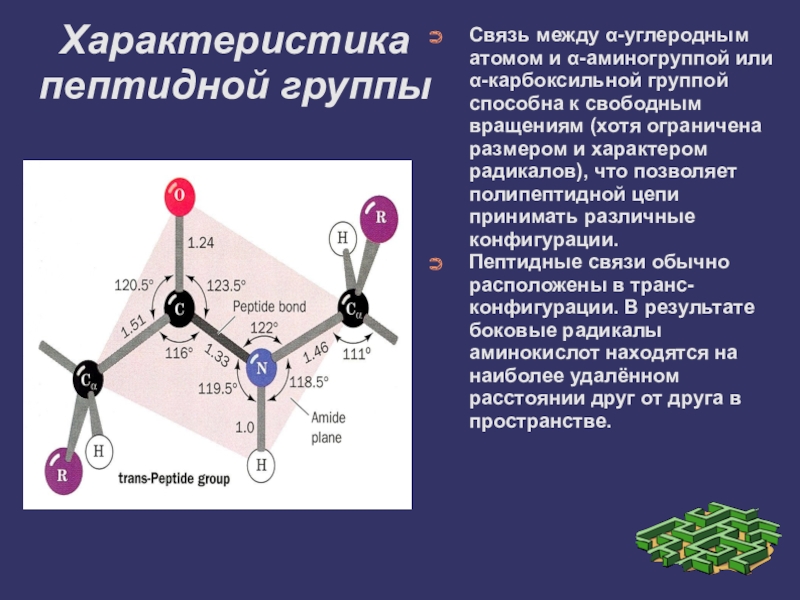
- 7. Характеристика пептидной группыСвязь между α-углеродным атомом и
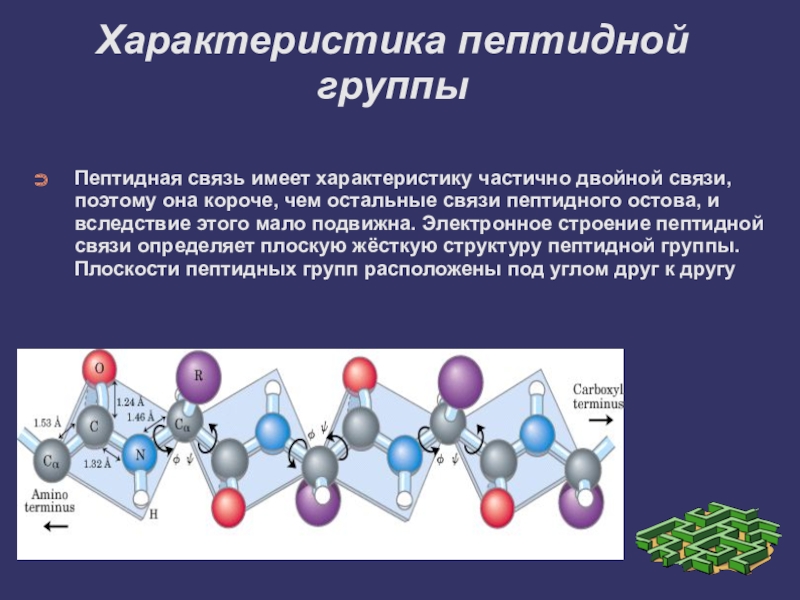
- 8. Характеристика пептидной группыПептидная связь имеет характеристику частично
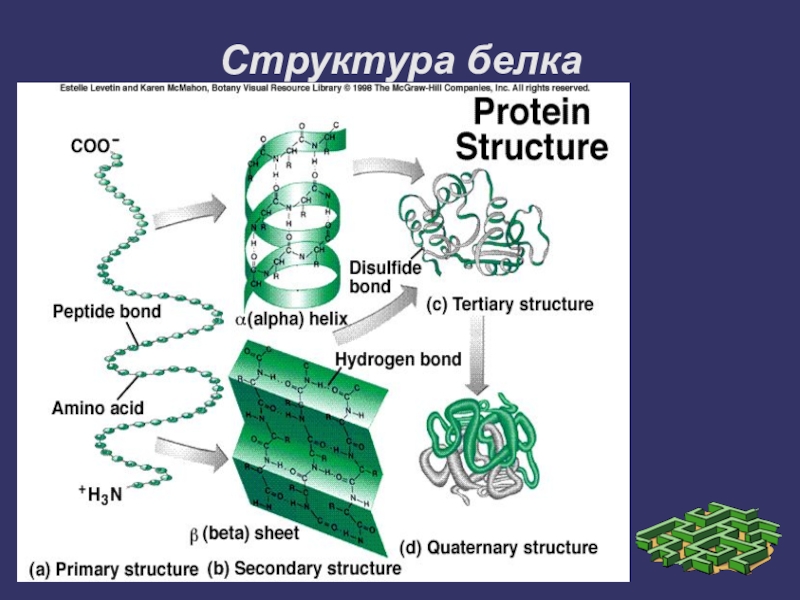
- 9. Структура белка
- 10. Первичная структура белкаПервичная структура белка - это
- 11. Вторичная структура белкаОбозначьте альтернативные стратегииОпишите “за” и “против” каждой стратегииПредоставьте прогноз затрат
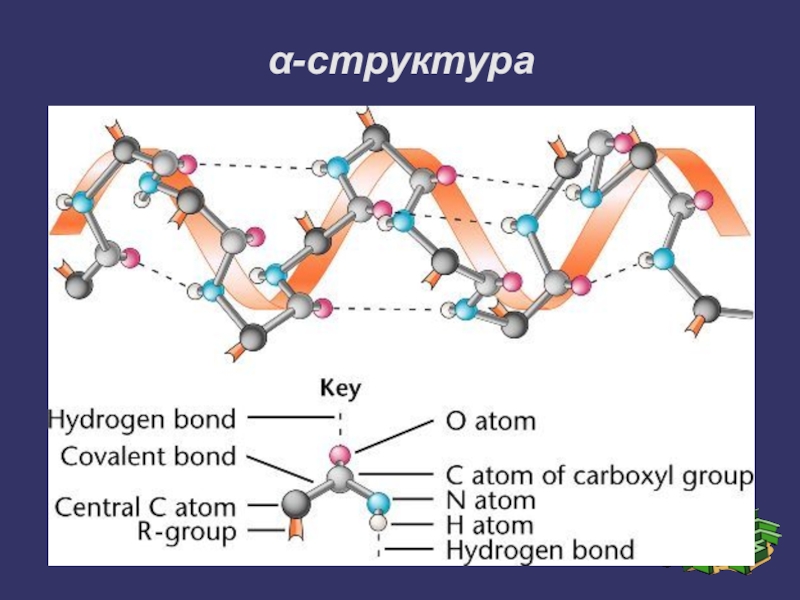
- 12. α-структура
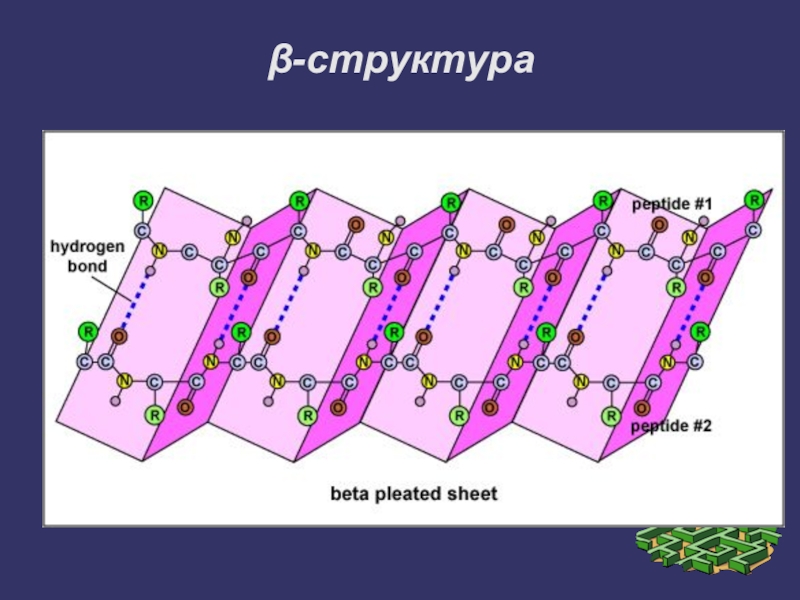
- 13. β-структура
- 14. Супервторичные структурыПредложите одну или несколько стратегийДайте обзор ожидаемых результатовОбозначьте дальнейшие шагиРаспределите различные задачи
- 15. Супервторичные структуры1. Супервторичная структура типа α/β-бочонка2. Структурный мотив
- 16. Спираль-поворот-спиральДвухспиральная структура ДНК имеет две бороздки -
- 17. Цинковые пальцы
- 18. Цинковые пальцыДва близко лежащих остатка цистеина отделены
- 19. Лейциновая молнияНа поверхности каждой из двух белков
- 20. Третичная структураТретичная структура белков - трёхмерная пространственная
- 21. Третичная структура
- 22. Роль шаперонов в трансляцииПри синтезе белков N-концевая
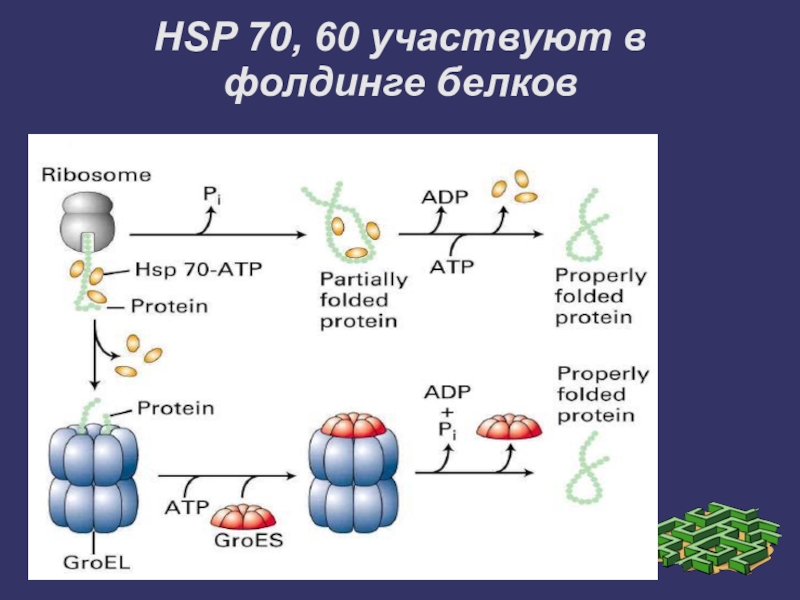
- 23. HSP 70, 60 участвуют в фолдинге белков
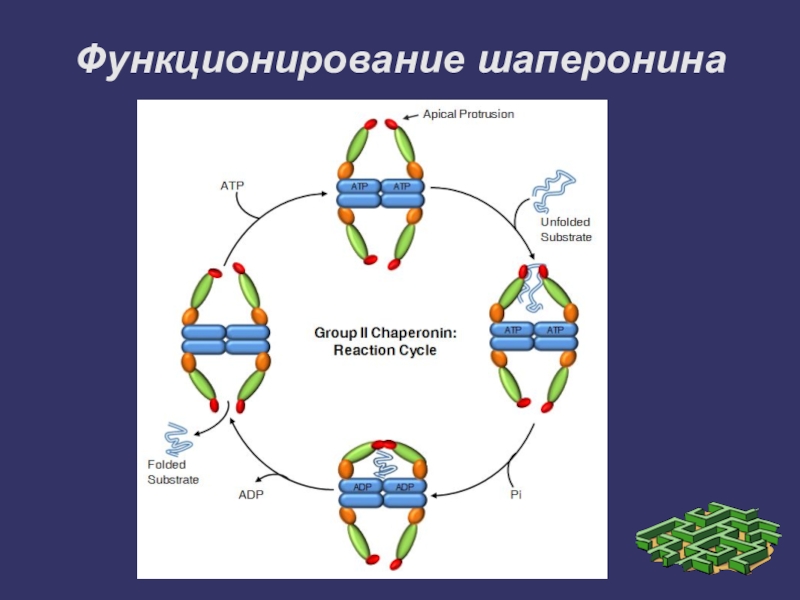
- 24. Функционирование шаперонина
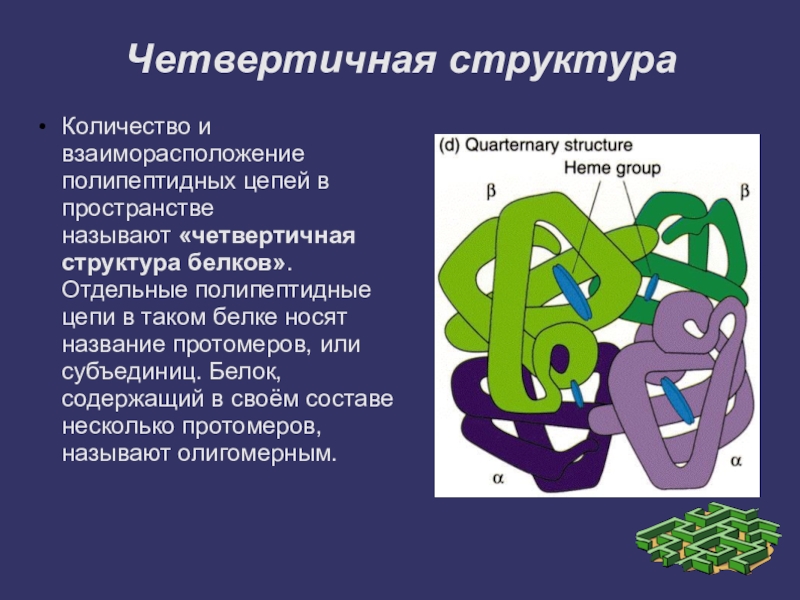
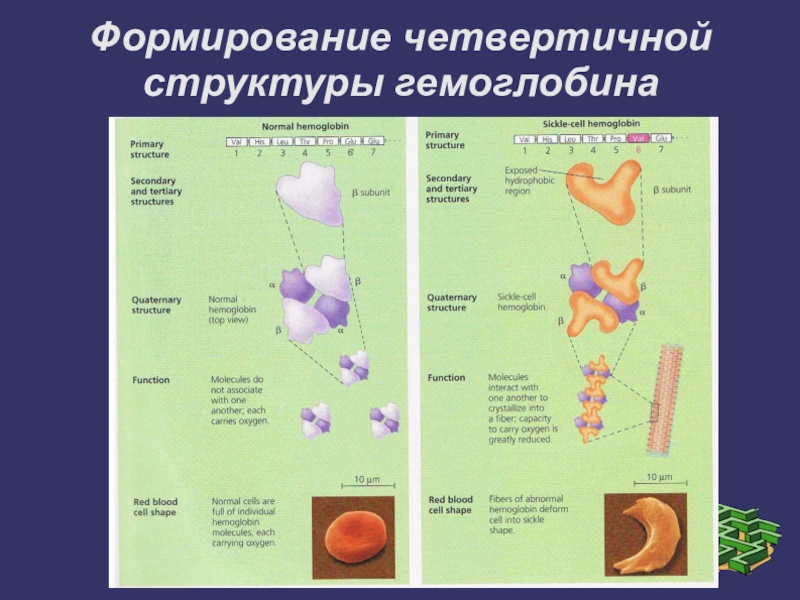
- 25. Четвертичная структураКоличество и взаиморасположение полипептидных цепей в
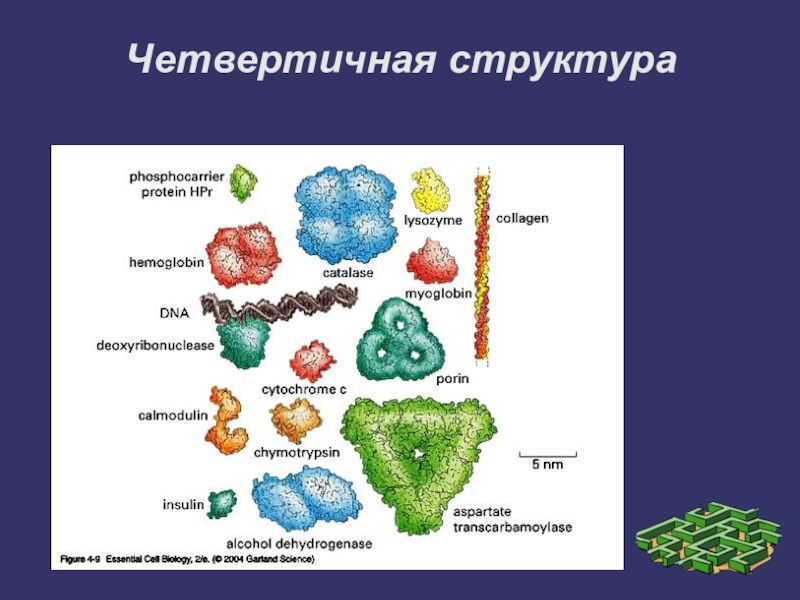
- 26. Четвертичная структура
- 27. Формирование четвертичной структуры гемоглобина
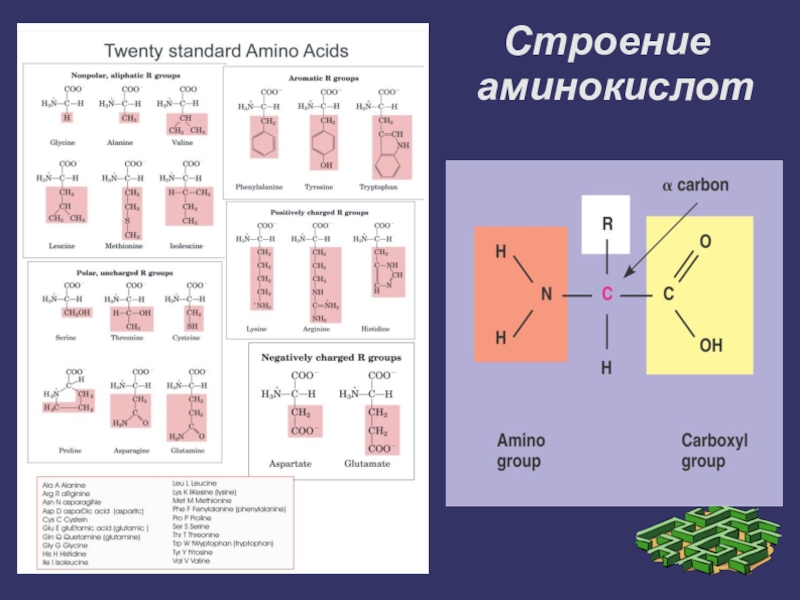
Строение аминокислот
Слайд 1Молекулярная биология белков
Вопросы
1. Аминокислотный состав белков
2. Строение и свойства пептидов
3. Первичная
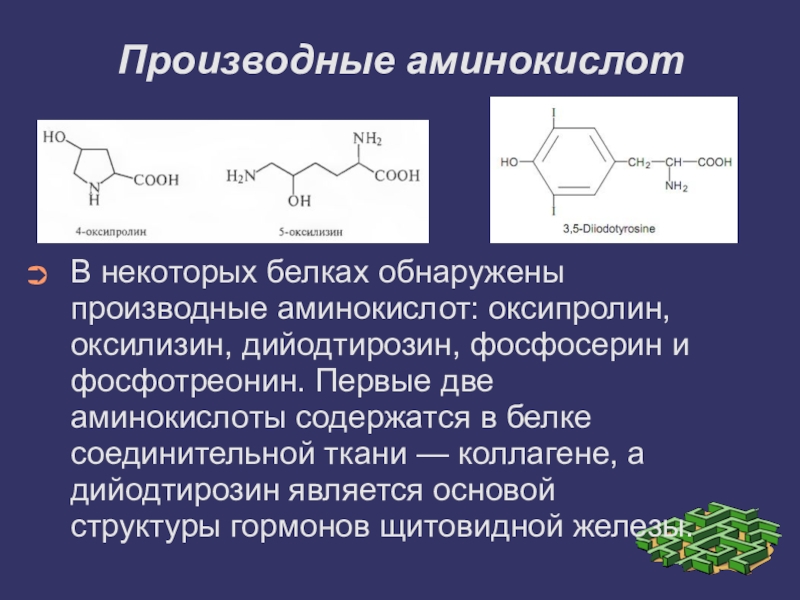
Слайд 3Производные аминокислот
В некоторых белках обнаружены производные аминокислот: оксипролин, оксилизин, дийодтирозин, фосфосерин
и фосфотреонин. Первые две аминокислоты содержатся в белке соединительной ткани — коллагене, а дийодтирозин является основой структуры гормонов щитовидной железы.
Слайд 7Характеристика пептидной группы
Связь между α-углеродным атомом и α-аминогруппой или α-карбоксильной группой
способна к свободным вращениям (хотя ограничена размером и характером радикалов), что позволяет полипептидной цепи принимать различные конфигурации.
Пептидные связи обычно расположены в транс-конфигурации. В результате боковые радикалы аминокислот находятся на наиболее удалённом расстоянии друг от друга в пространстве.
Пептидные связи обычно расположены в транс-конфигурации. В результате боковые радикалы аминокислот находятся на наиболее удалённом расстоянии друг от друга в пространстве.
Слайд 8Характеристика пептидной группы
Пептидная связь имеет характеристику частично двойной связи, поэтому она
короче, чем остальные связи пептидного остова, и вследствие этого мало подвижна. Электронное строение пептидной связи определяет плоскую жёсткую структуру пептидной группы. Плоскости пептидных групп расположены под углом друг к другу
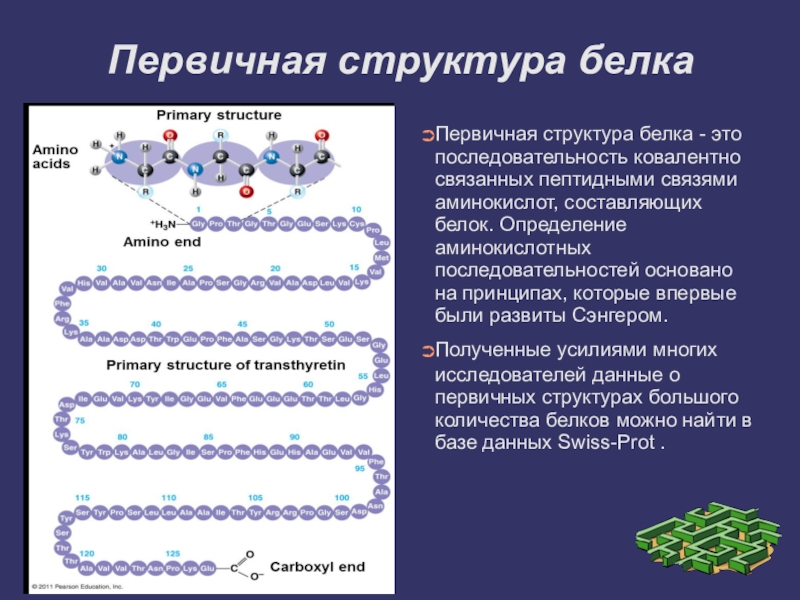
Слайд 10Первичная структура белка
Первичная структура белка - это последовательность ковалентно связанных пептидными
связями аминокислот, составляющих белок. Определение аминокислотных последовательностей основано на принципах, которые впервые были развиты Сэнгером.
Полученные усилиями многих исследователей данные о первичных структурах большого количества белков можно найти в базе данных Swiss-Prot .
Полученные усилиями многих исследователей данные о первичных структурах большого количества белков можно найти в базе данных Swiss-Prot .
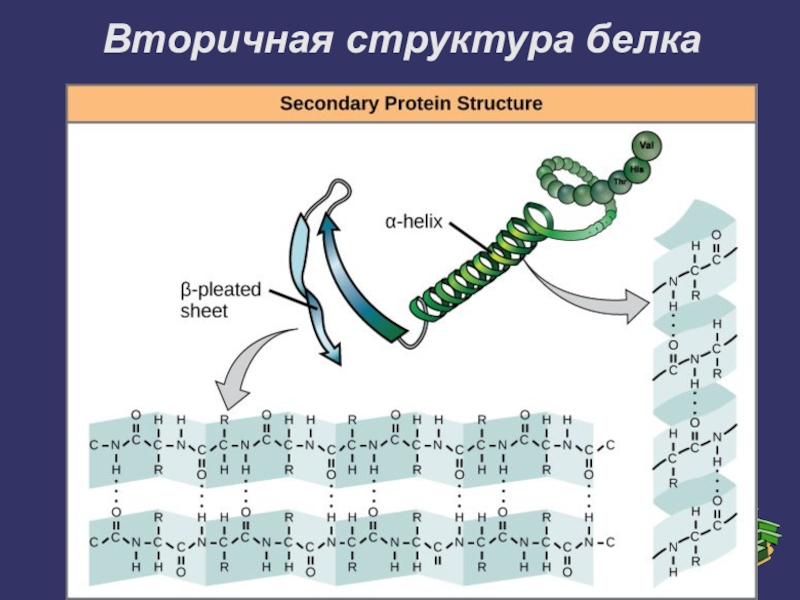
Слайд 11Вторичная структура белка
Обозначьте альтернативные стратегии
Опишите “за” и “против” каждой стратегии
Предоставьте прогноз
затрат
Слайд 14Супервторичные структуры
Предложите одну или несколько стратегий
Дайте обзор ожидаемых результатов
Обозначьте дальнейшие шаги
Распределите
различные задачи
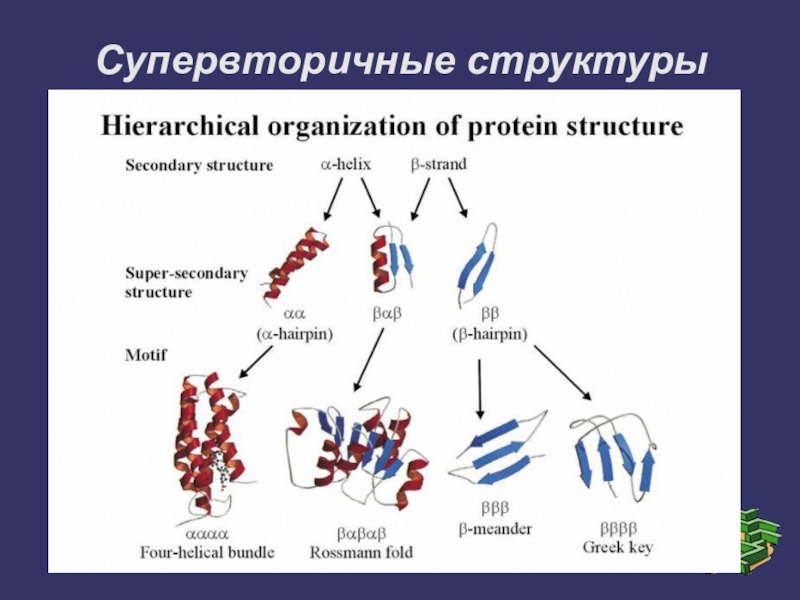
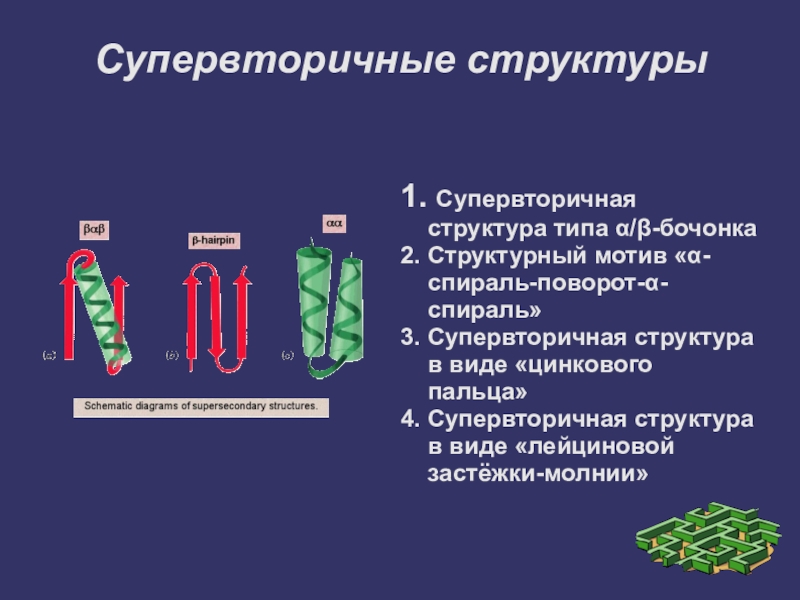
Слайд 15Супервторичные структуры
1. Супервторичная структура типа α/β-бочонка
2. Структурный мотив «α-спираль-поворот-α-спираль»
3. Супервторичная структура в виде
«цинкового пальца»
4. Супервторичная структура в виде «лейциновой застёжки-молнии»
4. Супервторичная структура в виде «лейциновой застёжки-молнии»
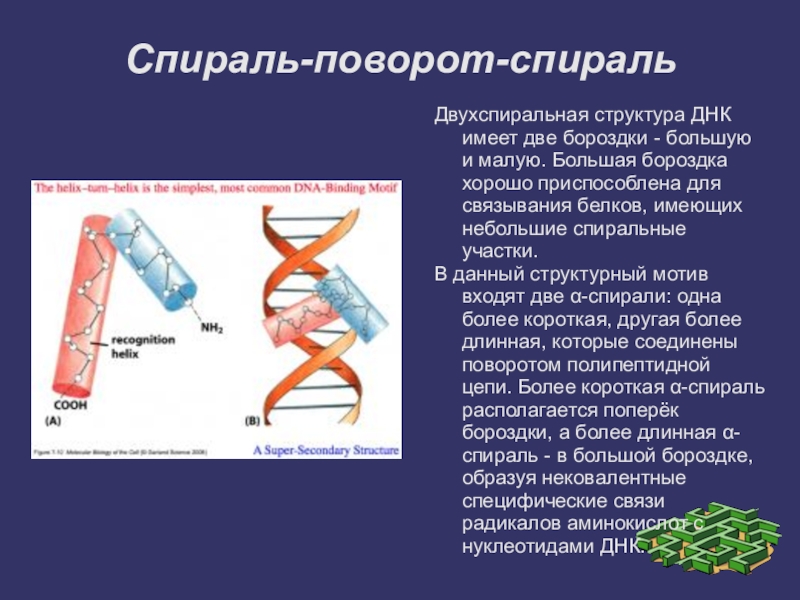
Слайд 16Спираль-поворот-спираль
Двухспиральная структура ДНК имеет две бороздки - большую и малую. Большая
бороздка хорошо приспособлена для связывания белков, имеющих небольшие спиральные участки.
В данный структурный мотив входят две α-спирали: одна более короткая, другая более длинная, которые соединены поворотом полипептидной цепи. Более короткая α-спираль располагается поперёк бороздки, а более длинная α-спираль - в большой бороздке, образуя нековалентные специфические связи радикалов аминокислот с нуклеотидами ДНК.
В данный структурный мотив входят две α-спирали: одна более короткая, другая более длинная, которые соединены поворотом полипептидной цепи. Более короткая α-спираль располагается поперёк бороздки, а более длинная α-спираль - в большой бороздке, образуя нековалентные специфические связи радикалов аминокислот с нуклеотидами ДНК.
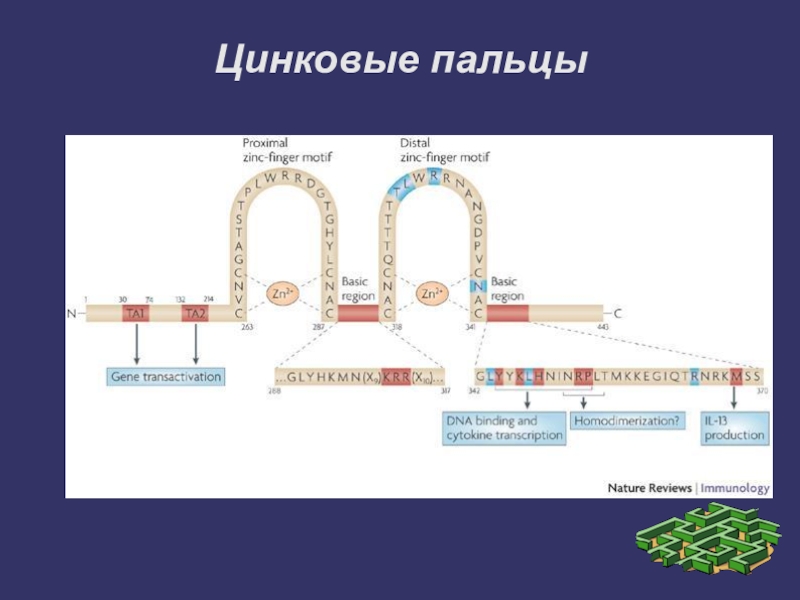
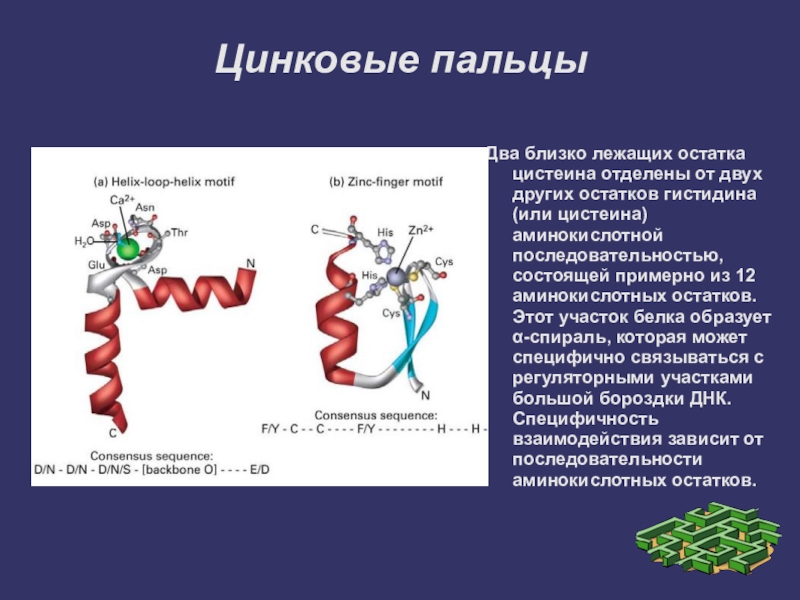
Слайд 18Цинковые пальцы
Два близко лежащих остатка цистеина отделены от двух других остатков
гистидина (или цистеина) аминокислотной последовательностью, состоящей примерно из 12 аминокислотных остатков. Этот участок белка образует α-спираль, которая может специфично связываться с регуляторными участками большой бороздки ДНК. Специфичность взаимодействия зависит от последовательности аминокислотных остатков.
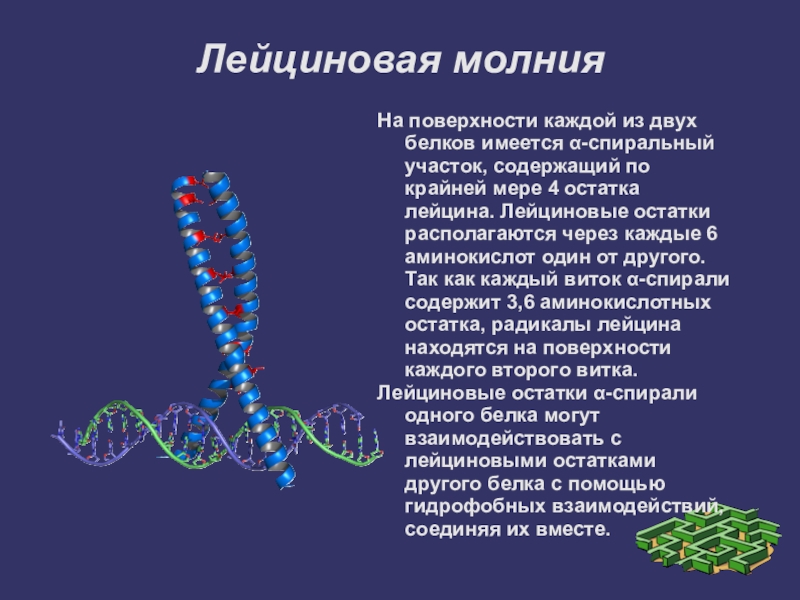
Слайд 19Лейциновая молния
На поверхности каждой из двух белков имеется α-спиральный участок, содержащий
по крайней мере 4 остатка лейцина. Лейциновые остатки располагаются через каждые 6 аминокислот один от другого. Так как каждый виток α-спирали содержит 3,6 аминокислотных остатка, радикалы лейцина находятся на поверхности каждого второго витка.
Лейциновые остатки α-спирали одного белка могут взаимодействовать с лейциновыми остатками другого белка с помощью гидрофобных взаимодействий, соединяя их вместе.
Лейциновые остатки α-спирали одного белка могут взаимодействовать с лейциновыми остатками другого белка с помощью гидрофобных взаимодействий, соединяя их вместе.
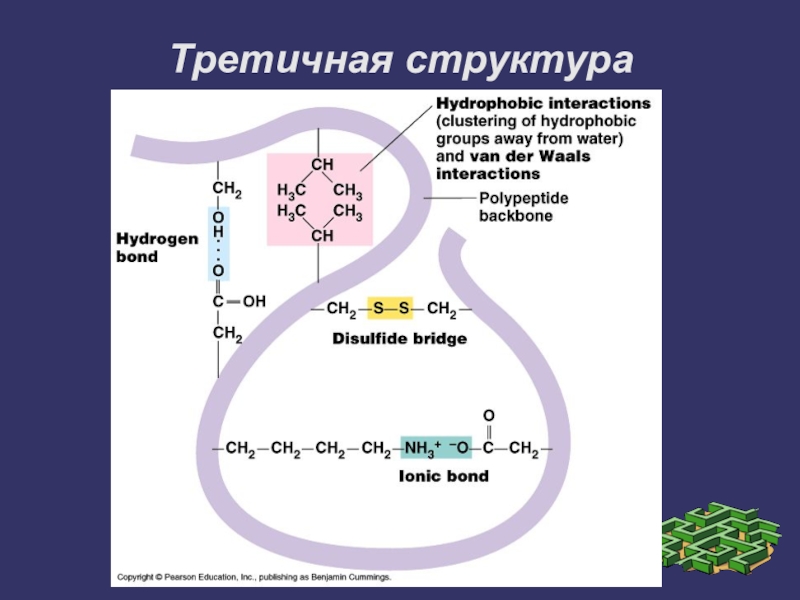
Слайд 20Третичная структура
Третичная структура белков - трёхмерная пространственная структура, образующаяся за счёт
взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи.
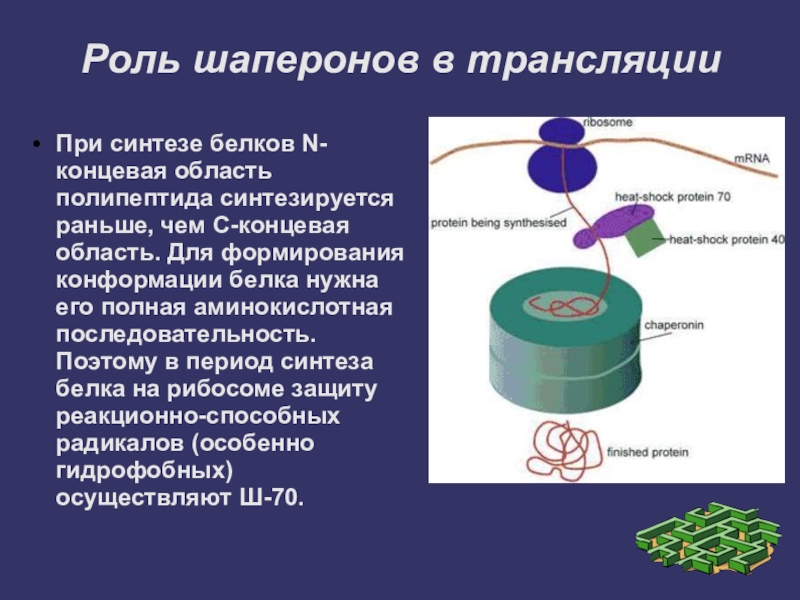
Слайд 22Роль шаперонов в трансляции
При синтезе белков N-концевая область полипептида синтезируется раньше,
чем С-концевая область. Для формирования конформации белка нужна его полная аминокислотная последовательность. Поэтому в период синтеза белка на рибосоме защиту реакционно-способных радикалов (особенно гидрофобных) осуществляют Ш-70.
Слайд 25Четвертичная структура
Количество и взаиморасположение полипептидных цепей в пространстве называют «четвертичная структура белков».
Отдельные полипептидные цепи в таком белке носят название протомеров, или субъединиц. Белок, содержащий в своём составе несколько протомеров, называют олигомерным.