- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по биологии и химии на тему Белки (10 класс)
Содержание
- 1. Презентация по биологии и химии на тему Белки (10 класс)
- 2. «Жизнь – есть способ существования белковых тел,
- 3. Цель урока: расширить и углубить представления
- 4. Слайд 4
- 5. Свое название белки получили от
- 6. Однако, в отдельный класс
- 7. Голландский химик Геррит Мульдер определил продукты разрушения
- 8. Термин «протеин» для обозначения подобных молекул былпредложен
- 9. В 1894 году немецкий физиолог Альбрехт Коссель
- 10. Немецкий химик Эмиль Фишер –
- 11. В 1888г. – один из основоположников отечественной
- 12. Джеймс Самнер (американский химик) экспериментально доказал, что
- 13. Первым ученым, который смог успешно предсказать вторичную
- 14. Определение аминокислотной последовательности первого белка
- 15. Первые трёхмерные структуры белков гемоглобина и миоглобина
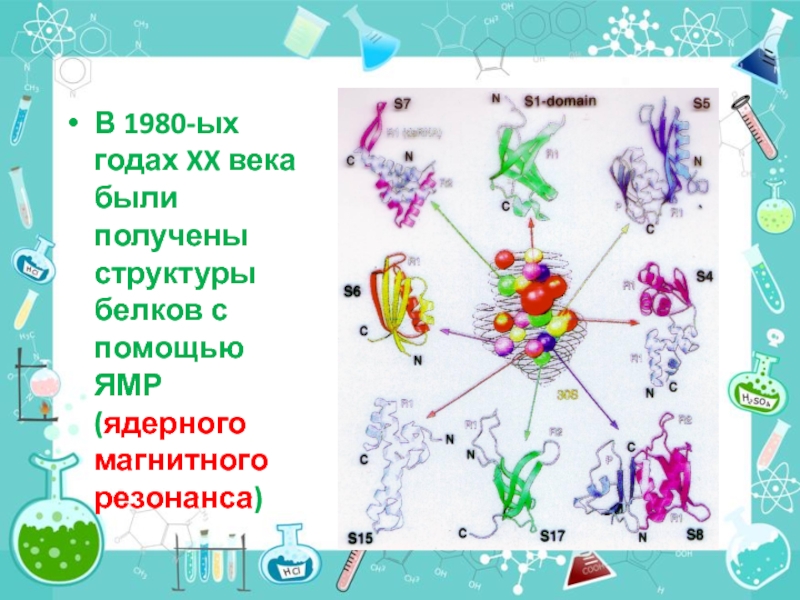
- 16. В 1980-ых годах XX века были получены структуры белков с помощью ЯМР (ядерного магнитного резонанса)
- 17. В последние годы в образовании белков достигнуты
- 18. Кроме того, одна из главных задач органической
- 19. В нашей стране в этом направлении работал
- 20. В настоящее время Банк
- 21. Элементный состав белков
- 22. Состав белковуглерод – 50-55%,кислород – 21-24%,азот –
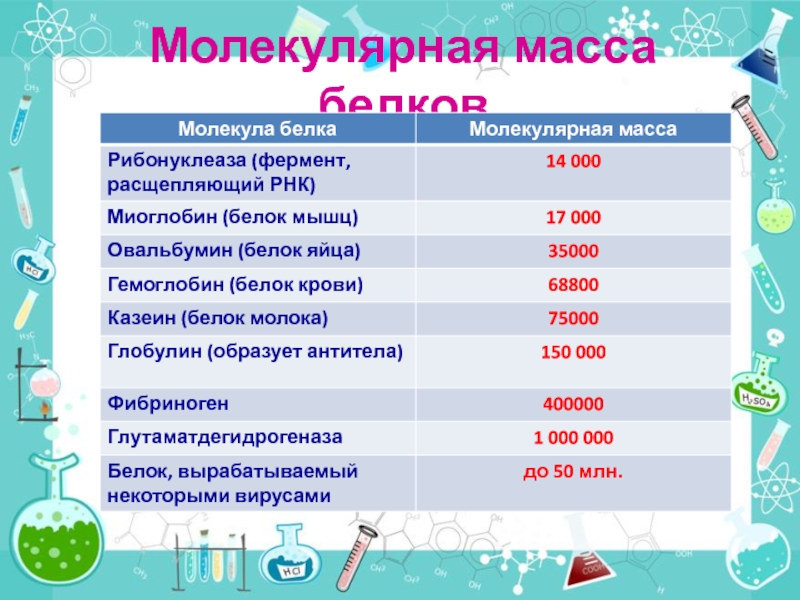
- 23. Молекулярная масса белков
- 24. ПолимерыПРИРОДНЫЕКрахмалЦеллюлозаКаучукКанифольБелкиИСКУССТВЕННЫЕПолиэтиленПолипропиленВискозаПенопластКапрон
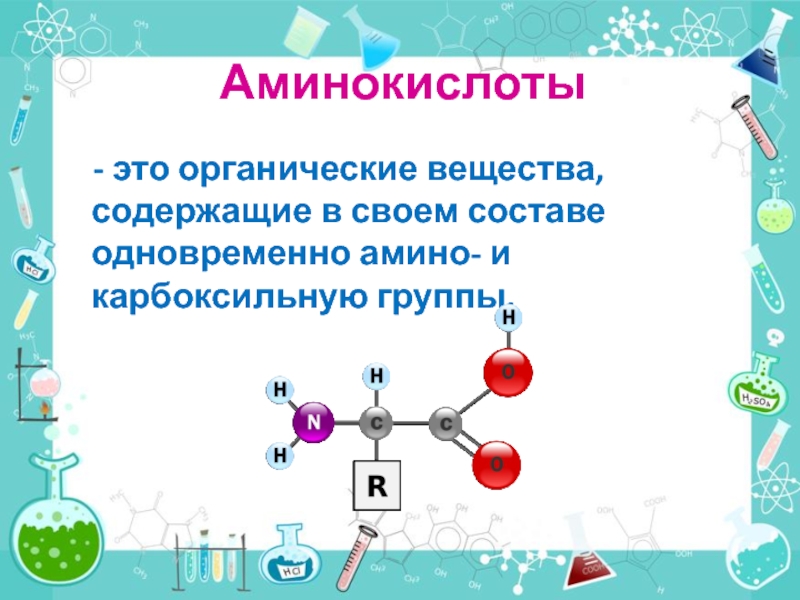
- 25. Аминокислоты - это органические вещества, содержащие в своем составе одновременно амино- и карбоксильную группы.
- 26. ОБЩАЯ ФОРМУЛА АМИНОКИСЛОТ В
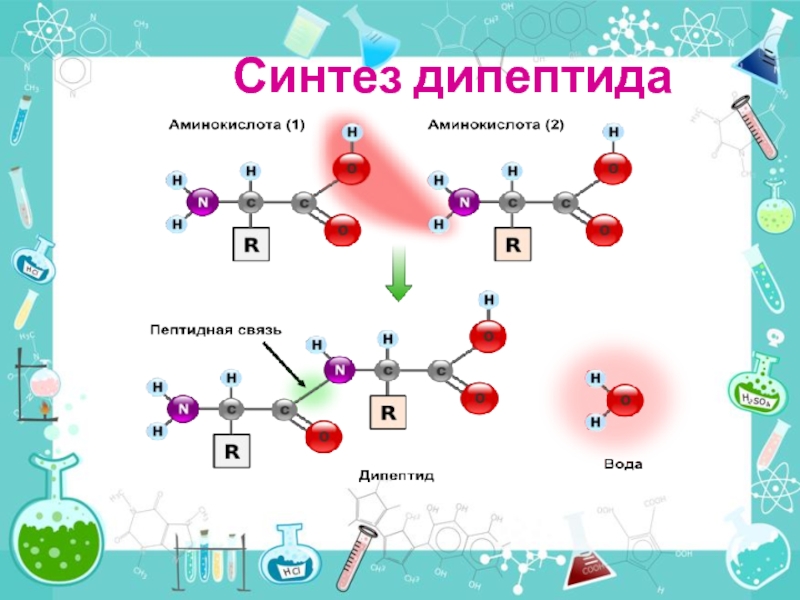
- 27. Синтез дипептида
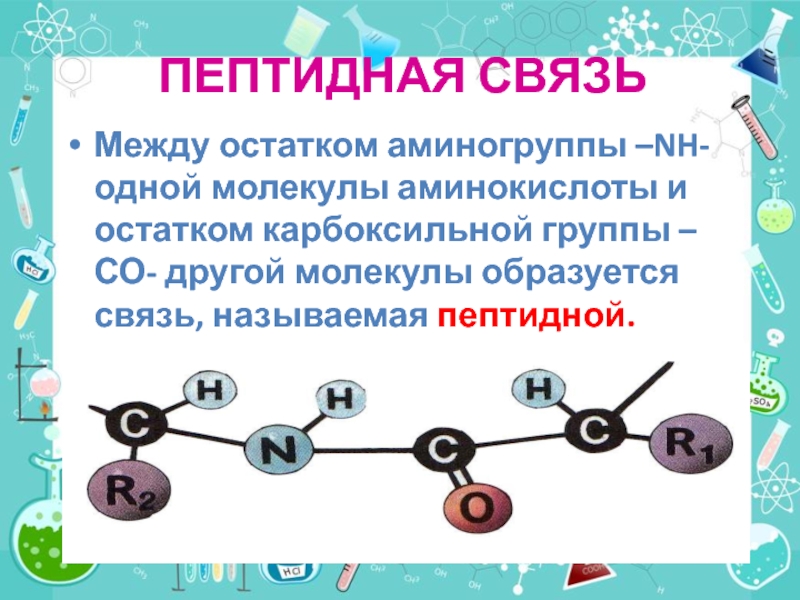
- 28. ПЕПТИДНАЯ СВЯЗЬМежду остатком аминогруппы –NH- одной молекулы
- 29. СТРУКТУРЫ БЕЛКОВ Порядок чередования аминокислотных звеньев в полипептидной цепи определяет первичную структуру белка.
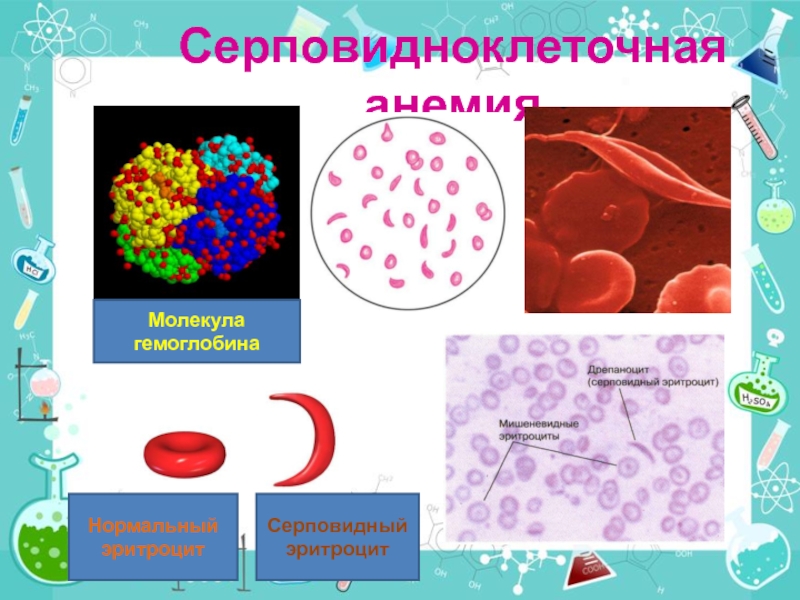
- 30. Серповидноклеточная анемияМолекула гемоглобинаНормальный эритроцитСерповидный эритроцит
- 31. ВТОРИЧНАЯ структураВторичная структура — пространственная конфигурация, которую принимает полипептидная цепь.
- 32. ТРЕТИЧНАЯ СТРУКТУРАТретичная структура — пространственная конфигурация, которую принимает в пространстве закрученная спираль полипептидная цепь.
- 33. ЧЕТВЕРТИЧНАЯ СТРУКТУРАВзаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
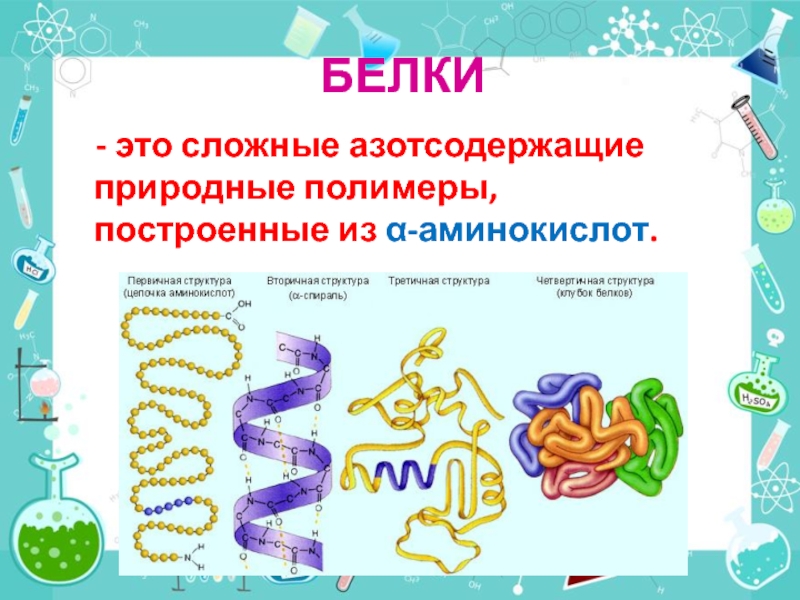
- 34. БЕЛКИ - это сложные азотсодержащие природные полимеры, построенные из α-аминокислот.
- 35. СВОЙСТВА БЕЛКОВБелки – бело-желтые порошки, полученные при
- 36. ДЕНАТУРАЦИЯОБРАТИМАЯ
- 37. 5. Амфотерность белков Эти дополнительные, сохраняющиеся
- 38. ВНУТРЕННЯЯ СРЕДА ОРГАНИЗМА (ВСО)КРОВЬЛИМФАТКАНЕВАЯ ЖИДКОСТЬАмфотерность белков имеет
- 39. 6. Цветные реакцииКсантопротеиновая реакция
- 40. Фенилкетонурия Заболевание связано с нарушением метаболизмаЗаболевание связано с
- 41. БИУРЕТОВАЯ РЕАКЦИЯБелок + NaOH + CuSO4
- 42. Выделение казеиногена из молокаМолоко + CH3COOH (конц.)
- 43. 8. ГИДРОЛИЗ - разрушение первичной структуры
- 44. СВОЙСТВА БЕЛКОВБелки – бело-желтые порошки, получаемые при
- 45. ФУНКЦИИ БЕЛКОВ
- 46. ФУНКЦИИ БЕЛКОВКератин – белок, входящий в состав волос волос,
- 47. ПЕПСИНЖелудочный сок + белок вареного яйцаВыдерживаем 40мин.
- 48. Д/З Лабораторная работа «Роль фермента каталазы
- 49. Гемоглобин в крови доставляет кислород в клетки
- 50. БЕЛКИ-АНТИТЕЛА – для обезвреживания чужеродных веществ.На основе
- 51. ФИБРИЛЛЫ – нитевидные белковые структуры в тканях
- 52. Белки выполняют энергетическую
- 53. Гормоны белковой либо пептидной природы:инсулин, глюкагонгормоны гипофиза.РЕГУЛЯТОРНАЯ ФУНКЦИЯ
- 54. Слайд 54
- 55. ВАЖНЕЙШИЕ ИСТОЧНИКИ БЕЛКОВ (в 100 гр)Продукты
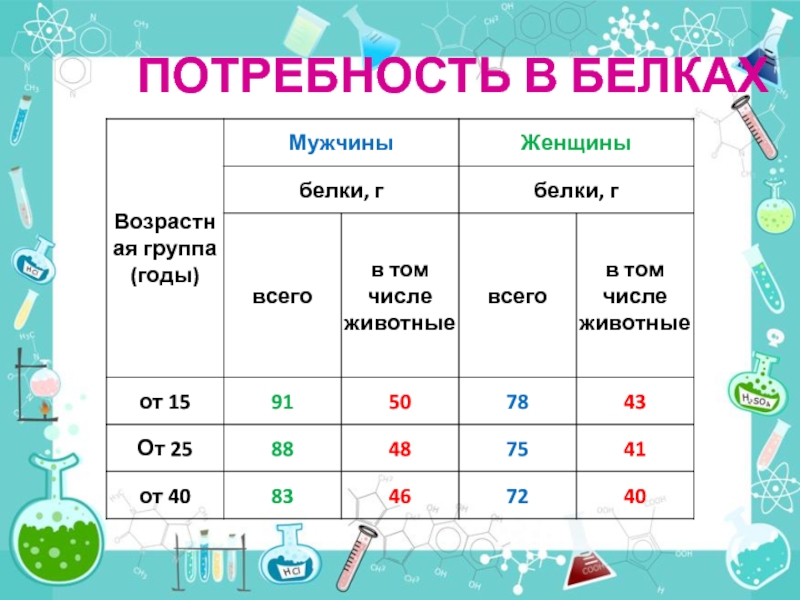
- 56. ПОТРЕБНОСТЬ В БЕЛКАХ
- 57. Содержание белка в некоторых тканях (после обезвоживания
- 58. ОПРЕДЕЛЕНИЕ БЕЛКА в МОЧЕПроба с кипячением
- 59. ВЫВОДЫ ПО УРОКУБелки – это высшая форма
- 60. СОСТАВЛЕНИЕ СИНКВЕЙНАСинквейн (с фр.) – «пять строк», пятистрочная
- 61. ТЕСТОВАЯ РАБОТА
- 62. ДОМАШНЕЕ ЗАДАНИЕСоставить синквейн к слову «белки»д/з лабораторная
Слайд 1БЕЛКИ
интегрированный урок
в 10 классе
МОУ Карачихской СОШ
Учитель биологии - Комарова Н.А.
Учитель химии
Слайд 2«Жизнь – есть способ существования белковых тел, существенным моментом которого является
/Ф. Энгельс/
Слайд 3Цель урока:
расширить и углубить представления о строении, свойствах и
Слайд 5 Свое название белки получили от яичного белка, который с
Согласно описаниям Плиния Старшего,
уже в Древнем Риме яичный белок применялся в качестве лечебного средства.
Слайд 6 Однако, в отдельный класс биологических молекул белки были
В то время уже были исследованы такие белки, как яичный белок, белок крови и белок зерна пшеницы.
Слайд 7Голландский химик Геррит Мульдер определил продукты разрушения белков — аминокислоты и для одной из
В 1836 Мульдер предложил первую модель химического строения белков.
Слайд 8Термин «протеин»
для обозначения
подобных
молекул был
предложен в 1838 году
сотрудником
Якобом Берцелиусом.
Слайд 9В 1894 году немецкий физиолог Альбрехт Коссель выдвинул теорию, согласно которой
Слайд 10 Немецкий химик Эмиль Фишер – основоположник химии белков
1853-1919г.г
Слайд 11В 1888г. – один из основоположников отечественной биохимии, Александр Яковлевич Данилевский
1838-1923г.г.
Слайд 12Джеймс Самнер (американский химик) экспериментально доказал, что фермент уреаза является белком,
Слайд 13Первым ученым, который смог успешно предсказать вторичную структуру белков в 1933
Слайд 14
Определение аминокислотной последовательности первого белка — инсулина принесло Фредерику
Слайд 15Первые трёхмерные структуры белков гемоглобина и миоглобина были получены методом дифракции
Слайд 16
В 1980-ых годах XX века были получены структуры белков с помощью
Слайд 17В последние годы в образовании белков достигнуты значительные успехи. Появились планы
Комбикормовый мини-завод
Слайд 18Кроме того, одна из главных задач органической химии – это создание
Слайд 19В нашей стране в этом направлении работал академик А.Н.Несмеянов с сотрудниками
1899-1980
Слайд 20 В настоящее время Банк данных о белках (Protein
В 21 веке исследование белков перешло на качественно новый уровень, когда исследуются не только индивидуальные очищенные белки, но и их модификации. Эта область биохимии получила название протеомики.
Слайд 22Состав белков
углерод – 50-55%,
кислород – 21-24%,
азот – 15-18%,
водород – 6–7%,
сера –
В состав некоторых белков входят:
железо, медь, бром, марганец…
Слайд 24Полимеры
ПРИРОДНЫЕ
Крахмал
Целлюлоза
Каучук
Канифоль
Белки
ИСКУССТВЕННЫЕ
Полиэтилен
Полипропилен
Вискоза
Пенопласт
Капрон
Слайд 25Аминокислоты
- это органические вещества, содержащие в своем составе одновременно
Слайд 26
ОБЩАЯ ФОРМУЛА АМИНОКИСЛОТ
В аминокислотах выделяют 2 функциональные группы:
H2N - CH -
R
1.Аминогруппа 2.Карбоксильная группа
Радикал ( они разные
у всех аминокислот)
Слайд 28ПЕПТИДНАЯ СВЯЗЬ
Между остатком аминогруппы –NH- одной молекулы аминокислоты и остатком карбоксильной
Слайд 29СТРУКТУРЫ БЕЛКОВ
Порядок чередования аминокислотных звеньев в полипептидной цепи определяет
Слайд 31
ВТОРИЧНАЯ структура
Вторичная структура — пространственная конфигурация, которую принимает полипептидная цепь.
Слайд 32ТРЕТИЧНАЯ СТРУКТУРА
Третичная структура — пространственная конфигурация, которую принимает в пространстве закрученная
Слайд 33ЧЕТВЕРТИЧНАЯ СТРУКТУРА
Взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
Слайд 35СВОЙСТВА БЕЛКОВ
Белки – бело-желтые порошки, полученные при постепенном осаждении.
Растворимость.
Разложение.
Денатурация – нарушение
Денатурация может быть вызвана изменением температуры, обезвоживанием, облучением рентгеновскими лучами и другими воздействиями. Вначале разрушается самая слабая структура – четвертичная, затем третичная, вторичная и при наиболее жестких условиях – первичная… Самый известный случай денатурации белка в быту — это приготовление куриного яйца
Слайд 36ДЕНАТУРАЦИЯ
ОБРАТИМАЯ
Если сохранена Если первичная
первичная структура
структура разрушена
(РЕНАТУРАЦИЯ)
Ренатурация широко используется в медицинской и пищевой промышленности для приготовления медицинских препаратов, например вакцин и сывороток, для получения пищевых концентратов, сохраняющих в высушенном виде свои питательные функции.
Слайд 375. Амфотерность белков
Эти дополнительные, сохраняющиеся в макромолекуле группы и
щелочь кислота
NaOH HCl
Амфотерные свойства
Затрачиваются на образование пептидных связей, т.е. ДИАМИНОКАРБОНОВЫЕ и АМИНОДИКАРБОНОВЫЕ кислоты
- NH2
- С = O
I
OH
Может ли белок проявлять кислотные или основные свойства?
Если больше групп
- С = O
I - кислотные свойства.
OH
Если больше групп - NH2
- основные свойства
Слайд 38ВНУТРЕННЯЯ СРЕДА ОРГАНИЗМА (ВСО)
КРОВЬ
ЛИМФА
ТКАНЕВАЯ ЖИДКОСТЬ
Амфотерность белков имеет большое биологическое значение. ВСО
Белки поддерживают реакцию ВСО на нужном (близком к нейтральному) уровню.
РН ͂ 7
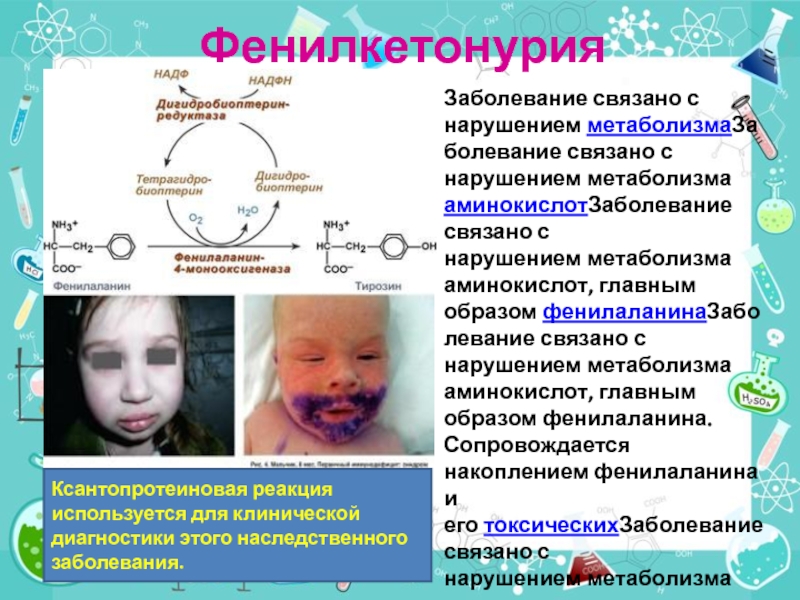
Слайд 40Фенилкетонурия
Заболевание связано с нарушением метаболизмаЗаболевание связано с нарушением метаболизма аминокислотЗаболевание связано с нарушением метаболизма
Диагностика заболевания:
Капнуть на мокрую пеленку новорожденного HNO3: если появляется желтое пятно - ребенок болен (лечение – введение недостающего фермента).
Ксантопротеиновая реакция используется для клинической диагностики этого наследственного заболевания.
Слайд 438. ГИДРОЛИЗ
- разрушение первичной структуры белка. В лабораторных условиях
Слайд 44СВОЙСТВА БЕЛКОВ
Белки – бело-желтые порошки, получаемые при постепенном осаждении при низких
Растворимость.
Денатурация (ренатурация).
Разложение.
Амфотерность.
Цветные реакции.
Реакции осаждения белков.
Гидролиз.
Слайд 46ФУНКЦИИ БЕЛКОВ
Кератин – белок, входящий в состав волос волос, ногтей, волос, ногтей, шерсти,
Фиброин – белок (ГЛИ+АЛА+ТИР+СЕР), выделяемый паукообразнымивыделяемый паукообразными и некоторыми насекомымивыделяемый паукообразными и некоторыми насекомыми, составляющий основу нитей паутинывыделяемый паукообразными и некоторыми насекомыми, составляющий основу нитей паутины и коконоввыделяемый паукообразными и некоторыми насекомыми, составляющий основу нитей паутины и коконов насекомых, в частности - шелкавыделяемый паукообразными и некоторыми насекомыми, составляющий основу нитей паутины и коконов насекомых, в частности - шелка тутового шелкопряда.
Коллаген – белок, составляющий основу соединительной ткани организма, обеспечивающий ее прочность и эластичность.
1.СТРОИТЕЛЬНАЯ ФУНКЦИЯ
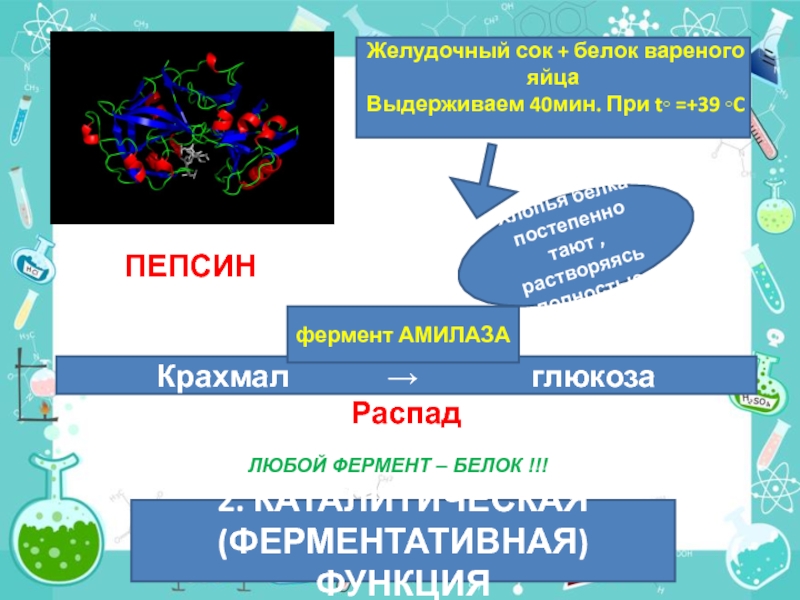
Слайд 47ПЕПСИН
Желудочный сок + белок вареного яйца
Выдерживаем 40мин. При t◦ =+39 ◦C
Хлопья
Крахмал → глюкоза
Распад
фермент АМИЛАЗА
2. КАТАЛИТИЧЕСКАЯ (ФЕРМЕНТАТИВНАЯ) ФУНКЦИЯ
ЛЮБОЙ ФЕРМЕНТ – БЕЛОК !!!
Слайд 48Д/З Лабораторная работа
«Роль фермента каталазы в клетке»
Ферменты – это специфические
.
Вывод: о роли фермента каталазы в биохимических реакциях клетки и условиях, влияющих на их активность
Слайд 49Гемоглобин в крови доставляет кислород в клетки тела
животных и человека,
не подвергая его химическим
изменениям
3. ТРАНСПОРТНАЯ ФУНКЦИЯ
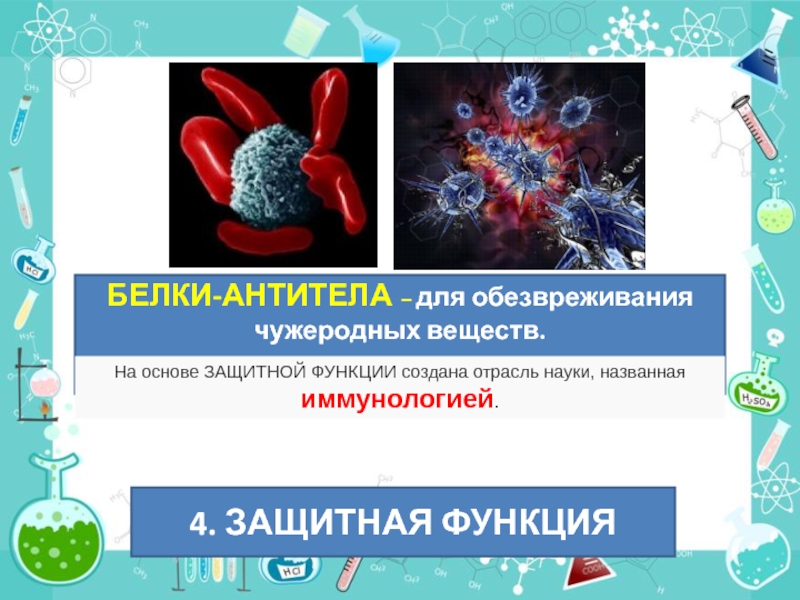
Слайд 50БЕЛКИ-АНТИТЕЛА – для обезвреживания чужеродных веществ.
На основе ЗАЩИТНОЙ ФУНКЦИИ создана отрасль
4. ЗАЩИТНАЯ ФУНКЦИЯ
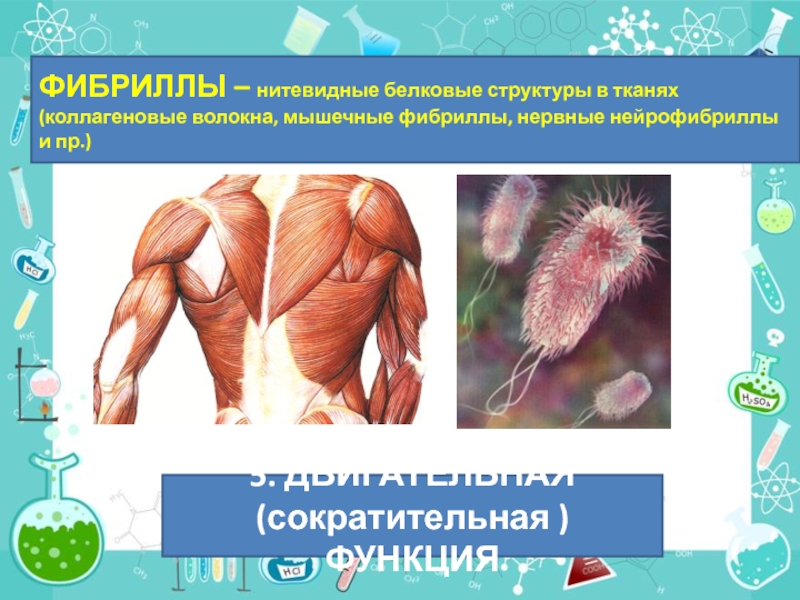
Слайд 51ФИБРИЛЛЫ – нитевидные белковые структуры в тканях (коллагеновые волокна, мышечные фибриллы,
5. ДВИГАТЕЛЬНАЯ (сократительная )ФУНКЦИЯ
Слайд 52 Белки выполняют
энергетическую функцию:
при
1 г белка
освобождается
17,6 кДж
6. ЭНЕРГЕТИЧЕСКАЯ ФУНКЦИЯ
Слайд 53Гормоны белковой либо пептидной природы:
инсулин,
глюкагон
гормоны
гипофиза.
РЕГУЛЯТОРНАЯ ФУНКЦИЯ
Слайд 55ВАЖНЕЙШИЕ ИСТОЧНИКИ БЕЛКОВ (в 100 гр)
Продукты
Соя 34
Сыр 30
Грибы 27
Горох 19,7
Фасоль 19,6
Мясо 14-20
Творог 14-18
Греча 12,6
Орехи 16-18
Рыба 12-16
Яйца 10,8
Хлеб 5-10
Молоко 5
Картофель 1,7
Слайд 57Содержание белка в некоторых тканях (после обезвоживания органа):
Мышцы – 80%;
Почки –
Кожа – 63%;
Печень – 57%;
Мозг – 45%;
Жировая ткань, кости, зубы – 14 – 28%;
Семена растений – 10 – 15 %;
Стебли, корни, листья – 3% - 5%
Плоды – 1-2%
Слайд 58ОПРЕДЕЛЕНИЕ БЕЛКА в МОЧЕ
Проба с кипячением
2 мл профильтрованной
К горячему раствору по каплям (1-3) добавить 1% р-р уксусной кислоты.
Если это – белок, осадок свертывается и оседает на дно, если осадок зависит от фосфатов, он растворяется при подкислении мочи.
Избегать избытка кислоты!
Заболевание - ПРОТЕИНУРИЯ
Слайд 59ВЫВОДЫ ПО УРОКУ
Белки – это высшая форма развития органических веществ.
Белки –
Остатки α-аминокислот связаны пептидными (амидными) связями.
Белок обладает 4 уровнями организации:
- первичная;
- вторичная;
- третичная;
- четвертичная.
Денатурация - разрушение вторичной и третичной структур белка, – потеря белками биологической активности.
Функции белков: строительная, каталитическая, транспортная, защитная, двигательная, энергетическая, регуляторная.
Слайд 60СОСТАВЛЕНИЕ СИНКВЕЙНА
Синквейн (с фр.) – «пять строк», пятистрочная строфа нерифмованного стихотворения.
Работа над
Синквейн – концентрация знаний, ассоциаций, чувств; сужение оценки явлений и событий, выражение своей позиции, взгляда на событие, предмет.
Правила составления синквейна
1. Одно слово, обычно существительное, отражающее главную идею; 2. Два слова, прилагательные, описывающие основную мысль; 3. Три слова, глаголы, описывающие действия в рамках темы; 4. Фраза из нескольких слов, показывающая отношение к теме; 5. Слово или несколько слов, связанные с первым, отражающие сущность темы.
Пример синквейна
1. АМИНОКИСЛОТЫ
2. НЕЗЕМЕНИМЫЕ, АМФОТЕРНЫЕ
3. СОЕДИНЯЮТСЯ, РАСТВОРЯЮТСЯ, ПЛАВЯТСЯ
4. ПРОЯВЛЯЮТ СВОЙСТВА АМИНОВ И КАРБОНОВЫХ КИСЛОТ
5. МОНОМЕРЫ БЕЛКОВ
Слайд 62ДОМАШНЕЕ ЗАДАНИЕ
Составить синквейн к слову «белки»
д/з лабораторная работа
«Роль фермента каталазы
По учебникам:
- биологии 10-11 кл (§ 4)
- химии
10 кл. (§ 17)
Конспект в
тетради.