- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по биологии Апоптоз и аутофагия
Содержание
- 1. Презентация по биологии Апоптоз и аутофагия
- 2. Клеточная свалкаАутофагия находится в центре научных интересов
- 3. Кроме лизосом, биологи обнаружили аутофагосомы – "тележки" для подвоза
- 4. Тот факт, что фрагменты клеток особенно быстро
- 5. Наконец, аутофагия полезна и в том случае,
- 6. Апоптоз (самоубийство) является наиболее подробно описанной формой запланированной
- 7. Аутофагия является одним из основных механизмов для ликвидации
- 8. Заболеваемость раком резко возрастает после 50-летнего возраста,
- 9. В целях сохранения организма, поврежденные клетки опираются
- 10. Регуляция аутофагии. Аутофагия сопровождает жизнедеятельность любой нормальной
- 11. Значение аутофагии при нормальных и патологических процессах.
- 12. В случае интенсификации процессов аутофагии клетки разрушаются,
- 13. Клеточное старение по сути является остановкой в фазе G1 клеточного
- 14. Клеточное старение (сенесценция) В нормальных условиях, активность
- 15. Механизм апоптоза Апоптоз является наиболее подробно изученной
- 16. В ходе внутриклеточного пути, несколько сенсоров, в
- 17. Апоптоз запускаемый на уровне митохондрий жестко регулируется
- 18. Внешний путь начинается в плазматической мембране за
- 19. Апоптоз и сенесценция Как и клеточное старение, апоптоз
- 20. механизм аутофагии Коротко-живущие белки ликвидируются преимущественно
- 21. Основным негативным регулятором макро-аутофагии является киназа mTOR, которая,
- 22. Этот комплекс негативно регулируются белками Bcl-2 /
- 23. Следующий тип само-поедания является шаперон-ассоциированная аутофагия (CMA). Несмотря на
- 24. Аутофагия и апоптоз при клеточном старении В
- 25. В опухолевых клетках клеточных линий при воздействии
- 26. Недостаток питательных веществ является наиболее часто используемым
- 27. Точный механизм, посредством которого аутофагия уменьшает старение далеко не ясен. Тем
Слайд 2Клеточная свалка
Аутофагия находится в центре научных интересов Осуми уже 27 лет.
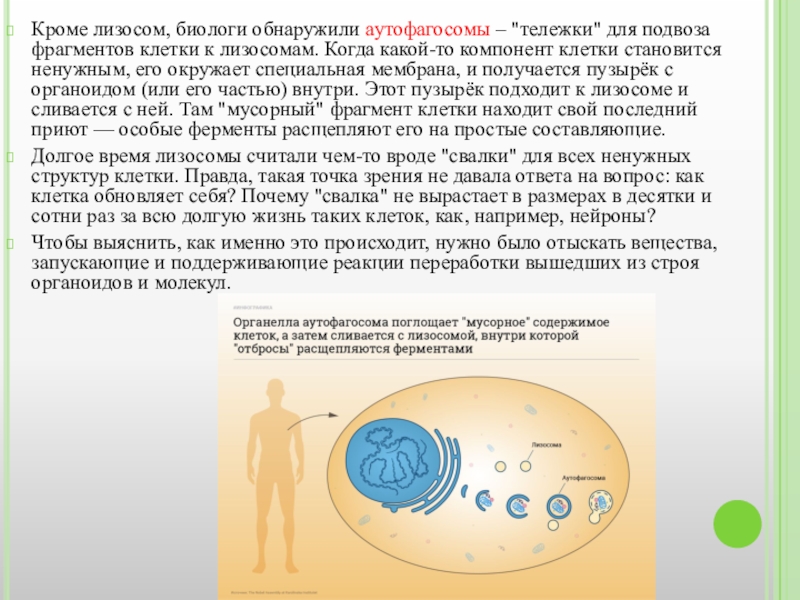
Слайд 3Кроме лизосом, биологи обнаружили аутофагосомы – "тележки" для подвоза фрагментов клетки к лизосомам.
Долгое время лизосомы считали чем-то вроде "свалки" для всех ненужных структур клетки. Правда, такая точка зрения не давала ответа на вопрос: как клетка обновляет себя? Почему "свалка" не вырастает в размерах в десятки и сотни раз за всю долгую жизнь таких клеток, как, например, нейроны?
Чтобы выяснить, как именно это происходит, нужно было отыскать вещества, запускающие и поддерживающие реакции переработки вышедших из строя органоидов и молекул.
Слайд 4Тот факт, что фрагменты клеток особенно быстро накапливаются в "голодающих" клетках,
Аутофагия — это единственный процесс, за счёт которого клетка обновляется "по-крупному". Протеасомы со своими убиквитиновыми метками разрушают только белки, и то не все, а лишь те, которым и так на роду написана короткая жизнь.
В аутофагосомы попадают большие фрагменты клеток, содержащие в себе не только белки, но и липиды, и нуклеиновые кислоты, и другие вещества. Когда ферменты лизосом, слившихся с аутофагосомами, переводят эти вещества в более доступную форму, клетка получает дополнительное питание.
Слайд 5Наконец, аутофагия полезна и в том случае, когда строение клетки нужно
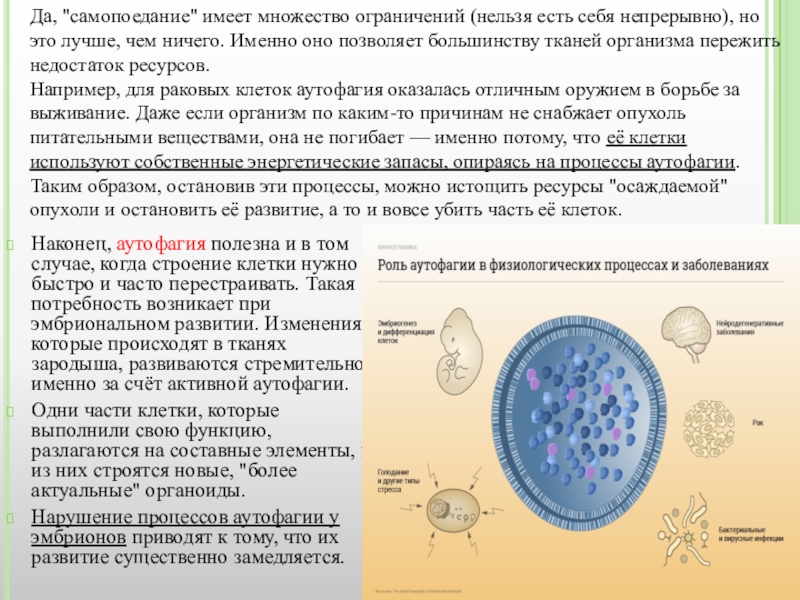
Одни части клетки, которые выполнили свою функцию, разлагаются на составные элементы, и из них строятся новые, "более актуальные" органоиды.
Нарушение процессов аутофагии у эмбрионов приводят к тому, что их развитие существенно замедляется.
Да, "самопоедание" имеет множество ограничений (нельзя есть себя непрерывно), но это лучше, чем ничего. Именно оно позволяет большинству тканей организма пережить недостаток ресурсов.
Например, для раковых клеток аутофагия оказалась отличным оружием в борьбе за выживание. Даже если организм по каким-то причинам не снабжает опухоль питательными веществами, она не погибает — именно потому, что её клетки используют собственные энергетические запасы, опираясь на процессы аутофагии.
Таким образом, остановив эти процессы, можно истощить ресурсы "осаждаемой" опухоли и остановить её развитие, а то и вовсе убить часть её клеток.
Слайд 6 Апоптоз (самоубийство) является наиболее подробно описанной формой запланированной клеточной смерти. Существует, однако,
аутофагия (самопоедание), которая осуществляется при помощи лизосомной деградации, имеющей важное значение для поддержания гомеостаза.
В отличие от митотических (делящихся) клеток, постмитотические клетки, такие как нейроны или кардиомиоциты, не могут войти в состояние покоя, поскольку они уже окончательно дифференцированны.
Судьба этих клеток, таким образом, полностью зависит от их способности справляться со стрессом.
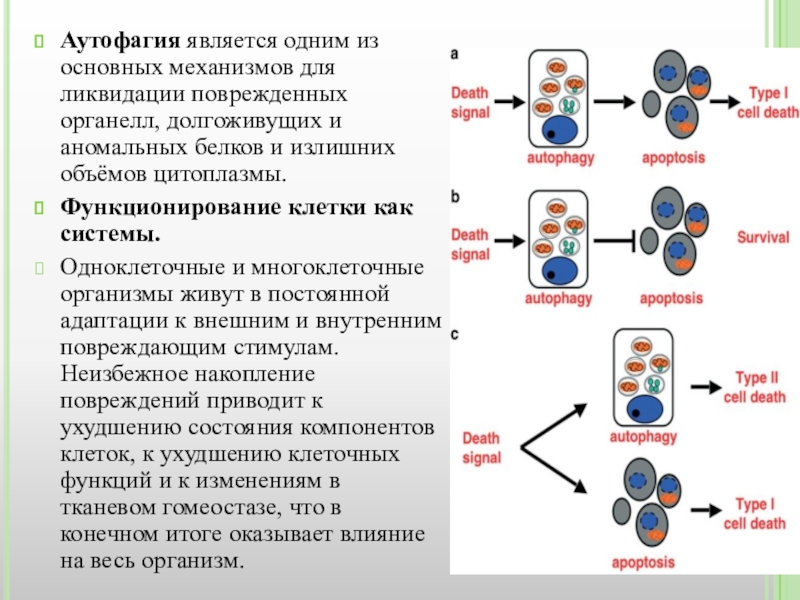
Слайд 7Аутофагия является одним из основных механизмов для ликвидации поврежденных органелл, долгоживущих и
Функционирование клетки как системы.
Одноклеточные и многоклеточные организмы живут в постоянной адаптации к внешним и внутренним повреждающим стимулам. Неизбежное накопление повреждений приводит к ухудшению состояния компонентов клеток, к ухудшению клеточных функций и к изменениям в тканевом гомеостазе, что в конечном итоге оказывает влияние на весь организм.
Слайд 8
Заболеваемость раком резко возрастает после 50-летнего возраста, в то время как
Одним из важных различий между этими двумя патологиями является тип клеток, которые они поражают.
Рак затрагивает, в первую очередь, митотические клетки, в то время как нейродегенеративные расстройства затрагивают главным образом постмитотические клетки.
После развития и дифференцировки, простыe организмы (например, Caenorhabditis elegans и Drosophila melanogaster) состоят только из постмитотических -неделящиеся клетки, окончательно утратившие способность делиться ) клеток.
И наоборот, комплексные организмы (например, млекопитающие) состоят как из постмитотических так и митотических клеток, которые присутствуют в регенерирующих тканях и поддерживают их способность размножаться.
Одним из важных различий между простыми и комплексными организмами, это продолжительность их жизни: нематоды C. elegans живут только несколько недель, плодовые мушки D.melanogaster живут несколько месяцев, в то время как мыши могут жить несколько лет, а люди - многие десятилетия.
Вполне вероятно, что присутствие регенерирующих тканей в организме дает возможность заменить поврежденные клетки, тем самым увеличивая продолжительность жизни.
Слайд 9В целях сохранения организма, поврежденные клетки опираются на два различных механизма,
Для постмитотических клеток однако, сценарий поведения повреждения клеток радикально отличается. Поскольку их клеточный цикл уже остановлен в фазе G0, они не могут войти в состояние покоя, в сенесценцию. Не имея такого преимущества как пролиферативное обновление, постмтотические клетки, такие, как нейроны или кардиомиоциты, вынуждены адаптироваться к стрессу в целях обеспечения жизненно важных функций всего организма.
В нейродегенеративных патологиях, таких как болезнь Паркинсона, болезнь Альцгеймера и Хантингтона, агрегирование белков является следствием недостаточного удаления окисленных, неверно сконформированных или аномальных белков в мозге. В этом контексте, аутофагия является основным путём для обеспечения нормальной функции повреждённой ткани.
Слайд 10Регуляция аутофагии.
Аутофагия сопровождает жизнедеятельность любой нормальной клетки в обычных условиях.
Основными стимулами
нехватка питательных веществ
наличие в цитоплазме повреждённых органелл
наличие в цитоплазме частично денатурировавших белков и их агрегатов
Для образования аутофагосом необходима активность многочисленных белков Atg-семейства (autophagosome-related proteins). Гомологи этих белков найдены у млекопитающих (в том числе и человека) и растений.
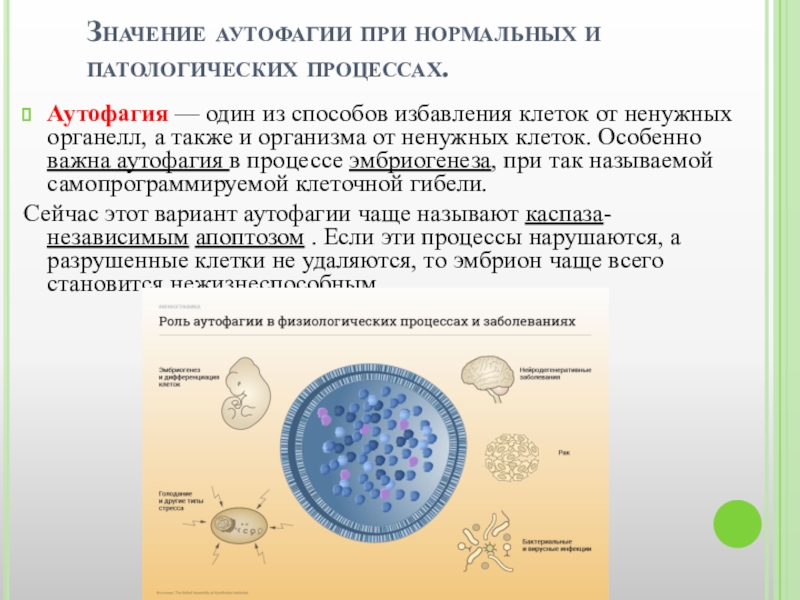
Слайд 11Значение аутофагии при нормальных и патологических процессах.
Аутофагия — один из способов избавления
Сейчас этот вариант аутофагии чаще называют каспаза-независимым апоптозом . Если эти процессы нарушаются, а разрушенные клетки не удаляются, то эмбрион чаще всего становится нежизнеспособным.
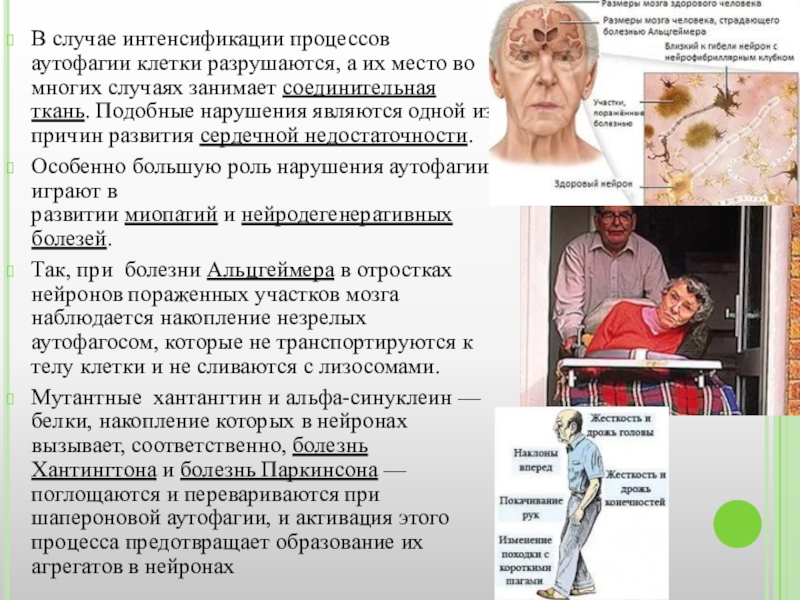
Слайд 12В случае интенсификации процессов аутофагии клетки разрушаются, а их место во
Особенно большую роль нарушения аутофагии играют в развитии миопатий и нейродегенеративных болезей.
Так, при болезни Альцгеймера в отростках нейронов пораженных участков мозга наблюдается накопление незрелых аутофагосом, которые не транспортируются к телу клетки и не сливаются с лизосомами.
Мутантные хантангтин и альфа-синуклеин — белки, накопление которых в нейронах вызывает, соответственно, болезнь Хантингтона и болезнь Паркинсона — поглощаются и перевариваются при шапероновой аутофагии, и активация этого процесса предотвращает образование их агрегатов в нейронах
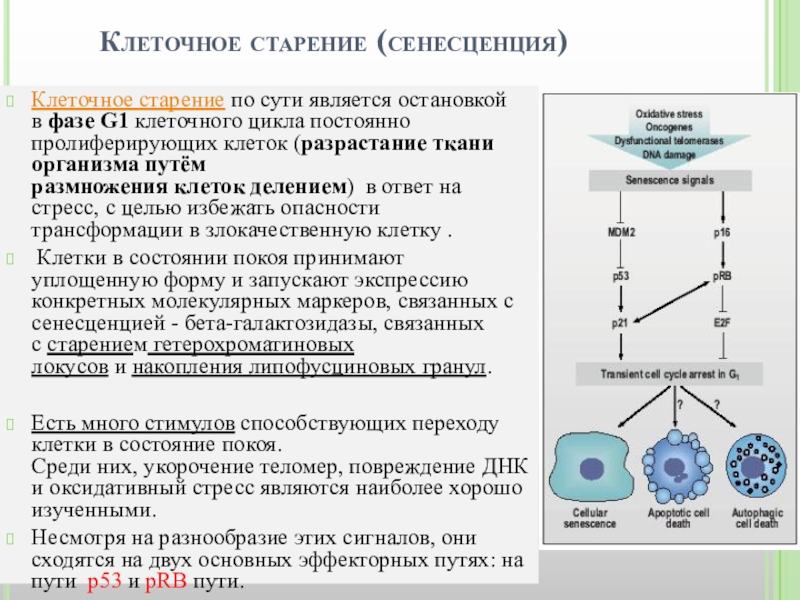
Слайд 13Клеточное старение по сути является остановкой в фазе G1 клеточного цикла постоянно пролиферирующих клеток
Клетки в состоянии покоя принимают уплощенную форму и запускают экспрессию конкретных молекулярных маркеров, связанных с сенесценцией - бета-галактозидазы, связанных с старением гетерохроматиновых локусов и накопления липофусциновых гранул.
Есть много стимулов способствующих переходу клетки в состояние покоя. Среди них, укорочение теломер, повреждение ДНК и оксидативный стресс являются наиболее хорошо изученными.
Несмотря на разнообразие этих сигналов, они сходятся на двух основных эффекторных путях: на пути р53 и pRB пути.
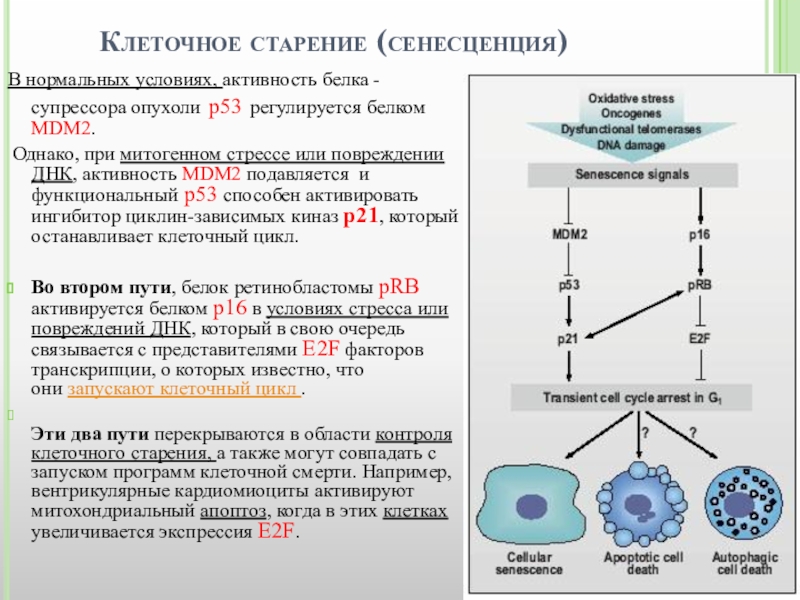
Клеточное старение (сенесценция)
Слайд 14Клеточное старение (сенесценция)
В нормальных условиях, активность белка - супрессора опухоли p53
Однако, при митогенном стрессе или повреждении ДНК, активность MDM2 подавляется и функциональный p53 способен активировать ингибитор циклин-зависимых киназ p21, который останавливает клеточный цикл.
Во втором пути, белок ретинобластомы рRB активируется белком p16 в условиях стресса или повреждений ДНК, который в свою очередь связывается с представителями E2F факторов транскрипции, о которых известно, что они запускают клеточный цикл .
Эти два пути перекрываются в области контроля клеточного старения, а также могут совпадать с запуском программ клеточной смерти. Например, вентрикулярные кардиомиоциты активируют митохондриальный апоптоз, когда в этих клетках увеличивается экспрессия E2F.
Слайд 15Механизм апоптоза
Апоптоз является наиболее подробно изученной формой запрограмированной клеточной гибели, которая
В отличие от гибели клеток путём некроза, при которой разрушается мембрана клеток и запускается воспалительная реакция, апоптоз осуществляется в пределах неповрежденной мембраны, без ущерба для соседних клеток.
На морфологическом уровне, классическими чертами апоптоза являются конденсация хроматина (pyknosis), ядерная фрагментация (karyorrhexis), сжатие клетки и пузырение мембраны.
Существует два основных пути инициации апоптоза: 1)внутриклеточный (или митохондриальный)
2)внешний
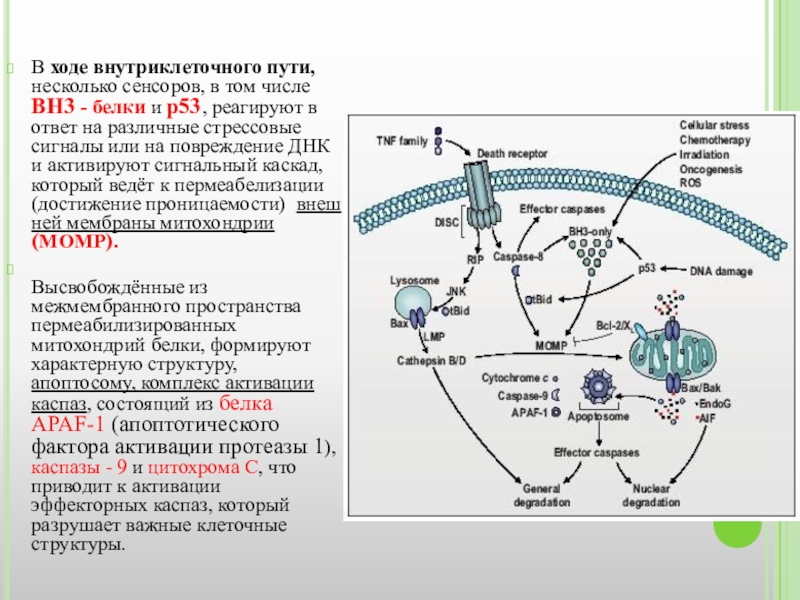
Слайд 16В ходе внутриклеточного пути, несколько сенсоров, в том числе BH3 -
Высвобождённые из межмембранного пространства пермеабилизированных митохондрий белки, формируют характерную структуру, апоптосому, комплекс активации каспаз, состоящий из белка APAF-1 (апоптотического фактора активации протеазы 1), каспазы - 9 и цитохрома С, что приводит к активации эффекторных каспаз, который разрушает важные клеточные структуры.
Слайд 17Апоптоз запускаемый на уровне митохондрий жестко регулируется семейством белков Bcl-2, которые
(1) анти-апоптотические мультидоменные члены (Bcl-2, Bcl-X L и Mcl-1), которые содержат четыре Bcl-2 гомологичных домена (BH1, BH2, BH3 и BH4),
(2) про-апоптотических мультидоменных члены (таких, как Bax и Bak), не имеющих BH4 доменов
(3) про-апоптотические BH3 белки (например, Bid, Bim и Bad).
Внутренние и внешние стимулы могут активировать протеолитическую деградацию белка Bid и транслокацию укороченного bid (tBid) к митохондриальной мембране, где он стимулирует MOMP, предположительно, путем активации каналов Bax / Bak и через другие механизмы. Множество внутриклеточных взаимодействий между членами семейства Bcl-2 сводятся к интеграции сигнальных каскадов, которые модулируют уровень и активность этих белков, чтобы активировать или избежать запуск митохондриального апоптоза.
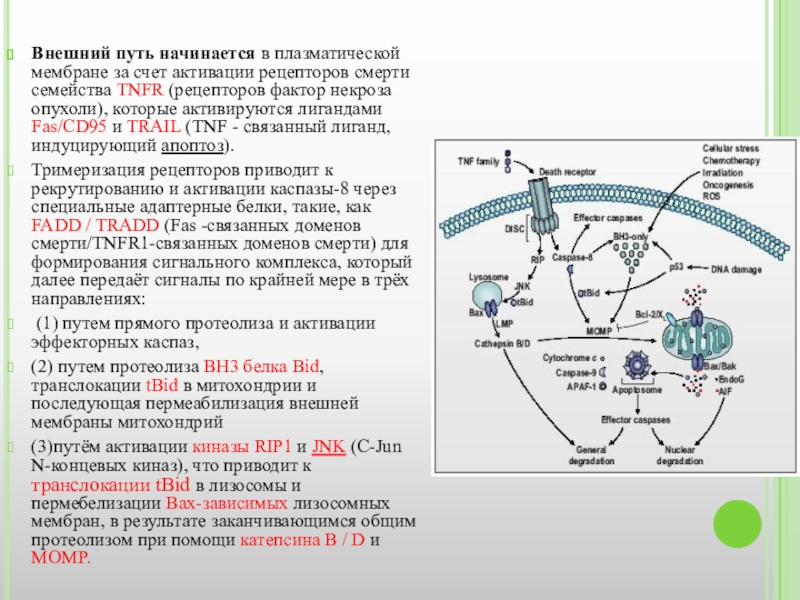
Слайд 18Внешний путь начинается в плазматической мембране за счет активации рецепторов смерти
Тримеризация рецепторов приводит к рекрутированию и активации каспазы-8 через специальные адаптерные белки, такие, как FADD / TRADD (Fas -связанных доменов смерти/TNFR1-связанных доменов смерти) для формирования сигнального комплекса, который далее передаёт сигналы по крайней мере в трёх направлениях:
(1) путем прямого протеолиза и активации эффекторных каспаз,
(2) путем протеолиза BH3 белка Bid, транслокации tBid в митохондрии и последующая пермеабилизация внешней мембраны митохондрий
(3)путём активации киназы RIP1 и JNK (C-Jun N-концевых киназ), что приводит к транслокации tBid в лизосомы и пермебелизации Bax-зависимых лизосомных мембран, в результате заканчивающимся общим протеолизом при помощи катепсина B / D и MOMP.
Слайд 19Апоптоз и сенесценция
Как и клеточное старение, апоптоз является крайней формой клеточного ответа
Тип клетки является определяющим, так поврежденные эпителиальные клетки и фибробласты в основном входят в покой, в то время как поврежденные лимфоциты подвергаются апоптозу. Кроме того, было сообщено о том, что при помощи манипулирования уровня экспрессии Bcl-2 или ингибирования каспаз можно направить клетку, которая обычно бы умерла путем апоптоза, в состояние покоя.
Также, были предприняты попытки затормозить клеточное старение путём повышенного уровня теломеразы, что в итоге не предотвращает клеточного старения, а защищает клетки от апоптоза. Эти исследования ясно указывают на пересечение между процессами апоптоза и клеточного старения, например, на уровне белка супрессора опухоли p53.
Слайд 20
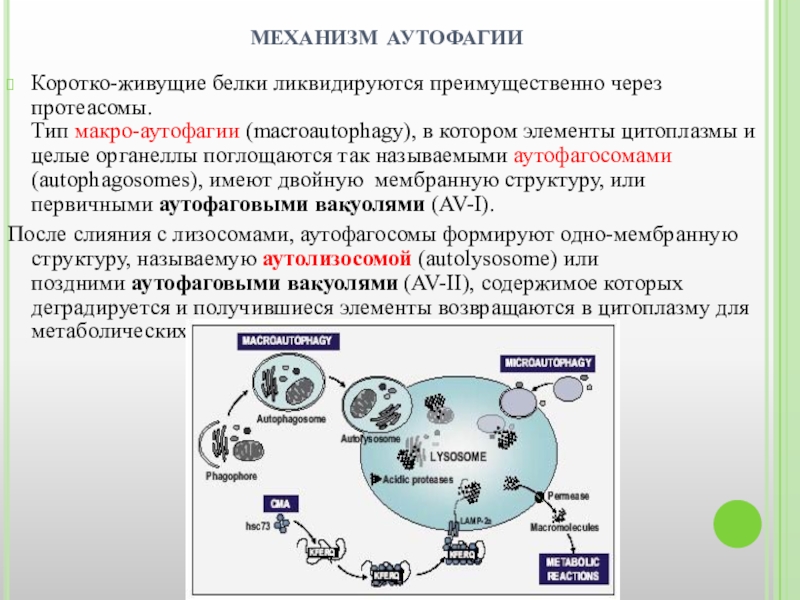
механизм аутофагии
Коротко-живущие белки ликвидируются преимущественно через протеасомы.
Тип макро-аутофагии (macroautophagy), в котором
После слияния с лизосомами, аутофагосомы формируют одно-мембранную структуру, называемую аутолизосомой (autolysosome) или поздними аутофаговыми вакуолями (AV-II), содержимое которых деградируется и получившиеся элементы возвращаются в цитоплазму для метаболических реакций.
Слайд 21Основным негативным регулятором макро-аутофагии является киназа mTOR, которая, как правило, запускает базовое
Подавление mTOR активности способствует ферментативной активации мультипротеинового комплекса, который формируется из III phosphatidylinositol 3-киназы (PI3K), белка вакуолярной сортировки 34 (Vps34), Beclin 1, белка вакуолярной сортировки 15 (Vps15), белка резистентности к УФ-излучению (UVRAG), endophilin B1 (Bif-1), молекулы активации Beclin-1-зависимой аутофагии (Ambra 1) и, возможно, другие белки.
Слайд 22Этот комплекс негативно регулируются белками Bcl-2 / X L. Vps34 производит
Процесс макро-аутофагии можно заингибировать по пути insulin/IGF-1, где PI3K продуцируют phosphatidylinositol - 3,4,5-trisphosphate [PtdIns (3,4,5) P 3], которые стимулируют функцию mTOR .
Не так хорошо изученным является следующий тип аутофагии - микро-аутофагия (microautophagy), при котором поглощение органелл производится непосредственно в лизосомные мембраны. Этот механизм также является путём деградации органелл и долгоживущих белков, но, в отличие от макро-аутофагии, он не отвечает за адаптацию к недостатку питательных веществ.
Слайд 23Следующий тип само-поедания является шаперон-ассоциированная аутофагия (CMA). Несмотря на то, что этот путь
В CMA, белки цитоплазмы, которые содержат конкретные пента-пептидные мотивы, распознаваемые лизосомами (консенсус последовательность KFERQ) распознаются комплексом белков-шаперонов (в том числе теплового шока 73 кДа-белок, hsc73) и направляются к лизосомной мембране, где они взаимодействуют с белками, связанными с мембраной лизосом (LAMP) 2a.
Субстратные белки затем разворачиваются и транспортируются в люмен лизосом для деградации. Мотив KFERQ находится примерно в 30% белков цитоплазмы, включающих в том числе RNase А и амилоидные белки предшественники (APP).
Интересно, что АРР могут быть связаны hsc73 (и, следовательно, скормлены СМА), когда основной путь их деградации заингибирован и данное взаимодействие происходит не через APP KFFEQ последовательности.
Пока еще не ясно как KFERQ мотив распознается шапероновым комплексом.
Некоторые пост-трансляционные изменения субстратов (например, окисление или денатурация) могут сделать этот мотив более доступными для шаперонов, повышая уровень их лизосомного поглощения в CMA.
Слайд 24Аутофагия и апоптоз при клеточном старении
В большинстве случаев, аутофагия способствует выживанию клеток путем
Это основано на том, что некоторые случаи гибели клеток сопровождаются массовой аутофаговой вакуолязацией. Тем не менее, эти морфологические наблюдения не могут показать, сопровождается ли смерть клетки формированием аутофаговых вакуолей или клеточная гибель действительно осуществляется путём аутофагии.
В самом деле, отношения между аутофагией и апоптозом являются сложными, и именно то, что определяет, погибнет ли клетка путем апоптоза или по другому механизму по-прежнему остаётся неясным.
В некоторых клеточных системах, аутофагия является единственным механизмом гибели, действуя в качестве резервного механизма исполнение смертного приговора, когда апоптоз в клетке просто заингибирован.
И наоборот, если в процессе клеточного голодания заблокировать процесс аутофагии (например, припомощи малых интерферирующих РНК), то инициируется программа апоптоза.
Слайд 25В опухолевых клетках клеточных линий при воздействии на них цитотоксическими веществами,
Опять же, белок p53 был определен в качестве одного из главных регуляторов определяющего направление, по которому пойдёт клетка. В стареющих и постмитотических клетках, аутофагия служит в качестве механизма адаптации к стрессу. Было показано, что аутофагосомы накапливаются в стареющих фибробластах в целях содействия обновлению веществ цитоплазмы и её органелл.
Точно так же в кардиомиоцитах, оптимальное функционирование митохондрий зависит от макро-аутофагии. Работа одного типа аутофагии- CMA - снижается с возрастом, что увеличивает риск дегенерации нейронов, связанный с накоплением подверженных к аггрегации мутантных белков.
Следует отметить, что нейродегенеративные заболевания, связанные с возрастом, имеют схожие характеристики с патологиями, вызванных нокаутом генов, связанных с аутофагией (atg) в головном мозге, такими как накопление убиквитинированных белков и телец включения в цитоплазме, увеличение апоптоза в нейронах и постепенная потеря нейрональных клеток.
Слайд 26Недостаток питательных веществ является наиболее часто используемым способом индуцирования аутофагии в
В ходе деградации макромолекул высвобождается АТФ, что позволяет скомпенсировать отсутствие внешних источников питания.
Важно отметить, что эта способность аутофагии может участвовать в продлении жизни организма за счёт ограничения в калорийности питания. Голодание или диетическое ограничение являются одним из сильнейших стимулов для запуска аутофагии по всему организму у мышей и нематод C.elegans.
В любопытном исследовании было показано, что выключение atg генов в C. elegans отменили эффекты противо-старения, которые наблюдались у особей в ходе ограничения калорий.
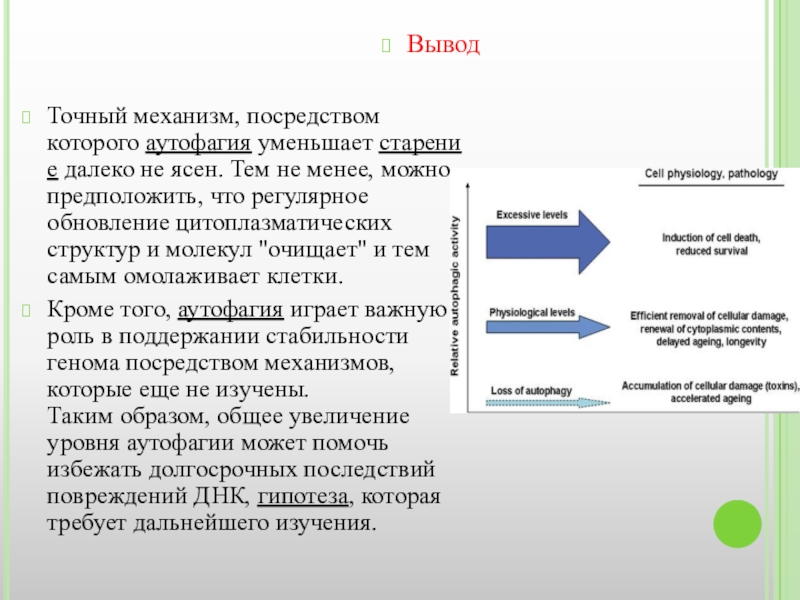
Слайд 27Точный механизм, посредством которого аутофагия уменьшает старение далеко не ясен. Тем не менее, можно предположить,
Кроме того, аутофагия играет важную роль в поддержании стабильности генома посредством механизмов, которые еще не изучены. Таким образом, общее увеличение уровня аутофагии может помочь избежать долгосрочных последствий повреждений ДНК, гипотеза, которая требует дальнейшего изучения.
Вывод











![Презентация по биологии Апоптоз и аутофагия Этот комплекс негативно регулируются белками Bcl-2 / X L. Vps34 производит Этот комплекс негативно регулируются белками Bcl-2 / X L. Vps34 производит фосфатидилинозитол - 3-фосфат [PtdIns (3) P],](/img/tmb/6/503427/8e3e3ae0a1fe1a5b7ab64785d1a45244-800x.jpg)