Васильевна
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по биологии 9 и 10 класс Белки. Строение и функции белков
Содержание
- 1. Презентация по биологии 9 и 10 класс Белки. Строение и функции белков
- 2. БелкиБелки́ (протеи́ны, полипепти́ды) — высокомолекулярные органические вещества,
- 3. Белки — важная часть
- 4. Белки были выделены в
- 5. В состав многих белков помимо пептидных цепей
- 6. Схематическое изображение образования пептидной связи в
- 7. Первичная структура — последовательность аминокислот в полипептидной
- 8. Функции белков.
- 9. Спасибо за внимание!
БелкиБелки́ (протеи́ны, полипепти́ды) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью аминокислот. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций
Слайд 2Белки
Белки́ (протеи́ны, полипепти́ды) — высокомолекулярные органические вещества, состоящие из соединённых в
цепочку пептидной связью аминокислот.
В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций дают большое разнообразие свойств молекул белков.
Хотя на первый взгляд может показаться, что использование в большинстве белков «всего» 20 видов аминокислот ограничивает разнообразие белковых структур, на самом деле количество вариантов трудно переоценить: для цепочки всего из 5 аминокислот оно составляет уже более 3 миллионов, а цепочка из 100 аминокислот (небольшой белок) может быть представлена более чем в 10в130 степени вариантах. Белки длиной от 2 до нескольких десятков аминокислотных остатков часто называют пептидами, при большей степени полимеризации — белками.
В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций дают большое разнообразие свойств молекул белков.
Хотя на первый взгляд может показаться, что использование в большинстве белков «всего» 20 видов аминокислот ограничивает разнообразие белковых структур, на самом деле количество вариантов трудно переоценить: для цепочки всего из 5 аминокислот оно составляет уже более 3 миллионов, а цепочка из 100 аминокислот (небольшой белок) может быть представлена более чем в 10в130 степени вариантах. Белки длиной от 2 до нескольких десятков аминокислотных остатков часто называют пептидами, при большей степени полимеризации — белками.
Слайд 3 Белки — важная часть питания животных и человека
(основные источники: мясо, птица, рыба, молоко, орехи, бобовые, зерновые; в меньшей степени: овощи, фрукты, ягоды и грибы).
Поскольку в организмах не могут синтезироваться все необходимые аминокислоты и часть из них поступает с белковой пищей.
В процессе пищеварения ферменты разрушают потреблённые белки до аминокислот, которые используются при биосинтезе белков организма или подвергаются дальнейшему распаду для получения энергии.
Поскольку в организмах не могут синтезироваться все необходимые аминокислоты и часть из них поступает с белковой пищей.
В процессе пищеварения ферменты разрушают потреблённые белки до аминокислот, которые используются при биосинтезе белков организма или подвергаются дальнейшему распаду для получения энергии.
Значение белков в жизнедеятельности организмов
Слайд 4 Белки были выделены в отдельный класс биологических молекул
в XVIII веке в результате работ французского химика Антуана Фуркруа и других учёных, в которых было отмечено свойство белков коагулировать (денатурировать) под воздействием нагревания или кислот. В то время были исследованы такие белки, как альбумин («яичный белок»), фибрин (белок из крови) и глютен (из зерна пшеницы).
История открытия белков
Слайд 5В состав многих белков помимо пептидных цепей входят и неаминокислотные фрагменты,
по этому критерию белки делят на две большие группы — простые и сложные белки (протеиды). Простые белки содержат только аминокислотные цепи, сложные белки содержат также неаминокислотные фрагменты. Среди сложных белков выделяют следующие классы:
Гликопротеиды, содержащие в качестве простетической группы ковалентно связанные углеводные остатки и их подкласс — протеогликаны. Большая часть внеклеточных белков, в частности, иммуноглобулины — гликопротеиды. В протеогликанах углеводная часть составляет ~95 %, они являются основным компонентом межклеточного матрикса.
Липопротеиды, содержащие в качестве простетической части липиды. Липопротеиды выполняют функцию транспорта липидов.
Металлопротеиды, содержащие связанные ионы металлов ( меди, марганца, железа и других металлов). Выполняют транспортные функции.
Нуклеопротеиды, содержащие ДНК или РНК, в частности, хроматин, из которого состоят хромосомы, является нуклеопротеидом.
Фосфопротеиды, содержащие в качестве простетической группы ковалентно связанные остатки фосфорной кислоты.
Хромопротеиды — собирательное название сложных белков К ним относится множество белков с металлсодержащей порфириновой простетической группой, выполняющие разнообразные функции — гемопротеины (белки, содержащие в качестве простетической группы гем — гемоглобин, цитохромы и др.), хлорофиллы и т.д.
Гликопротеиды, содержащие в качестве простетической группы ковалентно связанные углеводные остатки и их подкласс — протеогликаны. Большая часть внеклеточных белков, в частности, иммуноглобулины — гликопротеиды. В протеогликанах углеводная часть составляет ~95 %, они являются основным компонентом межклеточного матрикса.
Липопротеиды, содержащие в качестве простетической части липиды. Липопротеиды выполняют функцию транспорта липидов.
Металлопротеиды, содержащие связанные ионы металлов ( меди, марганца, железа и других металлов). Выполняют транспортные функции.
Нуклеопротеиды, содержащие ДНК или РНК, в частности, хроматин, из которого состоят хромосомы, является нуклеопротеидом.
Фосфопротеиды, содержащие в качестве простетической группы ковалентно связанные остатки фосфорной кислоты.
Хромопротеиды — собирательное название сложных белков К ним относится множество белков с металлсодержащей порфириновой простетической группой, выполняющие разнообразные функции — гемопротеины (белки, содержащие в качестве простетической группы гем — гемоглобин, цитохромы и др.), хлорофиллы и т.д.
Классификация белков
Слайд 6Схематическое изображение образования
пептидной связи в молекуле белка.
Подобная реакция
происходит в молекулярной машине по образованию белка — рибосоме.
При образовании белка в результате взаимодействия α-аминогруппы (-NH2)(основные свойства) одной аминокислоты с α-карбоксильной группой (-COOH)( кислотные свойства) другой аминокислоты образуются пептидные связи. Концы белка называют C- и N-концом (в зависимости от того, какая из групп концевой аминокислоты свободна: -COOH или -NH2, соответственно). При синтезе белка на рибосоме новые аминокислоты присоединяются к C-концу, поэтому название пептида или белка даётся путём перечисления аминокислотных остатков начиная с N-конца.
В ходе реакции полимеризации выделяется молекула воды. Наличие в молекуле аминокислоты основной и кислотных групп обуславливает амфотерность и высокую реактивность .
Последовательность аминокислот в белке соответствует информации, содержащейся в гене данного белка. Эта информация представлена в виде последовательности нуклеотидов, причём одной аминокислоте соответствует в ДНК последовательность из трёх нуклеотидов — так называемый триплет или кодон.
При образовании белка в результате взаимодействия α-аминогруппы (-NH2)(основные свойства) одной аминокислоты с α-карбоксильной группой (-COOH)( кислотные свойства) другой аминокислоты образуются пептидные связи. Концы белка называют C- и N-концом (в зависимости от того, какая из групп концевой аминокислоты свободна: -COOH или -NH2, соответственно). При синтезе белка на рибосоме новые аминокислоты присоединяются к C-концу, поэтому название пептида или белка даётся путём перечисления аминокислотных остатков начиная с N-конца.
В ходе реакции полимеризации выделяется молекула воды. Наличие в молекуле аминокислоты основной и кислотных групп обуславливает амфотерность и высокую реактивность .
Последовательность аминокислот в белке соответствует информации, содержащейся в гене данного белка. Эта информация представлена в виде последовательности нуклеотидов, причём одной аминокислоте соответствует в ДНК последовательность из трёх нуклеотидов — так называемый триплет или кодон.
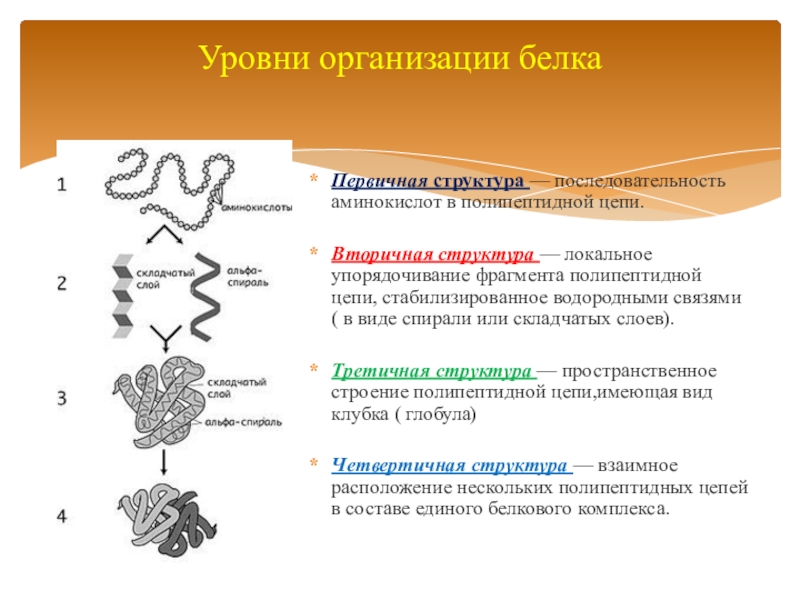
Слайд 7
Первичная структура — последовательность аминокислот в полипептидной цепи.
Вторичная структура — локальное
упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями ( в виде спирали или складчатых слоев).
Третичная структура — пространственное строение полипептидной цепи,имеющая вид клубка ( глобула)
Четвертичная структура — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
Третичная структура — пространственное строение полипептидной цепи,имеющая вид клубка ( глобула)
Четвертичная структура — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
Уровни организации белка