- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Интегрированный урок по химии и биологии Белки – природные высокомолекулярные вещества, свойства белков, их биологические функции
Содержание
- 1. Интегрированный урок по химии и биологии Белки – природные высокомолекулярные вещества, свойства белков, их биологические функции
- 2. Цели урока:проследить взаимосвязь строения белков с их
- 3. Девиз урока. « ... С полным основанием
- 4. «Жизнь – это способ существования белковых тел,
- 5. Определение, данное Ф.Энгельсом, в научной работе «АнтиДюринг»
- 6. История открытия белков В 1754 году Я. Беккари из пшеничной муки выделил клейкую массу – клейковину.
- 7. Гипотеза: между остатками аминокислот в молекуле белка существует пептидная связь (1888 г.)А. Данилевский
- 8. Э. Фишер и Ф. Гофмейстер Аминокислоты в
- 9. Фредерик СенгерУстановил структуру первого белка – инсулина (1953 г.)
- 10. Экспресс-тест по теме «Белки»Белки это биополимеры, мономерами
- 11. В клетках встречается свыше 170 кислот, но
- 12. Активный центр фермента – это липид.Гистоны входят
- 13. Аминокислота – амфотерное соединение.Амилаза катализирует гидролиз белков.Гемоглобин – это белок четвертичной структуры.
- 14. Анаболические реакции – это реакции синтеза.Дисульфидные мостики
- 15. Видео
- 16. Классификация белковПротеины -простые белки:АльбуминыГлобулиныПроламиныГлютелидыСклеропротеины Глобулярные белкиПротеиды- сложные белки:НуклеопротеидыФосфорпротеидыХромопротеиды Гликопротеиды ЛипопротеидыФибриллярные белки
- 17. Слайд 17
- 18. Слайд 18
- 19. Слайд 19
- 20. Физические свойстваБелки могут иметь различные размеры и
- 21. Оптические свойства коллоидных систем
- 22. Светорассеяние или эффект ТиндаляЕсли на коллоидный
- 23. Белки - амфолитыВ зависимости от pH среды
- 24. Пенообразование Пенообразование – это способность белков образовывать высококонцентрированные
- 25. Гидролиз белков Одно из важных свойств
- 26. Гидролиз белков Гидролиз белков происходит в желудке. Чистый
- 27. Результаты исследования желудочного сока на белок куриного яйца
- 28. Слайд 28
- 29. Слайд 29
- 30. Гидролиз трипептида
- 31. Денатурация – нарушение природной (нативной) структуры
- 32. РенатурацияРенатурация – обратимый процесс, т.е. восстановление физико-химических
- 33. 1. Ксантопротеиновая – взаимодействие с концентрированной азотной
- 34. физкультминутка
- 35. К. Линдерстрём-ЛангВвёл понятие о четырёх уровнях внутримолекулярной организации белков (начало XX в.)
- 36. Слайд 36
- 37. Биологические функции белков
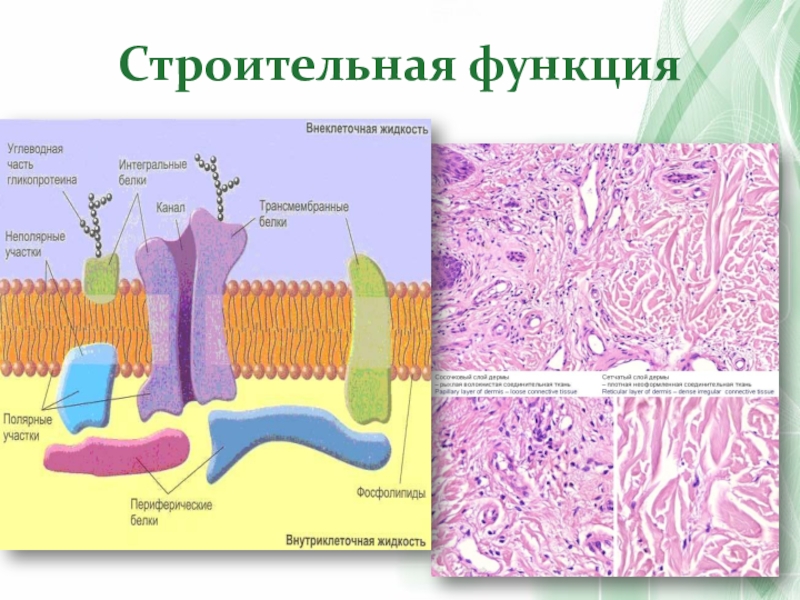
- 38. Строительная функция
- 39. Слайд 39
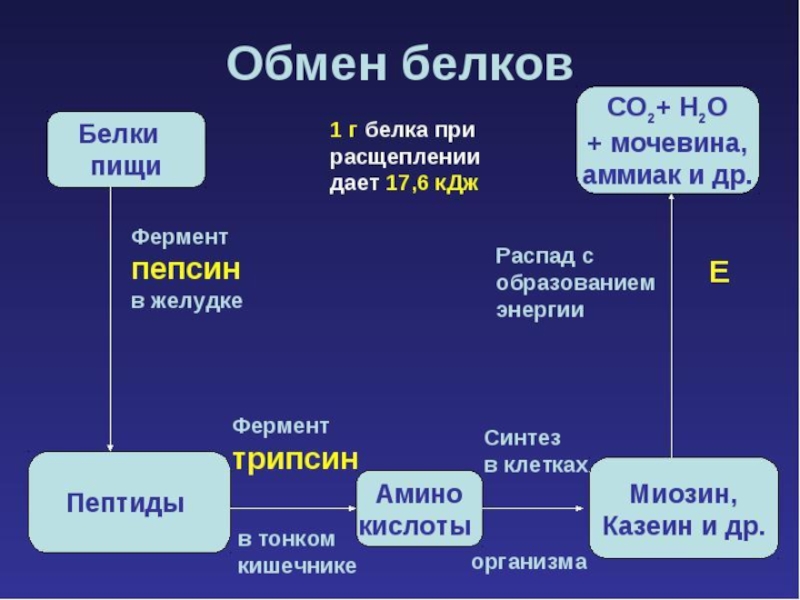
- 40. Энергетическая функция При распаде 1 грамма белков выделяется 17,6 кДж энергии
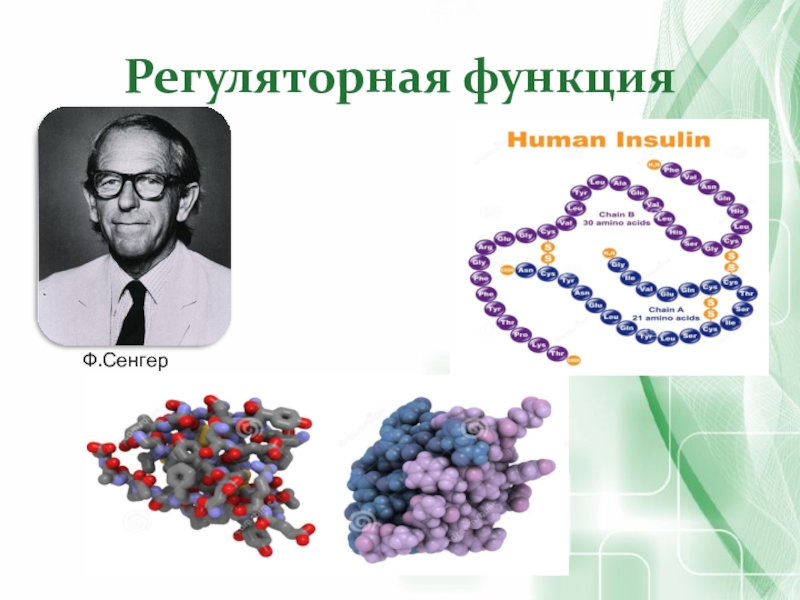
- 41. Регуляторная функцияФ.Сенгер
- 42. Двигательная функция
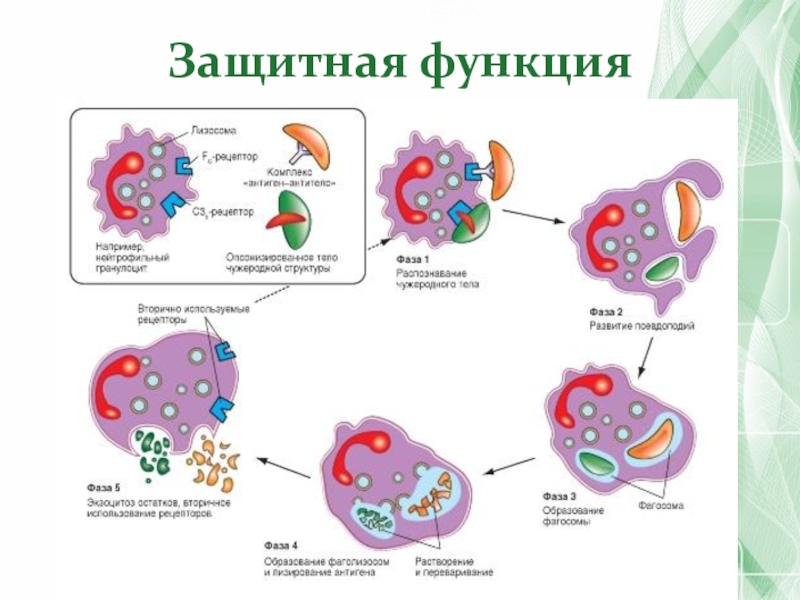
- 43. Защитная функция
- 44. Вирус иммунодефицита человека
- 45. Джеймс СамнерКаталитическая функция
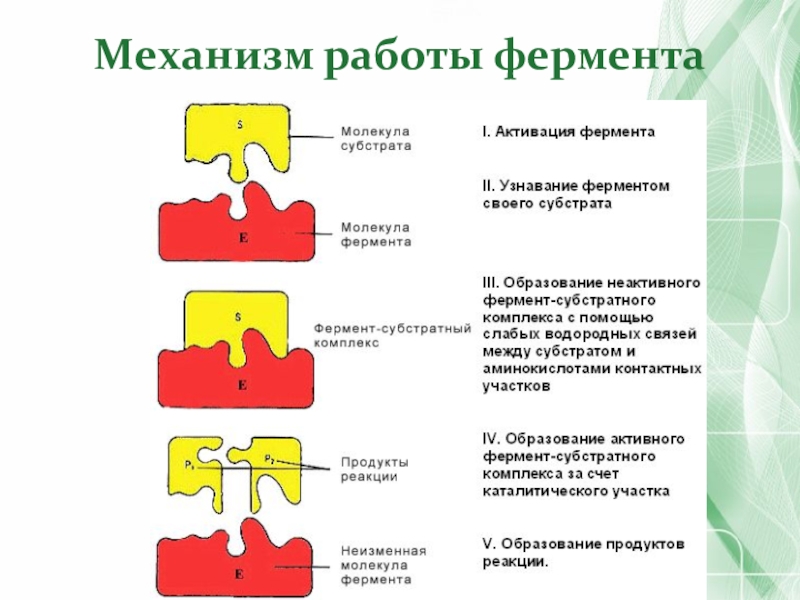
- 46. Механизм работы фермента
- 47. Классификация ферментовА) оксидоредуктазыБ) трансферазыВ) гидролазыГ) лиазыД) изомеразыЕ)
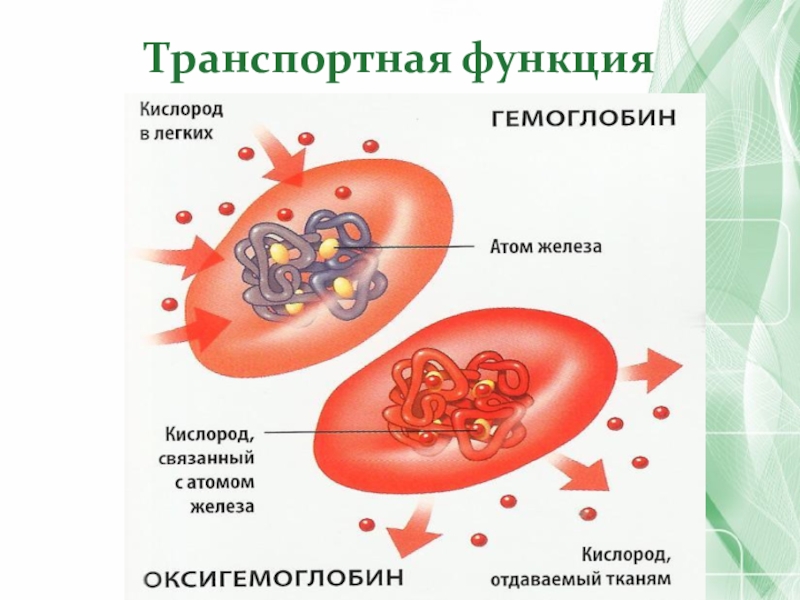
- 48. Транспортная функция
- 49. Функции белков
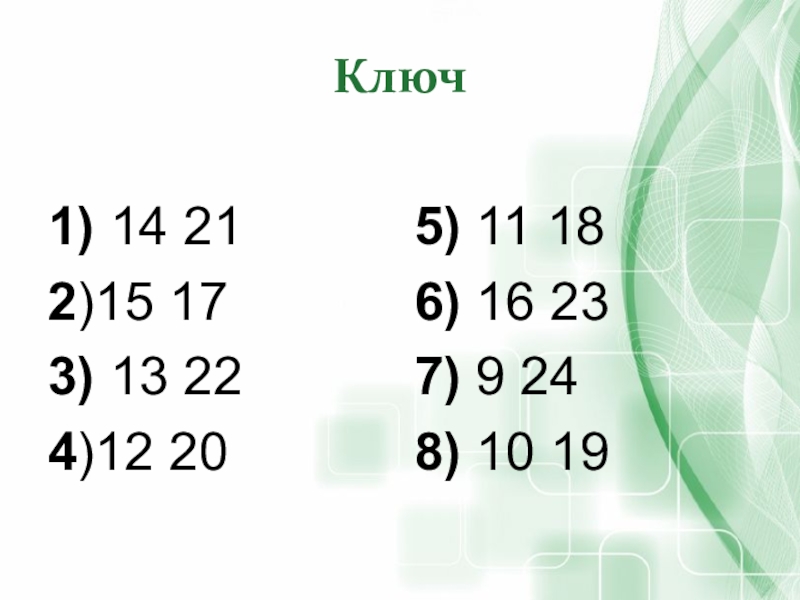
- 50. Ключ1) 14 212)15 173) 13 224)12 205) 11 186) 16 237) 9 248) 10 19
- 51. Слайд 51
- 52. Аминокислоты.Молекула белка состоит из 20 аминокислот, которые
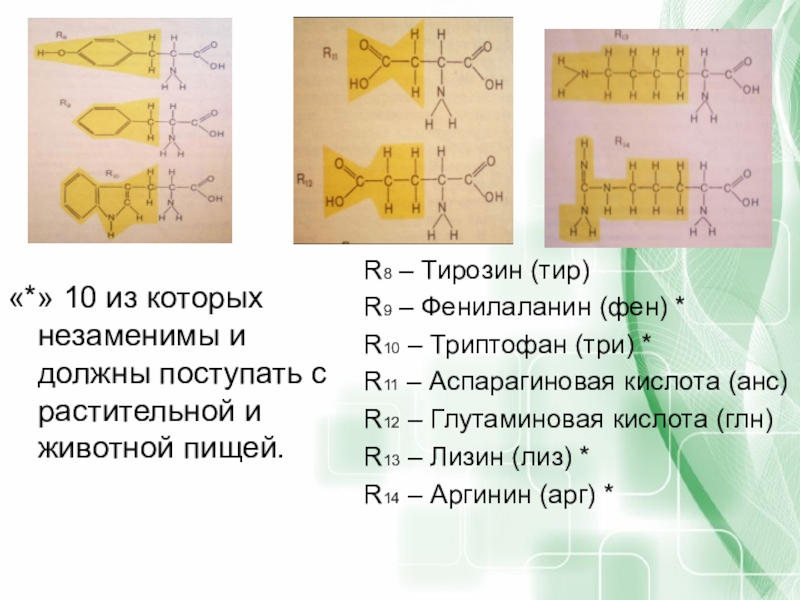
- 53. «*» 10 из которых незаменимы и должны
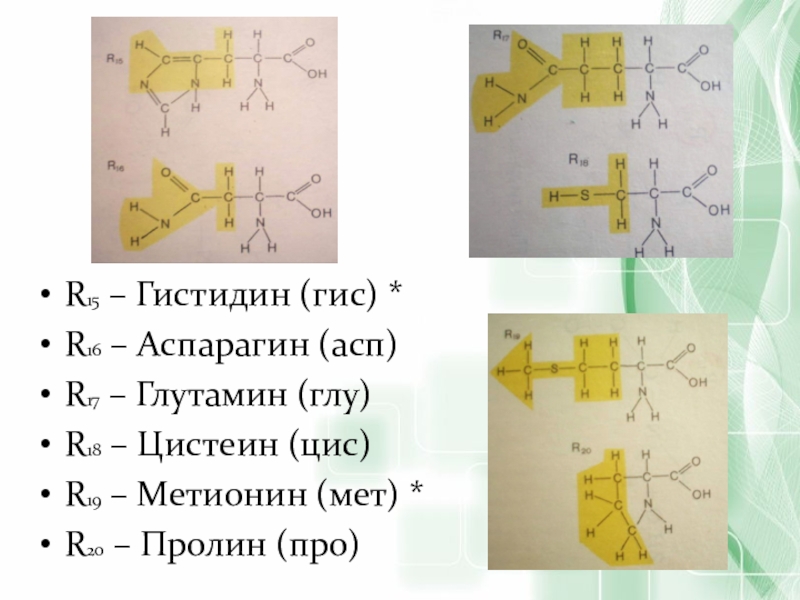
- 54. R15 – Гистидин (гис) *R16 – Аспарагин
- 55. Слайд 55
- 56. Белки и пища
- 57. Слайд 57
- 58. Потребность человека в белкахВ питании младенцев белки
- 59. Основные продукты с высоким содержанием белкаЯйца
- 60. Фрукты – источники растительного белка
- 61. Проблемы, возникающие при недостатке белказамедление роста
- 62. Избыток белка в организмеПревышение потребления в 1,7
- 63. Рекомендации Не употреблять полуфабрикаты и мясные продукты
- 64. Основное правило при выборе белковой пищиВыбирать продукты необходимо с низким содержанием жира и с высоким белка.
- 65. Будьте здоровы и красивы!
- 66. Новости науки Интересные факты про аминокислоты
- 67. Самый большой белок в нашем организме по
- 68. Умный инсулин
- 69. Слайд 69
Слайд 1Интегрированный урок в 11 классе
ХИМИЯ и БИОЛОГИЯ
Белки – природные высокомолекулярные вещества,
Слайд 2Цели урока:
проследить взаимосвязь строения белков с их свойствами и функциями как
выявить связь питания человека с его здоровьем.
Задачи урока:
расширить знания учащихся о природных высокомолекулярных веществах – белках;
формировать способность к самостоятельному приобретению знаний;
развивать умения делать выводы на основе сравнения;
работать с дополнительной литературой, реактивами;
выявить взаимосвязь биологии и химии.
развивать мышление учащихся через установление причинно-следственных связей: состав – строение – свойства – применение вещества.
Слайд 3Девиз урока.
« ... С полным основанием можно считать, что белки
Лайнус Полинг
Слайд 4
«Жизнь – это способ существования белковых тел, существенным моментом которого является
Фридрих Энгельс
Слайд 5Определение, данное Ф.Энгельсом, в научной работе «АнтиДюринг» позволяет задуматься над тем,
Слайд 6История открытия белков
В 1754 году Я. Беккари из пшеничной муки выделил
Слайд 7Гипотеза: между остатками аминокислот в молекуле белка существует пептидная связь (1888
А. Данилевский
Слайд 8Э. Фишер и Ф. Гофмейстер
Аминокислоты в молекуле белка связаны за счёт
Э. Фишер
Слайд 10Экспресс-тест по теме «Белки»
Белки это биополимеры, мономерами которых являются нуклеотиды.
Аминокислоты имеют
Содержание белков в различных клетках может колебаться от 50% до 80%
Слайд 11В клетках встречается свыше 170 кислот, но «волшебными» называются всего 18
Вторичная структура белка представлена спиралью или складчатым слоем.
Все белки – это ферменты.
Слайд 12
Активный центр фермента – это липид.
Гистоны входят в состав хромосом.
Денатурация –
Слайд 13
Аминокислота – амфотерное соединение.
Амилаза катализирует гидролиз белков.
Гемоглобин – это белок четвертичной
Слайд 14Анаболические реакции – это реакции синтеза.
Дисульфидные мостики – это связи между
Среди белков различают протеины и протеиды.
Слайд 16Классификация белков
Протеины -простые белки:
Альбумины
Глобулины
Проламины
Глютелиды
Склеропротеины
Глобулярные белки
Протеиды- сложные белки:
Нуклеопротеиды
Фосфорпротеиды
Хромопротеиды
Гликопротеиды
Липопротеиды
Фибриллярные белки
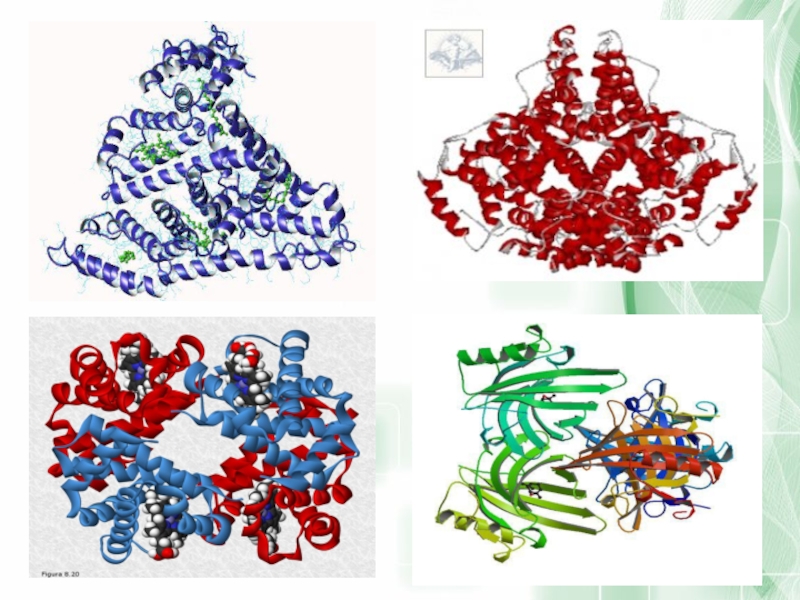
Слайд 20Физические свойства
Белки могут иметь различные размеры и форму. Молекулярная масса белков
электроноскопии;
рентгеноструктурного анализа комплексов белков с тяжёлыми металлами.
Многие белки существуют в виде кристаллов. Большинство белков образуют коллоидные растворы, доказательством чего служит их способность рассеивать свет – эффект Тиндаля.
Слайд 22Светорассеяние или
эффект Тиндаля
Если на коллоидный раствор направить пучок света, то
Это явление называется опалесценцией или конусом Тиндаля
Слайд 23Белки - амфолиты
В зависимости от pH среды белки могут вести себя
При определении значения pH среды число положительных и отрицательных зарядов в молекуле одинаково. Такое значение pH называют изоэлектрической точкой.
В этой точке белки электронейтральны, а их вязкость и растворимость наименьшие.
Слайд 24Пенообразование
Пенообразование – это способность белков образовывать высококонцентрированные системы, «жидкость – газ»
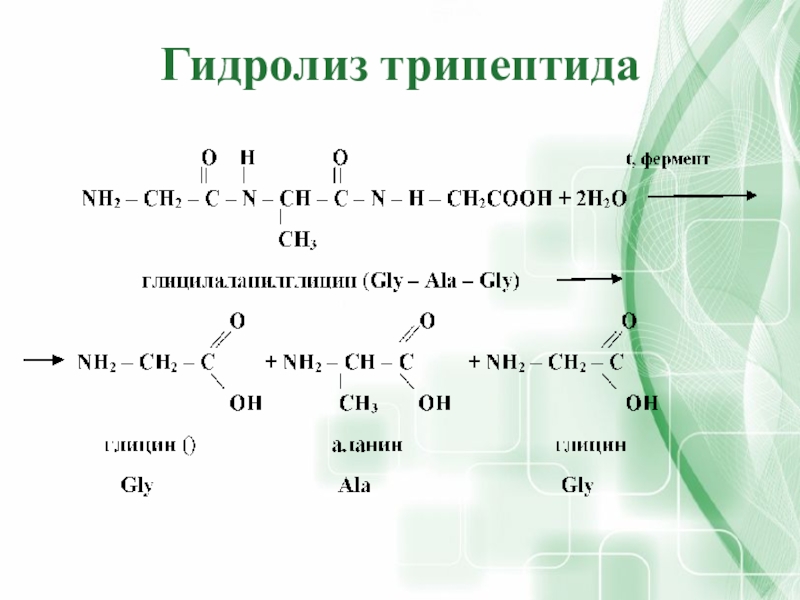
Слайд 25Гидролиз белков
Одно из важных свойств белков– это гидролиз. Гидролиз
В лабораторных условиях гидролиз проводят в присутствии кислот и щелочей при нагревании. Щелочной гидролиз проводят гидроксидом бария Ba(OH)2, реакция с ним происходит быстрее, кроме того, он не разрушает триптофан. В организме происходят процессы ферментативного гидролиза.
Слайд 26Гидролиз белков
Гидролиз белков происходит в желудке. Чистый желудочный сок – это
Слайд 31 Денатурация – нарушение природной (нативной) структуры белка.
Денатурация – это сложный
Слайд 32Ренатурация
Ренатурация – обратимый процесс, т.е. восстановление физико-химических и биологических свойств белка.
Иногда для этого достаточно удалить денатурирующий объект.
Ренатурация невозможна, если затронута первичная структура белка.
Слайд 331. Ксантопротеиновая – взаимодействие с концентрированной азотной кислотой, которое сопровождается появлением
2. Биуретовая – взаимодействие слабощелочных растворов белков с раствором сульфата меди (II), в результате которой появляется фиолетово-синяя окраска.
Цветные реакции на белки
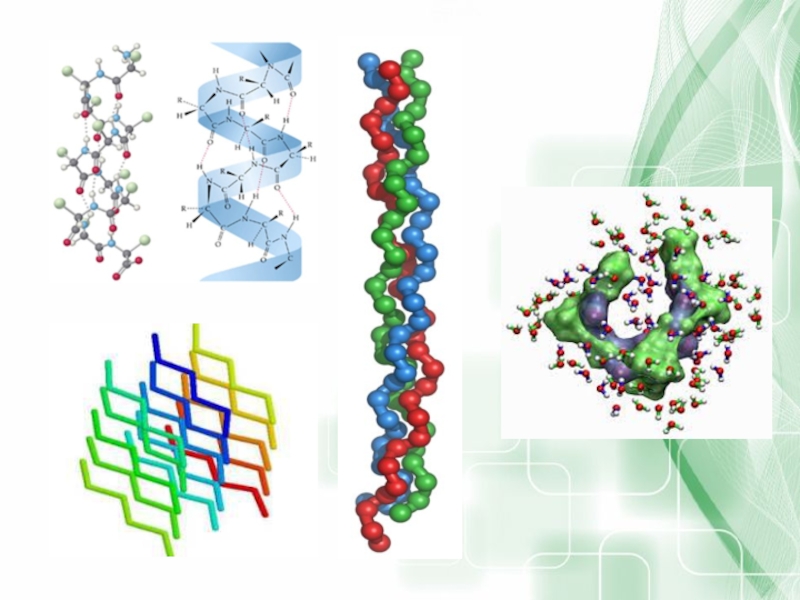
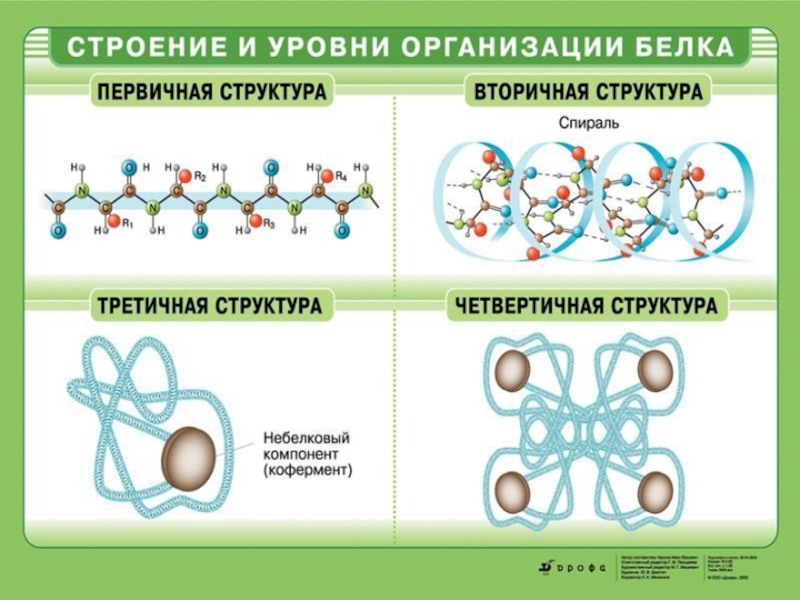
Слайд 35К. Линдерстрём-Ланг
Ввёл понятие о четырёх уровнях внутримолекулярной организации белков (начало XX
Слайд 47Классификация ферментов
А) оксидоредуктазы
Б) трансферазы
В) гидролазы
Г) лиазы
Д) изомеразы
Е) лигазы
1) участвуют в расщеплении органических веществ с помощью воды
2)ответственны за реакции окисления и восстановления
3) переносят определённые группы атомов с одной молекулы на другую
4) расщепление веществ без участия воды
5) катализируют реакции соединения двух молекул, используя энергию АТФ
6) способствуют внутренним , в том числе, пространственным изменениям
Слайд 49Функции белков
Распределите цифры по
Слайд 52Аминокислоты.
Молекула белка состоит из
20 аминокислот, которые
разнообразно чередуются.
R1 - Глицин
R2 – Аланин (ала)
R3 – Валин (вал) *
R4 – Лейцин (лей) *
R5 – Изолейцин (илей) *
R6 – Серин (сер)
R7 – Треонин (тре) *
Слайд 53«*» 10 из которых незаменимы и должны поступать с растительной и
R8 – Тирозин (тир)
R9 – Фенилаланин (фен) *
R10 – Триптофан (три) *
R11 – Аспарагиновая кислота (анс)
R12 – Глутаминовая кислота (глн)
R13 – Лизин (лиз) *
R14 – Аргинин (арг) *
Слайд 54R15 – Гистидин (гис) *
R16 – Аспарагин (асп)
R17 – Глутамин (глу)
R18
R19 – Метионин (мет) *
R20 – Пролин (про)
Слайд 58Потребность человека в белках
В питании младенцев белки составляют 100% рациона (молоко
у детей от года до 3-х лет – 75%;
от 3 лет до завершения роста (20 лет) – не менее 50 %;
у взрослого человека в среднем 14%;
для женщины в период беременности и кормления грудью эта цифра возрастает до 70% от суточной нормы.
Слайд 59 Основные продукты с высоким содержанием белка
Яйца – 17%
Творог –
Сыр - 30%
Мясо птицы – 15-20%
Говядина – 25%
Печень – 25%
Рыба – 15-25% в зависимости от вида
Соя – 14%
Брюссельская капуста – 9%
Крупы – 10-12%
Слайд 61Проблемы, возникающие
при недостатке белка
замедление роста и развития детей;
у взрослых -
ухудшение памяти, снижение работоспособности, ослабление иммунитета из-за снижения уровня образования антител, авитаминоз;
ослабление сердечной и дыхательной системы, потеря мышечной массы.
Слайд 62Избыток белка в организме
Превышение потребления в 1,7 г на килограмм веса:
провоцирует
может вызвать развитие подагры;
избыток белка перегружает пищеварительную систему,
способствует ухудшению аппетита, повышенной возбудимости центральной нервной системы, а также желез внутренней секреции.
накапливаются жировые отложения в печени,
страдает сердечнососудистая система, печень и почки, нарушается витаминный обмен.
Слайд 63Рекомендации
Не употреблять полуфабрикаты и мясные продукты длительного хранения (колбаса, сосиски,
Не злоупотреблять жирными сортами мяса и рыбы.
Больше есть мясо птицы, яйца, нежирную говядину, растительные белки.
Не соединять белки с углеводами, лучшим добавлением будет овощной салат.
Белковую пищу необходимо употреблять вечером до 18.00 часов.
Предпочтительные белковые продукты: яичный белок, обезжиренный творог, нежирные сорта сыра, нежирная свежая рыба и морепродукты, молодая баранина, нежирная телятина, куры, индейка(мясо без кожицы), соевое молоко, соевое мясо.
Слайд 64Основное правило при выборе белковой пищи
Выбирать продукты необходимо с низким содержанием
Слайд 66
Новости науки
Интересные факты про аминокислоты и белки:
Во время стресса, нужны обязательно
Слайд 67Самый большой белок в нашем организме по аминокислотной цепочке – титин,
В течение 5-6 месяцев происходит полная замена собственных белков человека.
Белки просто необходимы тем, кто простыл. В это время потребность организма в белках увеличивается примерно на 30-40%.
Белки могут сделать нас счастливыми. Гормон удовольствия – серотонин образуется из аминокислоты триптофана.