- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Естествознание. Лекция для студентов СПО
Содержание
- 1. Презентация. Естествознание. Лекция для студентов СПО
- 2. Вода вокруг нас.
- 3. Воде принадлежит огромная роль в природе. В
- 4. Все живое состоит из воды и органических
- 5. В первичной водной оболочке земного шара воды
- 6. Большими хранилищами влаги являются и ледники, в
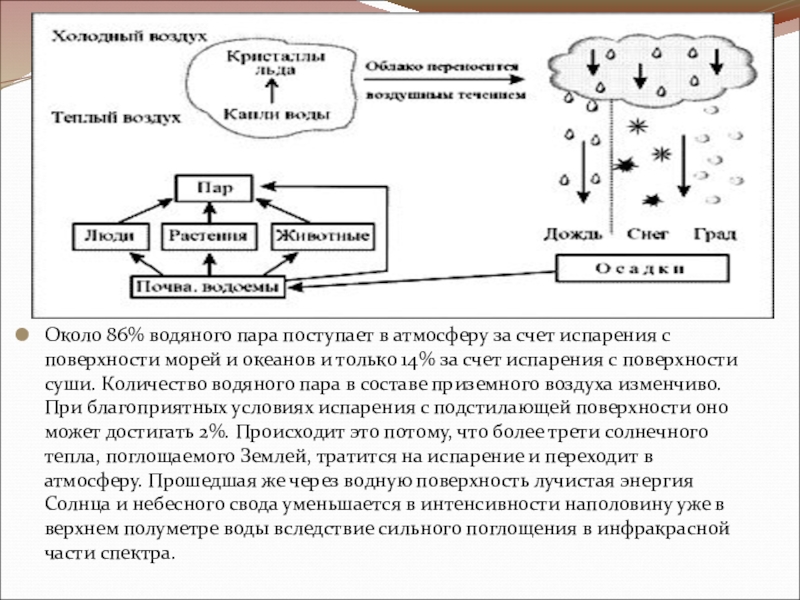
- 7. Около 86% водяного пара поступает в атмосферу
- 8. При замерзании чистая вода расширяется почти на
- 9. Морская вода замерзает при температуре – 1,91°C.
- 10. Иногда вода замерзает при положительной температуре. Такое
- 11. Известно, что молекулы, находящиеся на поверхности жидкости,
- 12. Слайд 12
- 13. Слайд 13
- 14. Слайд 14
- 15. В природе существует шесть изотопов кислорода. Три
- 16. Температура ее замерзания 3,8°C, температура кипения 101,42°C
- 17. Оптические свойства воды и льда. Не все
- 18. Существенную роль в жизни растений играют оптические
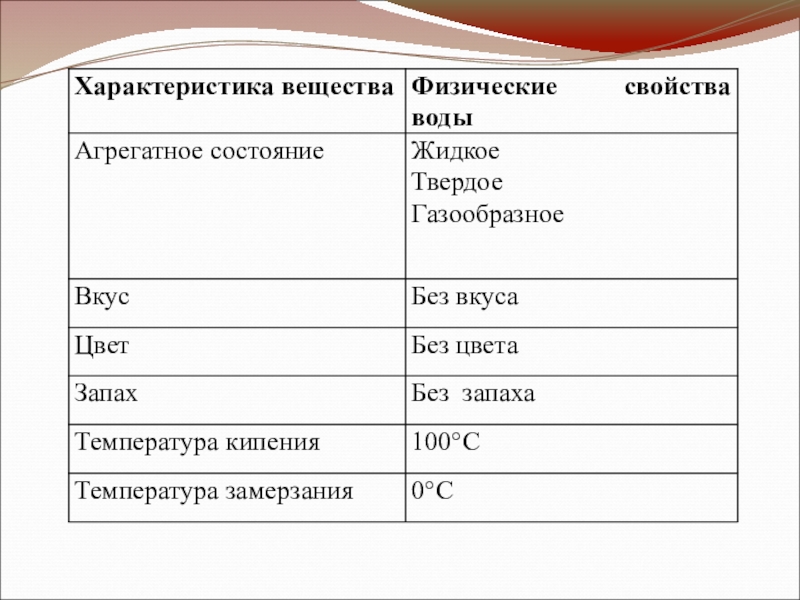
- 19. Зная физические свойства воды и льда, человек
- 20. Без воды не было бы на Земле ни жизни, ни производства.
- 21. Химические свойства1. Взаимодействие с металлами:С активными металламиС
- 22. Растворение жидких,твердых веществ и газов. Раство́р — гомогенная
- 23. Твёрдые, жидкие, газообразные растворыЧаще под раствором подразумевается
- 24. Растворы электролитов и неэлектролитовЭлектролиты — вещества, проводящие в
- 25. Растворы полимеровРастворы высокомолекулярных веществ ВМСРастворы высокомолекулярных веществ
- 26. Эму́льсия (новолат. emulsio; от лат. emulgeo — дою, выдаиваю) — дисперсная
- 27. Суспе́нзия (мука в воде) — смесь веществ, где
- 28. Гели состоят, по крайней мере, из двух
- 29. Золь иначе лиозоль; коллоидный раствор— высокодисперсная коллоидная
- 30. Нанодисперсия, наноэмульсия или наножидкость — это жидкость, содержащая
- 31. Слайд 31
- 32. Выбор одного ответа:А1 Вода играет большую роль
- 33. Выберите верные ответыА2 Вода - основа жизни:а) она
- 34. Выбор одного ответаА3 . Вещества, хорошо растворимые в воде, называются: а)гидрофильные, б) гидрофобные, в) амфифильные.
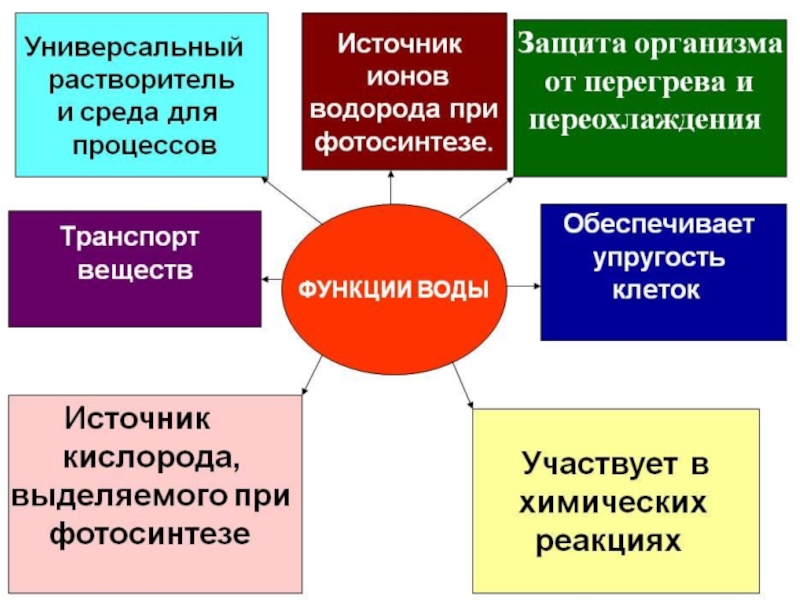
- 35. Выбор одного ответаА4 Функции воды в клетке:а) хранение и передача наследственной информации;б) торможение химических реакций;в) растворитель;г) энергетическая функция.
- 36. Выбрать 3 верных ответа: В 1. Какие
- 37. Развернутый ответС 1. Какое свойство воды делает ее универсальным растворителем для полярных веществ?
- 38. С 2. Найдите ошибки в приведенном тексте.
- 39. Ответы:С1. Какое свойство воды делает ее универсальным
- 40. С 2 Найдите ошибки в приведенном тексте.
- 41. Вода! Ты не просто необходима для жизни, ты и есть сама жизни. А.де Сент-Экзюпери
Слайд 1Неорганические вещества клетки. Вода. Лекция №1 по естествознанию.
Любовникова Е.В. Преподаватель
Слайд 3Воде принадлежит огромная роль в природе. В самом деле, ведь именно
Слайд 4Все живое состоит из воды и органических веществ. Без воды человек,
Слайд 5В первичной водной оболочке земного шара воды было гораздо меньше, чем
Слайд 6
Большими хранилищами влаги являются и ледники, в них сосредоточено до 2,1%
Слайд 7
Около 86% водяного пара поступает в атмосферу за счет испарения с
Слайд 8
При замерзании чистая вода расширяется почти на 10%, у морского льда
Слайд 9
Морская вода замерзает при температуре – 1,91°C. При дальнейшем понижении температуры
Слайд 10
Иногда вода замерзает при положительной температуре. Такое явление наблюдается в трубопроводах
Снежинки, как правило, бывают в виде шести- и двенадцатилучевых звездочек, шестиугольных пластинок, шестигранных призм. При понижении температуры воздуха уменьшаются размеры образующихся кристаллов и возрастает разнообразие их форм. Особенности роста кристаллов в воздухе связаны с наличием в нем водяного пара.
Слайд 11
Известно, что молекулы, находящиеся на поверхности жидкости, имеют избыток потенциальной энергии
Среди существующих в природе жидкостей поверхностное натяжение воды уступает только ртути. С поверхностным натяжением воды связано ее сильное смачивающее действие (способность «прилипать» к поверхности многих твердых тел). Кроме того, вода является универсальным растворителем. Теплота ее испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку.
Слайд 15В природе существует шесть изотопов кислорода. Три из них радиоактивны. Стабильными
Как известно, молекула воды состоит из двух атомов водорода и одного атома кислорода. В составе обычной воды H2O имеется небольшое количество тяжелой воды D2O и совсем незначительное количество сверхтяжелой воды T2O. В молекулу тяжелой воды вместо обыкновенного водорода H – протия входит его тяжелый изотоп D – дейтерий, в состав молекулы сверхтяжелой воды входит еще более тяжелый изотоп водорода Т – тритий. В природной воде на 1 000 молекул H2O приходится две молекулы D2O и на одну молекулу T2O – 1019 молекул H2O.
Тяжелая вода D2O бесцветна, не имеет ни запаха, ни вкуса и живыми организмами не усваивается.
Слайд 16Температура ее замерзания 3,8°C, температура кипения 101,42°C и температура наибольшей плотности
В молекулу тяжелой воды вместо обыкновенного водорода H – протия входит его тяжелый изотоп D – дейтерий, в состав молекулы сверхтяжелой воды входит еще более тяжелый изотоп водорода Т – тритий. В природной воде на 1 000 молекул H2O приходится две молекулы D2O и на одну молекулу T2O – 1019 молекул H2O.
Тяжелая вода D2O бесцветна, не имеет ни запаха, ни вкуса и живыми организмами не усваивается.
Слайд 17Оптические свойства воды и льда. Не все знают, что вода прозрачна
Не весь солнечный свет поглощается водой. Вода отражает 5% солнечных лучей, в то время как снег – около 85%. Под лед океана проникает только 2% солнечного света.
Слайд 18Существенную роль в жизни растений играют оптические свойства водяного пара. Дело
Слайд 19Зная физические свойства воды и льда, человек давно использует их в
Слайд 21Химические свойства
1. Взаимодействие с металлами:
С активными металлами
С менее активными металлами
С неактивными
2. Взаимодействие с неметаллами
3. Взаимодействие с оксидами
С оксидами металлов
С оксидами неметаллов
Слайд 22Растворение жидких,твердых веществ и газов.
Раство́р — гомогенная (однородная) смесь, состоящая из
Растворитель — компонент, агрегатное состояние которого не изменяется при образовании раствора. В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твёрдого вещества с твёрдым, растворителем считается компонент, количество которого в растворе преобладает.
Образование того или иного типа раствора обусловливается интенсивностью межмолекулярного, межатомногоОбразование того или иного типа раствора обусловливается интенсивностью межмолекулярного, межатомного, межионного или другого вида взаимодействия, то есть, теми же силами, которые определяют возникновение того или иного агрегатного состояния. Отличия: образование раствора зависит от характера и интенсивности взаимодействия частиц разных веществ.
По сравнению с индивидуальными веществами по структуре растворы сложнее.
Растворы бывают газовыми, жидкими и твёрдыми.
Слайд 23
Твёрдые, жидкие, газообразные растворы
Чаще под раствором подразумевается жидкое веществоЧаще под раствором
Существуют также растворы газов в жидкостях, газов в газах и жидкостей в жидкостях, в последнем случае растворителем считается вода, или же компонент, которого больше.
В химической практике обычно под растворами понимают гомогенные системы, растворитель может быть жидким, твёрдым (твёрдый растворВ химической практике обычно под растворами понимают гомогенные системы, растворитель может быть жидким, твёрдым (твёрдый раствор), газообразным. Однако нередко допускается и микрогетерогенность
«Раствором» именуют и смесь цемента с водой, песком и так далее. Хотя это и не является раствором в химическом смысле этого слова.
Слайд 24
Растворы электролитов и неэлектролитов
Электролиты — вещества, проводящие в расплавах или водных растворах
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам — большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи.
Слайд 25
Растворы полимеров
Растворы высокомолекулярных веществ ВМСРастворы высокомолекулярных веществ ВМС — белковРастворы высокомолекулярных веществ
Слайд 26
Эму́льсия (новолат. emulsio; от лат. emulgeo — дою, выдаиваю) — дисперсная система — дою, выдаиваю) — дисперсная
Эмульсии могут быть образованы двумя любыми несмешивающимися жидкостями; в большинстве случаев одной из фаз эмульсий является вода, а другой - вещество, состоящее из слабополярных молекул (например, жидкие углеводородыЭмульсии могут быть образованы двумя любыми несмешивающимися жидкостями; в большинстве случаев одной из фаз эмульсий является вода, а другой - вещество, состоящее из слабополярных молекул (например, жидкие углеводороды, жирыЭмульсии могут быть образованы двумя любыми несмешивающимися жидкостями; в большинстве случаев одной из фаз эмульсий является вода, а другой - вещество, состоящее из слабополярных молекул (например, жидкие углеводороды, жиры). Например, молокоЭмульсии могут быть образованы двумя любыми несмешивающимися жидкостями; в большинстве случаев одной из фаз эмульсий является вода, а другой - вещество, состоящее из слабополярных молекул (например, жидкие углеводороды, жиры). Например, молоко — одна из первых изученных эмульсий: в нём капли молочного жира распределены в водной среде.
Эмульсии относятся обычно к грубодисперсным системам, поскольку капельки дисперсной фазы имеют размеры от 1 до 50 мкм. Эмульсии низкой концентрации — неструктурированные жидкости. Высококонцентрированные эмульсии — структурированные системы.
Слайд 27
Суспе́нзия (мука в воде) — смесь веществ, где твёрдое вещество распределено в
Суспензия — это грубодисперснаяСуспензия — это грубодисперсная система с твёрдой дисперсной фазой и жидкой дисперсионной средойСуспензия — это грубодисперсная система с твёрдой дисперсной фазой и жидкой дисперсионной средой. Обычно частицы дисперсной фазы настолько велики (более 10 мкм), что оседают под действием силы тяжести (седиментируютСуспензия — это грубодисперсная система с твёрдой дисперсной фазой и жидкой дисперсионной средой. Обычно частицы дисперсной фазы настолько велики (более 10 мкм), что оседают под действием силы тяжести (седиментируют). Суспензии, в которых седиментация идёт очень медленно из-за малой разницы в плотности дисперсной фазы и дисперсионной среды, иногда называют взвесями. В концентрированных суспензиях легко возникают дисперсные структуры. Типичные суспензии — пульпы, буровые промывочные жидкости, цементныеСуспензия — это грубодисперсная система с твёрдой дисперсной фазой и жидкой дисперсионной средой. Обычно частицы дисперсной фазы настолько велики (более 10 мкм), что оседают под действием силы тяжести (седиментируют). Суспензии, в которых седиментация идёт очень медленно из-за малой разницы в плотности дисперсной фазы и дисперсионной среды, иногда называют взвесями. В концентрированных суспензиях легко возникают дисперсные структуры. Типичные суспензии — пульпы, буровые промывочные жидкости, цементные растворы, эмалевые краскиСуспензия — это грубодисперсная система с твёрдой дисперсной фазой и жидкой дисперсионной средой. Обычно частицы дисперсной фазы настолько велики (более 10 мкм), что оседают под действием силы тяжести (седиментируют). Суспензии, в которых седиментация идёт очень медленно из-за малой разницы в плотности дисперсной фазы и дисперсионной среды, иногда называют взвесями. В концентрированных суспензиях легко возникают дисперсные структуры. Типичные суспензии — пульпы, буровые промывочные жидкости, цементные растворы, эмалевые краски. Широко используются в производстве керамики.
Слайд 28
Гели состоят, по крайней мере, из двух компонентов, один из которых
Слайд 29
Золь иначе лиозоль; коллоидный раствор— высокодисперсная коллоидная система (коллоидный раствор) с
В зависимости от дисперсионной среды золи бывают твердыми, аэрозолямиВ зависимости от дисперсионной среды золи бывают твердыми, аэрозолями (газообразная дисперсионная среда) и лиозолями (жидкая дисперсионная среда). В зависимости от природы среды лиозоли называют гидрозолями (вода), органозолями (органическая среда) или, более конкретно, алкозолями (спирты), этерозолями (эфиры) и др. Золи занимают промежуточное положение между истинными растворамиВ зависимости от дисперсионной среды золи бывают твердыми, аэрозолями (газообразная дисперсионная среда) и лиозолями (жидкая дисперсионная среда). В зависимости от природы среды лиозоли называют гидрозолями (вода), органозолями (органическая среда) или, более конкретно, алкозолями (спирты), этерозолями (эфиры) и др. Золи занимают промежуточное положение между истинными растворами и грубодисперсными системами (суспензиямиВ зависимости от дисперсионной среды золи бывают твердыми, аэрозолями (газообразная дисперсионная среда) и лиозолями (жидкая дисперсионная среда). В зависимости от природы среды лиозоли называют гидрозолями (вода), органозолями (органическая среда) или, более конкретно, алкозолями (спирты), этерозолями (эфиры) и др. Золи занимают промежуточное положение между истинными растворами и грубодисперсными системами (суспензиями, эмульсиями).
Частицы дисперсной фазы лиозоля вместе с окружающей их сольватной оболочкой из молекул (ионов) дисперсионной среды называют мицеллами. К лиозолям относятся мицеллярные растворы различных типов, водные растворы биополимеров, органо- и гидрозоли металлов, синтетические латексы.
Примером аэрозоля на основе жидкости является туман — взвесь капель воды в воздухе; находящийся в воздухе дым или пыль — пример твердотельного аэрозоля.
Слайд 30Нанодисперсия, наноэмульсия или наножидкость — это жидкость, содержащая частицы и агломераты — это
Слайд 32Выбор одного ответа:
А1 Вода играет большую роль в жизни клетки, она
1)
2) обеспечивает нормальную кислотность среды
3) ускоряет химические реакции
4) входит в состав мембран
Слайд 33Выберите верные ответы
А2 Вода - основа жизни:
а) она может находиться в трех
б) является растворителем, обеспечивающим как приток веществ в клетку, так и удаление из неё продуктов обмена;
в) охлаждает поверхность при испарении.
Слайд 34Выбор одного ответа
А3 . Вещества, хорошо растворимые в воде, называются:
а)гидрофильные,
б)
в) амфифильные.
Слайд 35Выбор одного ответа
А4 Функции воды в клетке:
а) хранение и передача наследственной информации;
б) торможение
в) растворитель;
г) энергетическая функция.
Слайд 36Выбрать 3 верных ответа:
В 1. Какие функции выполняет в клетке вода?
А)
Б) растворителя
В)каталитическую
Г) запасающую
Д)транспортную
Е) придает клетке упругость
Слайд 37Развернутый ответ
С 1. Какое свойство воды делает ее универсальным растворителем для
Слайд 38
С 2. Найдите ошибки в приведенном тексте. Укажите номера предложений, в
1.Вода — одно из самых распространенных органических веществ на Земле.
2.В клетках костной ткани около 20% воды, а в клетках мозга 85%.
3.Свойства воды определяются структурой ее молекул.
4.Ионные связи между атомами водорода и кислорода обеспечивают полярность молекулы воды и ее способность растворять неполярные соединения.
5. Между атомами кислорода одной молекулы воды и атомом водорода другой молекулы образуется сильная водородная связь, чем объясняется высокая температура кипения воды.
Слайд 39Ответы:
С1. Какое свойство воды делает ее универсальным растворителем для полярных веществ?
Молекула
Слайд 40
С 2 Найдите ошибки в приведенном тексте. Укажите номера предложений, в
Ошибки допущены в предложениях 1, 2, 4, 5.
1 — вода — неорганическое вещество; 2 — в клетках костной ткани около 20% воды, а в клетках мозга-85%; 4 — ковалентные связи; полярные соединения; 5 — слабая водородная связь.
1. Вода — одно из самых распространенных органических веществ на Земле.
2. В клетках костной ткани до 85% воды, а в клетках мозга человека — до 50%.
3. Свойства воды определяются структурой ее молекул.
4. Ионные связи между атомами водорода и кислорода обеспечивают полярность молекулы воды и ее способность растворять неполярные соединения.
5. Между атомами кислорода одной молекулы воды и атомом водорода другой молекулы образуется сильная водородная связь, чем объясняется высокая температура кипения воды.