- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Лекция Аллергия. Иммунные болезни. по учебной дисциплине ОП.08. Основы патологии для студентов медицинского колледжа, специальность 31.02.01. Лечебное дело, уровень подготовки - углублённый, квалификация - фельдшер.
Содержание
- 1. Лекция Аллергия. Иммунные болезни. по учебной дисциплине ОП.08. Основы патологии для студентов медицинского колледжа, специальность 31.02.01. Лечебное дело, уровень подготовки - углублённый, квалификация - фельдшер.
- 2. Понятие об иммунитете.Иммунитет (лат. immunitas — освобождение, избавление от чего-либо) —
- 3. Принято все виды лимфоцитов разделять в зависимости
- 4. Антигены. Это одно из основных понятий в
- 5. Иммунная система. Иммунитет реализуется иммунной системой.Под иммунной системой
- 6. Слайд 6
- 7. Слайд 7
- 8. Красный костный мозг 1. Локализацияа) у взрослых -губчатое
- 9. Тимус (вилочковая, или зобная железа) 1. Локализация - за грудиной.2. Масса: максимальная величина
- 10. Лимфатические узлы Лимфатические узлы располагаются на пути
- 11. Слайд 11
- 12. Дефекы в работе иммунной системы могут проявляться
- 13. Физиологическая иммунная толерантность проявляется переносимостью иммунной системой
- 14. Иммунодефицитом называем состояние, для которого характерно снижение
- 15. Первичные иммунодефициты – это группа заболеваний, которая
- 16. Аллерги́я (др.-греч. ἄλλος — другой, иной, чужой
- 17. Первая классификация типов гиперчувствительности была создана американским
- 18. Первый тип (I) – атопический, анафилактический или
- 19. Второй тип (II) — цитотоксический. При этом
- 20. Третий тип (III) — иммунокомплексный, при котором
- 21. Четвёртый (IV) тип реакций — гиперчувствительность замедленного
- 22. Отдельно рассматривают реакциию V типа (аллергические
- 23. Причины аутоиммунизации. 1. Продукция
- 24. Слайд 24
Понятие об иммунитете.Иммунитет (лат. immunitas — освобождение, избавление от чего-либо) — это способность иммунной системы избавлять организм от генетически чужеродных объектов. Обеспечивает гомеостаз организма на клеточном и молекулярном уровне организации, генетическую целостность организма на протяжении его индивидуальной жизни.
Слайд 2Понятие об иммунитете.
Иммунитет (лат. immunitas — освобождение, избавление от чего-либо) — это способность иммунной системы
избавлять организм от генетически чужеродных объектов. Обеспечивает гомеостаз организма на клеточном и молекулярном уровне организации, генетическую целостность организма на протяжении его индивидуальной жизни.
иммунитет
врождённый приобретённый
(неспецифический) (специфический)
естественный искусственный
активный пассивный активный пассивный
Неспецифический иммунитет направлен против любого чужеродного вещества (антигена). Он проявляется в виде гуморального, за счет продукции бактерицидных веществ (лизоцима, интерферона, фибропектина), и клеточного, в результате которого осуществляется фагоцитоз и цитотоксический эффект.
Специфический иммунитет направлен против определенного чужеродного вещества. Он тоже реализуется в двух формах - гуморальный (продукция антител В-лимфоцитами и плазматическими клетками) и клеточный, который реализуется главным образом с участием Т-лимфоцитов.
иммунитет
врождённый приобретённый
(неспецифический) (специфический)
естественный искусственный
активный пассивный активный пассивный
Неспецифический иммунитет направлен против любого чужеродного вещества (антигена). Он проявляется в виде гуморального, за счет продукции бактерицидных веществ (лизоцима, интерферона, фибропектина), и клеточного, в результате которого осуществляется фагоцитоз и цитотоксический эффект.
Специфический иммунитет направлен против определенного чужеродного вещества. Он тоже реализуется в двух формах - гуморальный (продукция антител В-лимфоцитами и плазматическими клетками) и клеточный, который реализуется главным образом с участием Т-лимфоцитов.
Слайд 3Принято все виды лимфоцитов разделять в зависимости от выполняемой ими функции.
I.
Т-лимфоциты:
1) клетки, узнающие чужеродный антиген и дающие сигнал началу иммунного ответа; такие клетки получили название антигенреактивные клетки, или клетки иммунологической памяти;
2) клетки-эффекторы, непосредственно выполняющие процесс элиминации чужеродного в генетическом отношении материала; это цитотоксические клетки, или клетки-киллеры (убийцы), или клетки-эффекторы ГЗТ;
3) клетки, помогающие образованию эффекторов, их называют хелперы;
4) клетки, тормозящие начало и осуществляющие прерывание, окончание иммунной реакции организма, их называют супрессоры.
II. В-лимфоциты, вырабатывающие иммуноглобулины.
При встрече с антигеном В-лимфоциты начинают секретировать в окружающее пространство и в кровь антигенспецифические антитела - иммуноглобулины класса М (IgМ) - это 1-ая фаза антителообразования. Затем начинают образовываться иммуноглобулины класса G (IgG), составляющие основной класс Ig в крови - это 2-ая фаза антителообразования.
1) клетки, узнающие чужеродный антиген и дающие сигнал началу иммунного ответа; такие клетки получили название антигенреактивные клетки, или клетки иммунологической памяти;
2) клетки-эффекторы, непосредственно выполняющие процесс элиминации чужеродного в генетическом отношении материала; это цитотоксические клетки, или клетки-киллеры (убийцы), или клетки-эффекторы ГЗТ;
3) клетки, помогающие образованию эффекторов, их называют хелперы;
4) клетки, тормозящие начало и осуществляющие прерывание, окончание иммунной реакции организма, их называют супрессоры.
II. В-лимфоциты, вырабатывающие иммуноглобулины.
При встрече с антигеном В-лимфоциты начинают секретировать в окружающее пространство и в кровь антигенспецифические антитела - иммуноглобулины класса М (IgМ) - это 1-ая фаза антителообразования. Затем начинают образовываться иммуноглобулины класса G (IgG), составляющие основной класс Ig в крови - это 2-ая фаза антителообразования.
Слайд 4Антигены. Это одно из основных понятий в иммунологии. К антигенам относятся:
белки, полисахариды, липополисахариды, нуклеиновые кислоты как в очищенном виде, так и в виде структурных компонентов различных биологических структур (клеток, тканей, вирусов). Обычно это молекулы с большой массой. На поверхности молекулы сложного антигена имеются функциональные группы, которые определяют особенность и специфичность данного вещества. Они получили название антигенных детерминант. Число детерминант на поверхности молекулы определяет валентность антигена.
Антитела. Они выполняют в организме две основные функции. Первая - распознавание и специфическое связывание соответствующих антигенов, вторая - эффекторная: антитело индуцирует физиологические процессы, направленные на уничтожение антигена, - лизис чужеродных клеток через активацию системы комплемента, стимуляцию специализированных иммунокомпетентных клеток, выделение физиологически активных веществ и т.п. По своей химической природе все антитела относятся к гликопротеидам.
Выработка антител возможна при взаимодействии макрофага, Т-хелперов и В-лимфоцитов, получившем название процесса кооперации. Нарушение этого процесса приводит к блокаде выработки антител.
Антитела. Они выполняют в организме две основные функции. Первая - распознавание и специфическое связывание соответствующих антигенов, вторая - эффекторная: антитело индуцирует физиологические процессы, направленные на уничтожение антигена, - лизис чужеродных клеток через активацию системы комплемента, стимуляцию специализированных иммунокомпетентных клеток, выделение физиологически активных веществ и т.п. По своей химической природе все антитела относятся к гликопротеидам.
Выработка антител возможна при взаимодействии макрофага, Т-хелперов и В-лимфоцитов, получившем название процесса кооперации. Нарушение этого процесса приводит к блокаде выработки антител.
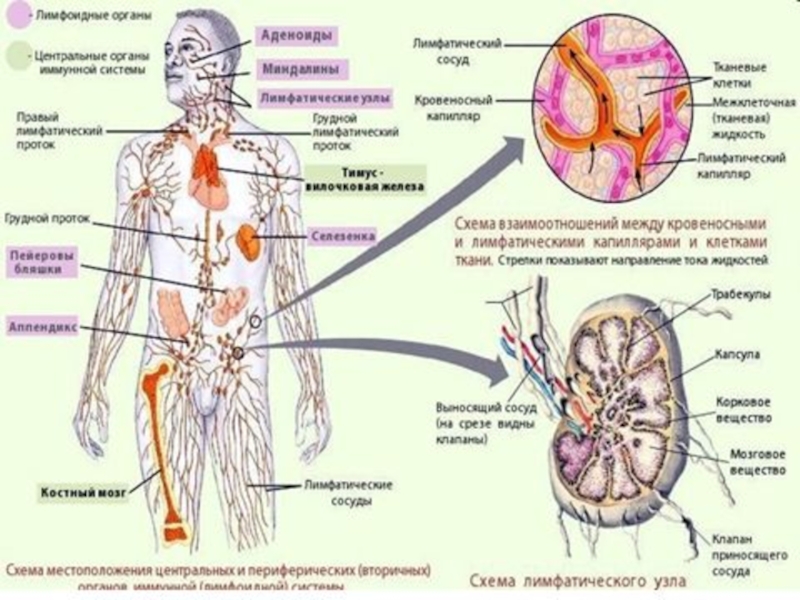
Слайд 5Иммунная система. Иммунитет реализуется иммунной системой.
Под иммунной системой в узком значении слова
обычно понимаются механизмы защиты от чужеродного в генетическом отношении вещества, которые реализуются с участием лимфоцитов. Лимфоциты развиваются из стволовой кроветворной клетки в красном костном мозге. В отличие от других форменных элементов крови, созревание лимфоцитов не ограничивается костным мозгом - здесь лишь возникают родоначальники популяций, а основные этапы развития идут в других областях. Во вторичных органах происходит пролиферация лимфоцитов в ответ на антигенную стимуляцию (на конкретный антиген).
Выделяют центральные и периферические органы иммунной системы.
К центральным органам иммунитета относят: красный костный мозг и тимус.
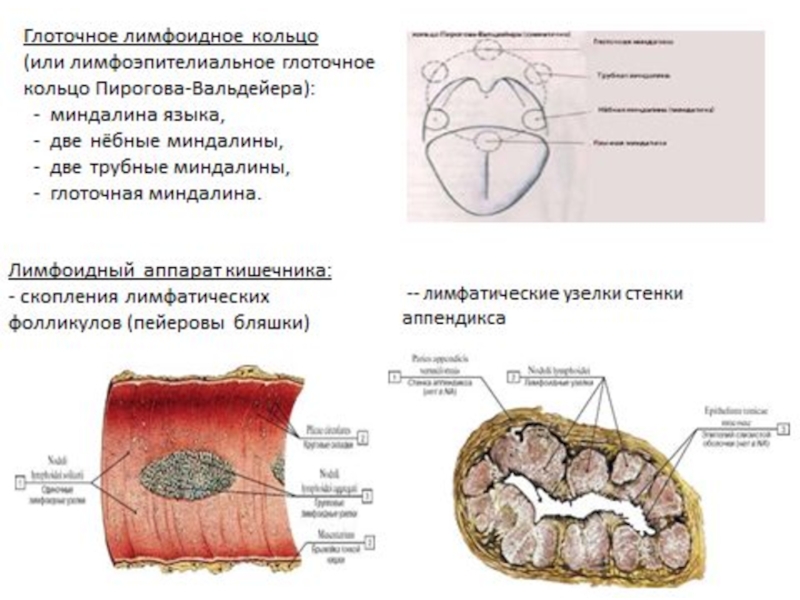
К периферическим органам иммунитета относят: селезёнку, лимфатические узлы, глоточное лимфоидное кольцо (или кольцо Пирогова) а также местноассоциированную лимфоидную ткань (МАЛТ).
Характерными признаками лимфоидных органов являются их ранняя закладка и состояние зрелости уже у новорожденных, а также значительное развитие в детском и подростковом возрасте, когда происходит становление и созревание организма. В дальнейшем отмечается постепенная инволюция (перерождение) как первичных, так и вторичных лимфоидных органов: начиная с юношеского возраста в них уменьшается количество лимфоидной ткани, а на ее месте разрастается жировая ткань.
Выделяют центральные и периферические органы иммунной системы.
К центральным органам иммунитета относят: красный костный мозг и тимус.
К периферическим органам иммунитета относят: селезёнку, лимфатические узлы, глоточное лимфоидное кольцо (или кольцо Пирогова) а также местноассоциированную лимфоидную ткань (МАЛТ).
Характерными признаками лимфоидных органов являются их ранняя закладка и состояние зрелости уже у новорожденных, а также значительное развитие в детском и подростковом возрасте, когда происходит становление и созревание организма. В дальнейшем отмечается постепенная инволюция (перерождение) как первичных, так и вторичных лимфоидных органов: начиная с юношеского возраста в них уменьшается количество лимфоидной ткани, а на ее месте разрастается жировая ткань.
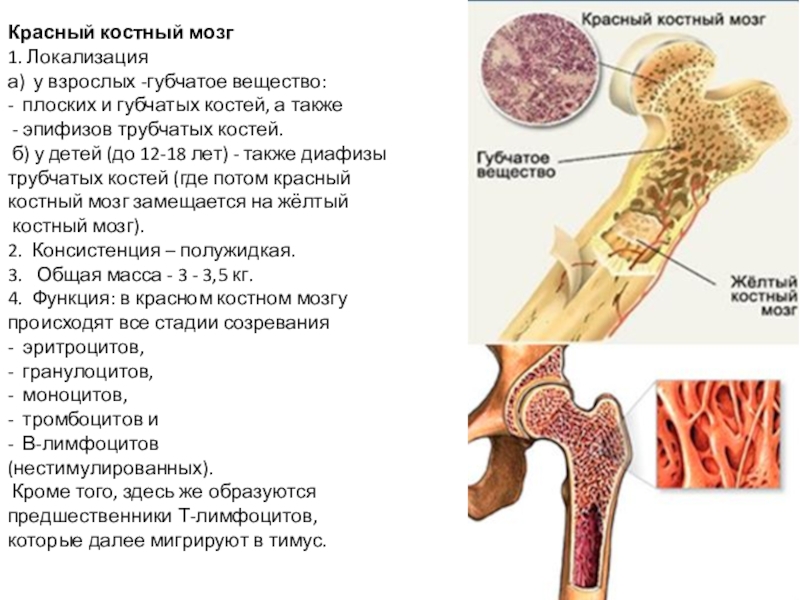
Слайд 8Красный костный мозг
1. Локализация
а) у взрослых -губчатое вещество:
- плоских и губчатых
костей, а также
- эпифизов трубчатых костей.
б) у детей (до 12-18 лет) - также диафизы
трубчатых костей (где потом красный
костный мозг замещается на жёлтый
костный мозг).
2. Консистенция – полужидкая.
3. Общая масса - 3 - 3,5 кг.
4. Функция: в красном костном мозгу
происходят все стадии созревания
- эритроцитов, - гранулоцитов, - моноцитов, - тромбоцитов и - В-лимфоцитов
(нестимулированных).
Кроме того, здесь же образуются
предшественники Т-лимфоцитов,
которые далее мигрируют в тимус.
б) у детей (до 12-18 лет) - также диафизы
трубчатых костей (где потом красный
костный мозг замещается на жёлтый
костный мозг).
2. Консистенция – полужидкая.
3. Общая масса - 3 - 3,5 кг.
4. Функция: в красном костном мозгу
происходят все стадии созревания
- эритроцитов, - гранулоцитов, - моноцитов, - тромбоцитов и - В-лимфоцитов
(нестимулированных).
Кроме того, здесь же образуются
предшественники Т-лимфоцитов,
которые далее мигрируют в тимус.
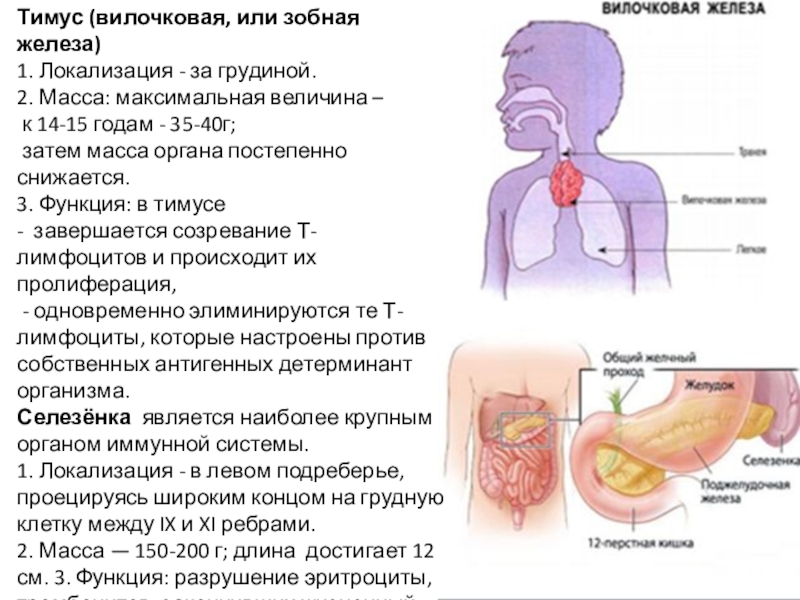
Слайд 9Тимус (вилочковая, или зобная железа)
1. Локализация - за грудиной.
2. Масса: максимальная величина –
к 14-15 годам - 35-40г;
затем
масса органа постепенно снижается.
3. Функция: в тимусе
- завершается созревание Т-лимфоцитов и происходит их пролиферация,
- одновременно элиминируются те Т-лимфоциты, которые настроены против собственных антигенных детерминант организма.
Селезёнка является наиболее крупным органом иммунной системы.
1. Локализация - в левом подреберье, проецируясь широким концом на грудную клетку между IX и XI ребрами.
2. Масса — 150-200 г; длина достигает 12 см. 3. Функция: разрушение эритроциты, тромбоцитов, закончивших жизненный цикл. Кроме того, в ней осуществляется дифференцирование В- и Т-лимфоцитов.
3. Функция: в тимусе
- завершается созревание Т-лимфоцитов и происходит их пролиферация,
- одновременно элиминируются те Т-лимфоциты, которые настроены против собственных антигенных детерминант организма.
Селезёнка является наиболее крупным органом иммунной системы.
1. Локализация - в левом подреберье, проецируясь широким концом на грудную клетку между IX и XI ребрами.
2. Масса — 150-200 г; длина достигает 12 см. 3. Функция: разрушение эритроциты, тромбоцитов, закончивших жизненный цикл. Кроме того, в ней осуществляется дифференцирование В- и Т-лимфоцитов.
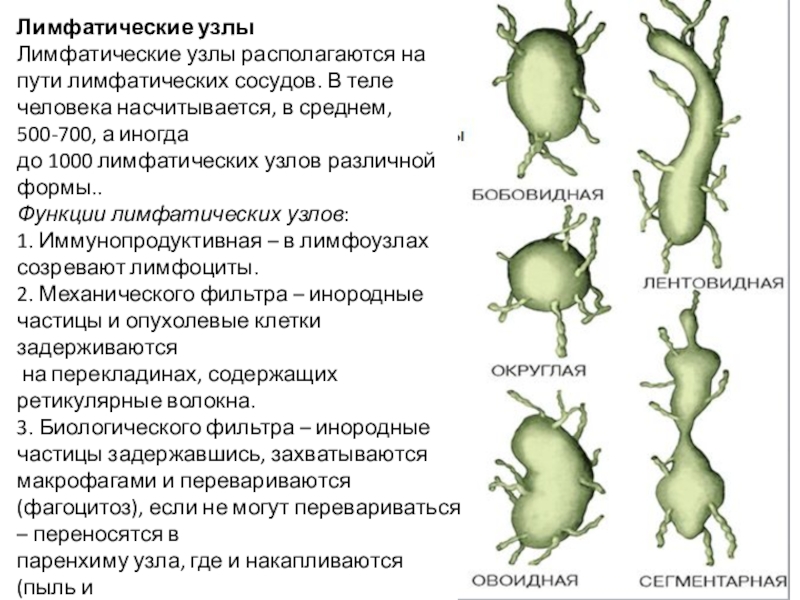
Слайд 10Лимфатические узлы Лимфатические узлы располагаются на пути лимфатических сосудов. В теле человека
насчитывается, в среднем, 500-700, а иногда
до 1000 лимфатических узлов различной формы..
Функции лимфатических узлов: 1. Иммунопродуктивная – в лимфоузлах созревают лимфоциты. 2. Механического фильтра – инородные
частицы и опухолевые клетки задерживаются
на перекладинах, содержащих ретикулярные волокна. 3. Биологического фильтра – инородные
частицы задержавшись, захватываются макрофагами и перевариваются (фагоцитоз), если не могут перевариваться – переносятся в паренхиму узла, где и накапливаются (пыль и
др. инородные частицы) или размножаются (опухолевые клетки). 4. Депо лимфы.
до 1000 лимфатических узлов различной формы..
Функции лимфатических узлов: 1. Иммунопродуктивная – в лимфоузлах созревают лимфоциты. 2. Механического фильтра – инородные
частицы и опухолевые клетки задерживаются
на перекладинах, содержащих ретикулярные волокна. 3. Биологического фильтра – инородные
частицы задержавшись, захватываются макрофагами и перевариваются (фагоцитоз), если не могут перевариваться – переносятся в паренхиму узла, где и накапливаются (пыль и
др. инородные частицы) или размножаются (опухолевые клетки). 4. Депо лимфы.
Слайд 12Дефекы в работе иммунной системы могут проявляться в виде гипореактивности, гиперрееактивности
и извращённой реактивности иммунной системы.
Иммунная толерантность - это отсутствие реакции иммунной системы на антигены или чужеродные белки, в результате чего не образуются антитела и иммунные лимфоциты.
Иммунная толерантность имеет большое значение при трансплантации.
Различают виды иммунной толерантности:
*патологическая; *физиологическая; * искусственная или лечебная.
Примером патологической иммунной толерантности является переносимость опухоли организмом. В этом случае иммунная система слабо реагирует на чужеродные по белковому составу раковые клетки, с чем может быть связан не только рост опухоли, но и её возникновение. Такая патологическая толерантность по механизму развития может быть связана с увеличением образования Т-лимфоцитов супрессоров, ослабляющих нормальные иммунные реакции.
Искусственная (лечебная) иммунная толерантность воспроизводится с помощью воздействий, снижающих активность органов иммунной системы, например, введение иммунодепрессантов, ионизирующим излучением и др. Ослабление активности иммунной системы обеспечивает переносимость организмом пересаженных органов и тканей (трансплантаты).
Иммунная толерантность - это отсутствие реакции иммунной системы на антигены или чужеродные белки, в результате чего не образуются антитела и иммунные лимфоциты.
Иммунная толерантность имеет большое значение при трансплантации.
Различают виды иммунной толерантности:
*патологическая; *физиологическая; * искусственная или лечебная.
Примером патологической иммунной толерантности является переносимость опухоли организмом. В этом случае иммунная система слабо реагирует на чужеродные по белковому составу раковые клетки, с чем может быть связан не только рост опухоли, но и её возникновение. Такая патологическая толерантность по механизму развития может быть связана с увеличением образования Т-лимфоцитов супрессоров, ослабляющих нормальные иммунные реакции.
Искусственная (лечебная) иммунная толерантность воспроизводится с помощью воздействий, снижающих активность органов иммунной системы, например, введение иммунодепрессантов, ионизирующим излучением и др. Ослабление активности иммунной системы обеспечивает переносимость организмом пересаженных органов и тканей (трансплантаты).
Слайд 13Физиологическая иммунная толерантность проявляется переносимостью иммунной системой белков своего организма. В
основе такой толерантности лежит клонально - селекционный механизм или "запоминание" клетками иммунной системы белкового состава своего организма. В процессе созревания организма происходит отбор иммунных клеток, и сохраняются лишь те из них, которые способны переносить собственные белки без образования против них антител или иммунных лимфоцитов. Ткань мозга, щитовидной железы, внутренних половых органов и хрусталика глаза в раннем периоде развития организма не имеет контакта с клетками иммунной системы, и поэтому иммунная система не имеет толерантности к белкам этих тканей. Сохранение этих тканей обеспечивается их изоляцией от иммунной системы с помощью гистогематических барьеров. Нарушение физиологической толерантности к собственным белкам может возникать в результате мутаций клеток иммунной системы и появления так называемых запретных клонов иммунных клеток, а также в результате нарушения гистогематических барьеров указанных выше тканей. Следствием этих нарушений являются аутоиммунные болезни.
Слайд 14Иммунодефицитом называем состояние, для которого характерно снижение функции иммунной системы и
сопротивляемости организма по отношению к инфекционным, аутоаллергическим, онкологическим и другим заболеваниям. При недостаточности иммунной системы частота возникновения опухолей возрастает в 100-200 раз. Морфологическим субстратом при этом может выступать любой орган иммунной системы. Недостаточность может затрагивать лишь один компонент иммунной системы, а также иметь комбинированные формы. Так, синдром приобретённого иммунодефицита (СПИД) - это инфекционное заболевание, поражающее Т-хелперы.
Недостаточность иммунной системы может развиваться и при непосредственном угнетении органов иммунной системы, например, при ионизирующем облучении, введении высоких доз препаратов, угнетающих пролиферацию клеток, при старении.
С точки зрения этиологии (причин развития заболевания) различают первичные и вторичные иммунодефициты.
Вторичные иммунодефициты встречаются гораздо чаще первичных. Обычно вторичные иммунодефициты развиваются на фоне воздействия на организм неблагоприятных факторов окружающей среды или различных инфекций, реже –под влиянием эндогенных факторов. При вторичных иммунодефицитах могут нарушаться либо отдельные компоненты иммунной системы, либо вся система в целом. Большинство вторичных иммунодефицитов (кроме иммунодефицита, вызванного ВИЧ) являются обратимыми и хорошо поддаются лечению.
Недостаточность иммунной системы может развиваться и при непосредственном угнетении органов иммунной системы, например, при ионизирующем облучении, введении высоких доз препаратов, угнетающих пролиферацию клеток, при старении.
С точки зрения этиологии (причин развития заболевания) различают первичные и вторичные иммунодефициты.
Вторичные иммунодефициты встречаются гораздо чаще первичных. Обычно вторичные иммунодефициты развиваются на фоне воздействия на организм неблагоприятных факторов окружающей среды или различных инфекций, реже –под влиянием эндогенных факторов. При вторичных иммунодефицитах могут нарушаться либо отдельные компоненты иммунной системы, либо вся система в целом. Большинство вторичных иммунодефицитов (кроме иммунодефицита, вызванного ВИЧ) являются обратимыми и хорошо поддаются лечению.
Слайд 15Первичные иммунодефициты – это группа заболеваний, которая характеризуется снижением функции иммунной
системы, происходящим на фоне различных генетических нарушений. Встречаются первичные иммунодефициты довольно редко, порядка 1-2 случаев на 500.000 человек. При первичных иммунодефицитах, как и при вторичных, могут нарушаться отдельные составляющие иммунитета: клеточное звено, гуморальный ответ, система фагоцитов и комплимента, - либо вся иммунная система в целом. Первичные иммунодефициты присутствуют на протяжении всей жизни. Больные с первичным иммунодефицитом, как правило, умирают от различных инфекционных осложнений.
Одной из наиболее тяжёлых форм иммунного дефицита является наследственное заболевание, для которого характерно отсутствие в костном мозге родоначальных гемопоэтических стволовых клеток. Т.к. из этих клеток развиваются и клетки красной крови, и моноциты, и лимфоциты, и тромбоциты, при данном заболевании возникает недостаточность всех компонентов иммунной системы. Больные обычно погибают в раннем детском возрасте от инфекций, протекающих исключительно тяжело.
Одной из наиболее тяжёлых форм иммунного дефицита является наследственное заболевание, для которого характерно отсутствие в костном мозге родоначальных гемопоэтических стволовых клеток. Т.к. из этих клеток развиваются и клетки красной крови, и моноциты, и лимфоциты, и тромбоциты, при данном заболевании возникает недостаточность всех компонентов иммунной системы. Больные обычно погибают в раннем детском возрасте от инфекций, протекающих исключительно тяжело.
Слайд 16Аллерги́я (др.-греч. ἄλλος — другой, иной, чужой + ἔργον — воздействие)
— сверхчувствительность иммунной системы организма при повторных воздействиях аллергена на ранее сенсибилизированный этим аллергеном организм. Термин «аллергия» был введён венским педиатром Клеменсом фон Пирке в 1906 г. Он заметил, что у некоторых из его пациентов наблюдаемые симптомы могли быть вызваны определёнными веществами (аллергенами) из окружающей среды: пылью, пыльцой растений, некоторыми видами пищи.
Аллерген - это вещество вызывающее аллергическую реакцию.
Сенсибилизация - повышенная чувствительность всего организма или отдельных его частей к воздействию какого-либо фактора внешней или внутренней среды.
Аллергическая реакция - это клиническое проявление повышенной чувствительности к аллергену. Ее условно делят на три стадии:
1) иммунную (формируется от начала контакта организма с аллергеном, при этом происходит усиленное образование аллергических антител),
2) патохимическую (проявляется образованием в гуморальных средах и тканях организма комплексов антиген – антителов; в результате химических реакций в организме вырабатываются: анафилотоксины, кинины, лимфокины);
3) патофизиологическую (представляет собой результат действия медиаторов аллергии на клетки, ткани, органы и физиологические системы).
Аллерген - это вещество вызывающее аллергическую реакцию.
Сенсибилизация - повышенная чувствительность всего организма или отдельных его частей к воздействию какого-либо фактора внешней или внутренней среды.
Аллергическая реакция - это клиническое проявление повышенной чувствительности к аллергену. Ее условно делят на три стадии:
1) иммунную (формируется от начала контакта организма с аллергеном, при этом происходит усиленное образование аллергических антител),
2) патохимическую (проявляется образованием в гуморальных средах и тканях организма комплексов антиген – антителов; в результате химических реакций в организме вырабатываются: анафилотоксины, кинины, лимфокины);
3) патофизиологическую (представляет собой результат действия медиаторов аллергии на клетки, ткани, органы и физиологические системы).
Слайд 17Первая классификация типов гиперчувствительности была создана американским врачом Робертом Куком в
1947 г. Он выделял два типа гиперчувствительности:
1) гиперчувствительность немедленного типа, обусловленную гуморальными иммунными механизмами и развивающуюся через 20-30 минут (в основе лежит нарушение деятельности β-лимфоцитов и участие в аллергических реакциях иммуноглобулинов), и
2) гиперчувствительность замедленного типа, обусловленную клеточными гуморальными иммунными механизмами, возникающую через 6-8 ч после контакта с антигеном (основная роль принадлежит взаимодействию аллергена с сенсибилизированными Т-лимфоцитами) .
На сегодняшний день по патогенезу различают 4 типа реакций гиперчувствительности,
На практике типы гиперчувствительности необязательно встречаются порознь.
Несмотря на то, что все 4 типа реагирования считаются реакциями гиперчувствительности, термин «аллергия» был сохранён за первым типом реакций. Под истинной аллергией понимают только такие патологические иммунные реакции, которые протекают по механизму атопии, т.е. по I типу, а реакции II, III и IV типов (цитотоксические, иммунокомплексные и клеточные) типов относят к аутоиммунной патологии.
1) гиперчувствительность немедленного типа, обусловленную гуморальными иммунными механизмами и развивающуюся через 20-30 минут (в основе лежит нарушение деятельности β-лимфоцитов и участие в аллергических реакциях иммуноглобулинов), и
2) гиперчувствительность замедленного типа, обусловленную клеточными гуморальными иммунными механизмами, возникающую через 6-8 ч после контакта с антигеном (основная роль принадлежит взаимодействию аллергена с сенсибилизированными Т-лимфоцитами) .
На сегодняшний день по патогенезу различают 4 типа реакций гиперчувствительности,
На практике типы гиперчувствительности необязательно встречаются порознь.
Несмотря на то, что все 4 типа реагирования считаются реакциями гиперчувствительности, термин «аллергия» был сохранён за первым типом реакций. Под истинной аллергией понимают только такие патологические иммунные реакции, которые протекают по механизму атопии, т.е. по I типу, а реакции II, III и IV типов (цитотоксические, иммунокомплексные и клеточные) типов относят к аутоиммунной патологии.
Слайд 18Первый тип (I) – атопический, анафилактический или реагиновый тип — обусловлены
антителами класса IgE. При взаимодействии аллергена с IgE, фиксированными на поверхности тучных клеток, происходит активация этих клеток и высвобождение депонированных и вновь образованных медиаторов аллергии с последующим развитием аллергической реакции. Примеры таких реакций – анафилактический шок, отёк Квинке, поллиноз, бронхиальная
астма.
Анафилактический шок - это тяжёлая общая реакция организма, развивающаяся при введении различных веществ белковой природы (сыворотки и вакцины, анатоксин, экстракты из органов, яды насекомых и животных), лекарственных препаратов (пенициллин, анальгин, сульфаниламиды, стрептомицин, новокаин, витамины группы В и др.), может развиться в ответ на бактериальные токсины.
Тяжесть анафилактического шока в значительной мере определяется промежутком времени от момента поступления антигена в организм до развития шоковой реакции. В зависимости от этого выделяют:
- молниеносную форму (развивается в течение 1-2 мин);
- тяжёлую форму (развивается через 5-7 мин);
- шок средней тяжести (через 30 мин).
Для профилактики анафилаксии в медицинской практике используют метод десенсибилиза-ции - за 2-4 ч до введения необходимого количества сыворотки вводят небольшую ее дозу (0,5-1,0 мл), а затем при отсутствии реакции вводят всю остальную сыворотку.
астма.
Анафилактический шок - это тяжёлая общая реакция организма, развивающаяся при введении различных веществ белковой природы (сыворотки и вакцины, анатоксин, экстракты из органов, яды насекомых и животных), лекарственных препаратов (пенициллин, анальгин, сульфаниламиды, стрептомицин, новокаин, витамины группы В и др.), может развиться в ответ на бактериальные токсины.
Тяжесть анафилактического шока в значительной мере определяется промежутком времени от момента поступления антигена в организм до развития шоковой реакции. В зависимости от этого выделяют:
- молниеносную форму (развивается в течение 1-2 мин);
- тяжёлую форму (развивается через 5-7 мин);
- шок средней тяжести (через 30 мин).
Для профилактики анафилаксии в медицинской практике используют метод десенсибилиза-ции - за 2-4 ч до введения необходимого количества сыворотки вводят небольшую ее дозу (0,5-1,0 мл), а затем при отсутствии реакции вводят всю остальную сыворотку.
Слайд 19
Второй тип (II) — цитотоксический. При этом типе аллергенами становятся собственные
клетки организма, мембрана которых приобрела свойства аутоаллергенов. Это происходит в основном при их повреждении в результате воздействия лекарств, ферментов бактерий или вирусов, в результате чего клетки изменяются и воспринимаются иммунной системой как антигены. В любом случае для возникновения этого типа аллергии, антигенные структуры должны приобрести свойства аутоантигенов. Цитотоксический тип обусловлен IgG- или IgM, которые направлены против АГ, расположенных на видоизменённых клетках собственных тканей организма. Связывание AТ с АГ на поверхности клетки приводит к активации комплемента, который вызывает повреждение и разрушение клеток, последующий фагоцитоз и удаление их. Связываясь с IgG, они участвуют в формировании антителозависимой клеточной цитотоксичности. Именно по цитотоксическому типу происходит развитие аутоиммунной гемолитической анемии, лекарственной аллергии, аутоиммунного тиреоидита.
Слайд 20
Третий тип (III) — иммунокомплексный, при котором ткани организма повреждаются циркулирующими
иммунными комплексами с участием IgG- или IgM, имеющими большую молекулярную массу. Т.о. при III типе, так же, как и при II, реакции обусловлены IgG и IgM. Но в отличие от II типа, при аллергической реакции III типа антитела взаимодействуют с растворимыми антигенами, а не с находящимися на поверхности клеток. Образовавшиеся иммунные комплексы длительно циркулируют в организме и фиксируются в капиллярах различных тканей, где активируют систему комплемента, вызывая приток лейкоцитов, высвобождение гистамина, серотонина, лизосомальных ферментов, повреждающих эндотелий сосудов и ткани, в которых фиксирован иммунный комплекс. Этот тип реакций является основным при сывороточной болезни, лекарственной и пищевой аллергии, при некоторых аутоаллергических болезнях ( системная красная волчанка, ревматоидный артрит ).
Слайд 21Четвёртый (IV) тип реакций — гиперчувствительность замедленного типа или клеточно-опосредованная гиперчувствительность.
Реакции замедленного типа развиваются в сенсибилизированном организме через 24-48 часов после контакта с аллергеном. При IV типе реакций роль антител выполняют сенсибилизированные Т-лимфоциты. АГ, контактируя с АГ-специфическими рецепторами на Т-клетках, приводит к увеличению количества этой популяции лимфоцитов и их активации с выделением медиаторов клеточного иммунитета — воспалительных цитокинов. Цитокины вызывают скопление макрофагов и других лимфоцитов, вовлекают их в процесс разрушения АГ, в результате чего возникает воспаление. Клинически это проявляется развитием гиперергического воспаления: образуется клеточный инфильтрат, клеточную основу которого составляют мононуклеары — лимфоциты и моноциты. Клеточный тип реакции лежит в основе развития вирусных и бактериальных инфекций (контактный дерматит, туберкулез, микозы, сифилис, лепра, бруцеллез), некоторых форм инфекционно-аллергической бронхиальной астмы, реакции отторжения трансплантата и противоопухолевого иммунитета.
Слайд 22
Отдельно рассматривают реакциию V типа (аллергические реакции аутоантител) — изменение
(утрата или усиление) активности белковых молекул под влиянием аутоантител. Например, аутоантитела к инсулину или к инсулиновым рецепторам клеток инактивируют (нейтрализуют) их, следствием чего может быть развитие сахарного диабета 1-го типа. Аутоантитела к фолликулярным тиреоцитам, напротив, через специальные цитолеммальные рецепторы стимулируют эти клетки и увеличивают продукцию ими тиреоидных гормонов, что является причиной болезни Грейвса, протекающей с клиникой тиреотоксикоза. Следовательно, реакции V типа можно подразделить на два варианта: (1) реакции нейтрализации (инактивации) и (2) реакции стимуляции активности белков организма.
Аутоиммунизация (аутоиммунный ответ) — иммунный ответ на собственные антигены.
Аутоиммунные болезни — заболевания, при которых аутоаллергия является основным звеном патогенеза.
Различают три основных признака аутоиммунных заболеваний:
- наличие аутоиммунной реакции;
- наличие клинических и экспериментальных данных, что такая реакция на повреждение ткани не вторична, а имеет первичное патогенетическое значение;
- отсутствие иных определённых причин болезни.
Аутоиммунизация (аутоиммунный ответ) — иммунный ответ на собственные антигены.
Аутоиммунные болезни — заболевания, при которых аутоаллергия является основным звеном патогенеза.
Различают три основных признака аутоиммунных заболеваний:
- наличие аутоиммунной реакции;
- наличие клинических и экспериментальных данных, что такая реакция на повреждение ткани не вторична, а имеет первичное патогенетическое значение;
- отсутствие иных определённых причин болезни.
Слайд 23 Причины аутоиммунизации.
1. Продукция патологических антител или патологических
киллерных клеток может быть связана с инфицированием организма таким инфекционным агентом, антигенные детерминанты (эпитопы) важнейших белков которого напоминают антигенные детерминанты нормальных тканей организма хозяина.
2. Аутоиммунная реакция может быть также связана с вызванной инфекционным агентом деструкцией или некрозом тканей, или изменением их антигенной структуры так, что патологически изменённая ткань становится иммуногенной для организма хозяина.
3. Нарушение целостности тканевых (гисто-гематических) барьеров, в норме отделяющих некоторые органы и ткани от крови и, соответственно, от иммунной агрессии лимфоцитов хозяина. При этом, поскольку в норме антигены этих тканей в кровь вообще не попадают, тимус в норме не производит негативной селекции (уничтожения) аутоагрессивных лимфоцитов против этих тканей. Но это не мешает нормальному функционированию органа до тех пор, пока цел тканевой барьер, отделяющий данный орган от крови.
Большинство аутоиммунных заболеваний являются хроническими. В их развитии есть периоды обострений и ремиссий. Как правило, хронические аутоиммунные заболевания приводят к серьёзным нарушениям функции внутренних органов и инвалидизации больного.
2. Аутоиммунная реакция может быть также связана с вызванной инфекционным агентом деструкцией или некрозом тканей, или изменением их антигенной структуры так, что патологически изменённая ткань становится иммуногенной для организма хозяина.
3. Нарушение целостности тканевых (гисто-гематических) барьеров, в норме отделяющих некоторые органы и ткани от крови и, соответственно, от иммунной агрессии лимфоцитов хозяина. При этом, поскольку в норме антигены этих тканей в кровь вообще не попадают, тимус в норме не производит негативной селекции (уничтожения) аутоагрессивных лимфоцитов против этих тканей. Но это не мешает нормальному функционированию органа до тех пор, пока цел тканевой барьер, отделяющий данный орган от крови.
Большинство аутоиммунных заболеваний являются хроническими. В их развитии есть периоды обострений и ремиссий. Как правило, хронические аутоиммунные заболевания приводят к серьёзным нарушениям функции внутренних органов и инвалидизации больного.