коэффициентов в уравнении.
Найти соответствующие точки.
Последовательно соедините точки.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Урок-презентация Типы химических реакций
Содержание
- 1. Урок-презентация Типы химических реакций
- 2. Расшифруйте замаскированный химический элемент.По порядку уравнять химические
- 3. Расшифруйте замаскированный химический элемент. C + O2
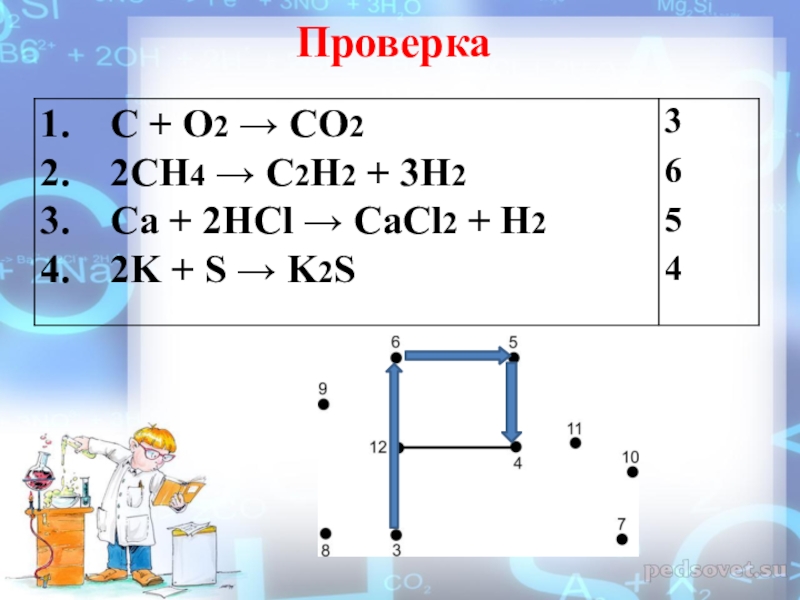
- 4. Проверка
- 5. Слайд 5
- 6. Д.И. Менделеев«Мощь и сила науки во множестве фактов, цель – в обобщении этого множества»
- 7. «Типы химических реакций»Тема урока:
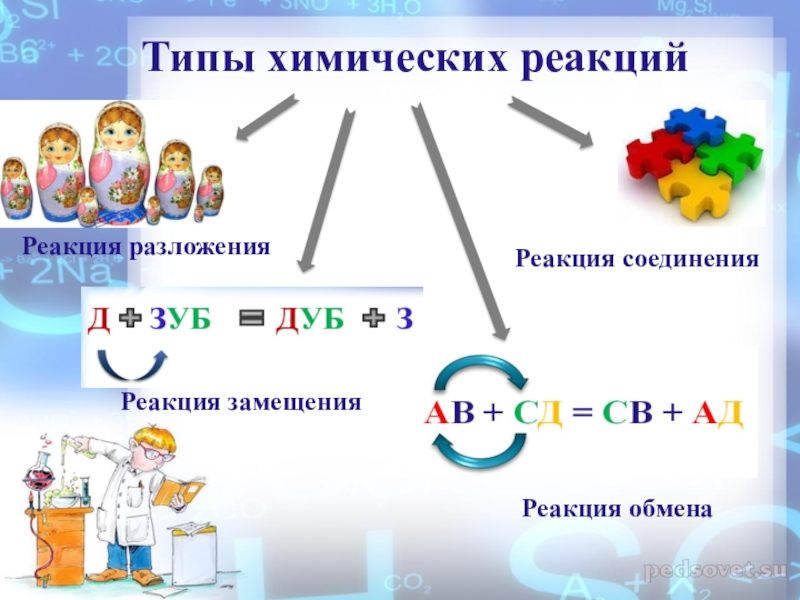
- 8. Типы химических реакцийРеакция разложенияРеакция соединенияРеакция замещенияРеакция обмена
- 9. Помогите Юре заполнить таблицу.
- 10. Что общего в данных реакциях?2Н2О = 2Н2↑
- 11. Реакция разложенияреакция, в результате которой
- 12. Проверка
- 13. Что общего в данных реакциях?2Mg + O2 = 2MgOBaO + H2O = Ba(OH)2Fe + S =FeS
- 14. Реакция соединенияреакция, в результате которой из двух
- 15. Проверка
- 16. Что общего в данных реакциях?Zn + 2HCl
- 17. Реакция замещенияреакция между простым и сложным веществами,
- 18. Проверка
- 19. Реакция разложения
- 20. Реакция соединения
- 21. Реакция замещения
- 22. Техника безопасности
- 23. Лабораторный опыт
- 24. Проверка
- 25. Согласны ли вы, что:В реакции Ca +
- 26. Проверка
- 27. РефлексияОцените свою работу на уроке с позиции:
- 28. Спасибо за работу!
Расшифруйте замаскированный химический элемент.По порядку уравнять химические реакции. Подсчитать сумму коэффициентов в уравнении.Найти соответствующие точки.Последовательно соедините точки.
Слайд 2Расшифруйте замаскированный химический элемент.
По порядку уравнять химические реакции.
Подсчитать сумму
Слайд 3Расшифруйте замаскированный химический элемент.
C + O2 → CO2
2. CH4 → C2H2 + H2
3. Ca + HCl → CaCl2 + H2
4. K + S → K2S
Слайд 11 Реакция разложения
реакция, в результате которой
из одного сложного вещества
образуются два или несколько простых или сложных веществ.
Слайд 14Реакция соединения
реакция, в результате которой из двух или нескольких простых или
сложных веществ образуется одно более сложное вещество.
Слайд 16Что общего в данных реакциях?
Zn + 2HCl = ZnCl2 + H2↑
H2
+ CuO = H2O + Cu
2Al + Fe2O3 = Al2O3 + 2Fe
2Al + Fe2O3 = Al2O3 + 2Fe
Слайд 17Реакция замещения
реакция между простым и сложным веществами,
в результате которой
атомы
простого вещества замещают атомы одного из элементов в сложном веществе.
Слайд 25Согласны ли вы, что:
В реакции Ca + Cl2→ CaCl2 коэффициенты не
нужны.
Реакция Zn + 2HCl → ZnCl2 + H2 относится к реакциям замещения.
Реакция 2Ca + O2 → 2CaO относится к реакциям обмена.
В реакции CH4 → C + H2 коэффициенты не нужны.
Реакция CuO + H2 → Cu + H2O относится к реакциям разложения.
Реакция 2C + O2 → 2CO относится к реакциям соединения.
В реакции CuCl2 + Fe → Cu + FeCl2 коэффициенты не нужны.
Реакция Zn + 2HCl → ZnCl2 + H2 относится к реакциям замещения.
Реакция 2Ca + O2 → 2CaO относится к реакциям обмена.
В реакции CH4 → C + H2 коэффициенты не нужны.
Реакция CuO + H2 → Cu + H2O относится к реакциям разложения.
Реакция 2C + O2 → 2CO относится к реакциям соединения.
В реакции CuCl2 + Fe → Cu + FeCl2 коэффициенты не нужны.
Слайд 27Рефлексия
Оцените свою работу на уроке с позиции:
Я научился (ась) …
Я
узнал (а) …
Мне было сложно понять …