Степень окисления азота -3.
5. Взаимодействует с кислотами с образованием солей.
6. В молекуле между атомами ковалентная полярная связь.
7. Взаимодействует с водородом в присутствии катализатора.
8. Он проявляет только восстановительные свойства.
9. Используют как азотное удобрение.
10. Легче воздуха.
11. Используют в медицине.
12. Хорошо растворим в воде.
13. Инертный газ.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад урока по химии по теме: Соли аммония
Содержание
- 1. Презентация урока по химии по теме: Соли аммония
- 2. ПроверкаI ВАРИАНТ 1, 2, 3, 7, 10,
- 3. СОЛИ АММОНИЯ
- 4. Разминка Напиши формулы солей:Хлорид аммонияНитрат аммонияСульфат аммония Фосфат аммония Проверь себя:NH4ClNH4NO3(NH4)2SO4(NH4)3PO4
- 5. Физические свойстваСоли аммония :а) твёрдые вещества;б) имеют ионную кристаллическую решетку;в) хорошо растворимы в воде.
- 6. Химические свойстваОбщие свойства солей: 1. Взаимодействие
- 7. Химические свойстваОсобые свойства солей аммония. Термическое разложение:1.
- 8. Применение солей аммонияв пиротехнике, при взрывных работах;в
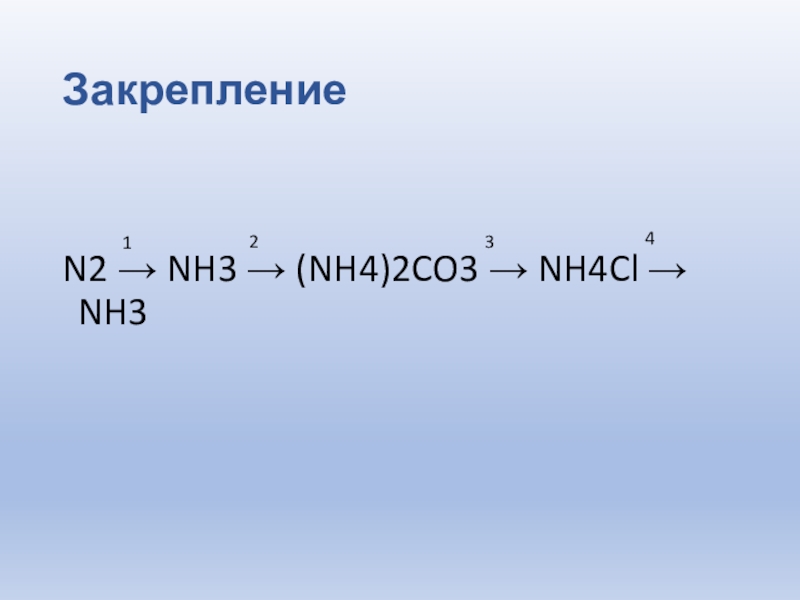
- 9. ЗакреплениеN2 → NH3 → (NH4)2CO3 → NH4Cl → NH3 1234
ПроверкаI ВАРИАНТ 1, 2, 3, 7, 10, 11, 13II ВАРИАНТ 1, 3, 4, 5, 6, 8, 9, 10, 11, 12
Слайд 1Выбери верное утверждение
1. Газообразный при обычных условиях.
2. Не имеет запаха.
3. Бесцветный.
4.
Слайд 4Разминка
Напиши формулы солей:
Хлорид аммония
Нитрат аммония
Сульфат аммония
Фосфат аммония
Проверь себя:
NH4Cl
NH4NO3
(NH4)2SO4
(NH4)3PO4
Слайд 5Физические свойства
Соли аммония :
а) твёрдые вещества;
б) имеют ионную кристаллическую решетку;
в) хорошо
растворимы в воде.
Слайд 6Химические свойства
Общие свойства солей:
1. Взаимодействие с кислотами:
(NH4 )2СО3 + 2HCl 2NH4Cl +
CO2 + H2O
2. Взаимодействие со щелочами:
NH4Cl+ NaOH NH3↑ + H2O + NaCl
(качественная реакция)
3. Взаимодействие с солями:
NH4Cl + AgNO3 NH4NO3 + AgCl↓
2. Взаимодействие со щелочами:
NH4Cl+ NaOH NH3↑ + H2O + NaCl
(качественная реакция)
3. Взаимодействие с солями:
NH4Cl + AgNO3 NH4NO3 + AgCl↓
Слайд 7Химические свойства
Особые свойства солей аммония. Термическое разложение:
1. Соли кислот слабых окислителей:
NH4Cl NH3
↑+ HCl
2. Соли кислот сильных окислителей:
(NH4)2Cr2O7 → N2 ↑ + Cr2O3 + 4H2O
2. Соли кислот сильных окислителей:
(NH4)2Cr2O7 → N2 ↑ + Cr2O3 + 4H2O
Слайд 8Применение солей аммония
в пиротехнике, при взрывных работах;
в хлебопечении и кондитерской промышленности;
в
сельском хозяйстве – удобрения;
при паянии металлов.
при паянии металлов.